miRNA-155靶向Wnt5a调控转录激活子3信号通路在支气管哮喘发生发展中的作用
梁 音,张 剑,王新卫,刘新年,张海英
0 引 言
支气管哮喘(简称哮喘)是一种慢性气道炎性疾病,其特征主要是气道慢性炎症、气道高反应、气道重塑,发病率和死亡率在全世界范围内呈逐渐上升趋势,是危害人类健康的常见疾病之一,已成为世界性的公共卫生难题。目前,该病病因被认为是由多种细胞参与的慢性气道炎症所致,其中包括多种细胞(如气道上皮细胞、T淋巴细胞、中性粒细胞等)和细胞组分等[1-3]。miRNA-155是一种多功能非蛋白编码的小RNA,在各种生理和病理过程中发挥作用,包括炎症、免疫和造血。此外,除自身免疫性疾病如类风湿性关节炎外,miRNA-155在不同过敏性疾病和特应性皮炎的发病机制中也具有重要作用,miRNA-155的过度表达已被证实与哮喘的发展和促过敏细胞的激活有关[4-6]。Wnt5a是Wnt蛋白家族中非常重要的成员之一,在炎症性疾病中发挥重要而复杂的作用。有研究发现,Wnt5a在炎症反应中既能诱导炎症因子发挥促炎作用,又能诱导某些抑炎因子发挥抗炎作用[7]。信号转导子和转录激活子3(Signal transducer and activator of transcription 3,STAT3)是在炎症和癌症中通过磷酸化从细胞质穿梭到核而被激活[8]。研究表明,STAT3对炎性细胞因子的产生至关重要,它们的激活与气道炎症的发生有关[9]。本研究旨在探讨miRNA-155通过Wnt5a调控STAT3信号通路在哮喘发生发展中的作用,为临床治疗哮喘提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物健康SD雄性大鼠共36只,8~12周,体重250~270 g,购自中国科学院昆明动物研究所,实验动物合格证号:SYXK(滇)K2017-0009。大鼠饲养期间光照明暗交替周期为12 h、温度23~25 ℃,相对湿度40%~70%。
1.1.2 实验试剂miRNA-155抑制物及阴性对照(上海吉玛生物公司)、LipofectamineTM-2000、TRIzol Reagent、miRNA-155、U6引物(均购自美国Invitrogen公司)、Wnt5a、GAPDH普通PCR上下游引物(北京六合华大基因科技股份有限公司)、SYBR Green PCR Master Mix(TaKaRa)、RevertAid First Strand cDNA Synthesis Kit(Thermo Scientific)、人气道上皮细胞-16-HBE细胞(上海博谷生物科技有限公司)、DMEM培养基(赛默飞世尔科技(中国)有限公司)、中性树胶(国药集团化学试剂有限公司)、HE染液(武汉赛维尔生物科技有限公司)、RIPA裂解液(北京索莱宝科技有限公司)、BCA蛋白浓度测定试剂盒(Thermo公司)、ECL化学发光试剂盒(Elabscience公司)、Wnt5a兔抗鼠单抗、STAT3兔抗鼠单抗(均购自Abcam公司)、p-STAT3兔抗鼠单抗(美国CST公司)、HRP标记山羊抗兔IgG(Santa Cruze公司)、大鼠IL-6、TNF-α ELISA试剂盒(均购自南京建成生物工程研究所);其余试剂均为国产分析纯。
1.1.3 主要仪器Mater Screen Paed肺功能仪(德国耶格公司)、实时荧光定量PCR仪(Bio-Rad公司)、Centrifuge5810R型高速冷冻离心机(德国Eppendorf公司)、电泳仪和转膜仪(Bio-Rad公司)、酶标仪(Thermo公司)、摇床(上海精密仪器制造公司)、化学发光成像系统(GE公司)、脱水机和包埋机(武汉俊杰电子有限公司 )、HM315-标准的轮转切片机(德国美康公司)、正置光学显微镜(德国莱卡公司)。
1.2 建立动物模型和分组参照文献[10]建立哮喘大鼠模型,第1、8天分别腹腔内注射10% 卵清蛋白(OVA)和10%氢氧化铝混合液1.0 mL(OVA和氢氧化铝各10 g加入100 mL无菌等渗盐水中)致敏,于OVA致敏后第15天开始雾化激发,将大鼠置于一密闭玻璃容器(40 cm×50 cm×60 cm)中,给予1% OVA(1 g OVA加入100 mL无菌等渗盐水中)雾化吸入(雾粒直径3~5 μm),每周激发5次,每次30 min,以大鼠出现呼吸加快,口唇发绀、站立不稳等表现为激发成功,连续激发8周。将SD大鼠按随机数字表法分为正常对照组、阴性对照组和miRNA-155表达抑制组,每组12只,阴性对照组大鼠在哮喘模型建立后转染NC 拮抗物;miRNA-155表达抑制组大鼠在哮喘模型建立后转染miRNA-155 拮抗物;正常对照组以等渗盐水代替OVA致敏和激发,连续处理7 d后处死观察。麻醉处死后取肺组织。
1.3 观察指标
1.3.1 采用肺功能检测仪进行肺功能检测将大鼠麻醉后固定于手术板,打开喉镜行气管插管,然后连接Mater Screen Paed肺功能仪,测定用力肺活量(FVC)、第一秒用力呼气量(FEV1)、一秒率(FEV1/ FVC)、呼气峰流量(PEF)。
1.3.2 采用HE染色法观察肺组织损伤情况将肺组织用0.9%等渗盐水漂洗、滤纸、吸干,放入4%多聚甲醛固定液中固定48 h,然后进行脱水、石蜡包埋、切片。病理切片厚度为4 μm。将病理切片放置于65 ℃烘箱2 h后,依次放入二甲苯20 min、无水乙醇、95%乙醇、90%乙醇、85%乙醇、75%乙醇、50%乙醇各5 min。苏木精、酒精-伊红染色,中性树脂封固,镜下观察组织形态及病理改变。
1.3.3 采用RT-PCR法检测各组大鼠肺组织miRNA-155、Wnt5a mRNA表达水平Trizol法提取大鼠肺组织总RNA,逆转录获得cDNA,采用SYBR Green I实时荧光定量PCR方法检测各组miRNA-155和Wnt5a基因的表达水平。引物设计如下:miRNA-155上5′-CGTTAATGCTAATCGTGATAG-3′,下游5′-GCAGGGTCCGAGGT-3′;U6上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGAATTTGCGT-3′;Wnt5a上5′-CATCGGAGCACAGCCTCTCTG-3′,下游5′-CACTCTTTGATGCCCGTCTT-3′;GAPDH上游5′-TCCATGACAACTTTGGCATTG-3′,下游5′-TCACGCCACAGCTTTCCA-3′。反应条件:95 ℃预变性3 min;95 ℃变性10 s,59 ℃退火10 s,72 ℃延伸15 s,共40个循环。每个样本重复检测3次。每组miRNA-155、Wnt5a基因的相对表达量按公式(2-△△Ct法)计算。
1.3.4 双荧光素酶报告基因实验采用生物信息学软件TargetScan等数据库分析miRNA-155的靶基因,结果显示Wnt5a基因3′端存在miRNA-155的结合位点,提示Wnt5a可能是miRNA-155的直接靶基因。采用双荧光素酶报告基因实验验证该结果,分别扩增出含miRNA-155结合位点的Wnt5a 3′UTR及miRNA-155结合位点突变的Wnt5a 3′UTR系列,将其插入到荧光素酶报告基因载体上,构建野生型Wnt5a-Wt和突变型Wnt5a-Mut重组质粒。将人气道上皮细胞(16-HBE细胞)接种到含10%胎牛血清和1%青链霉素双抗的DMEM培养基中,37 ℃培养24 h,分别将Wnt5a-Wt重组质粒、Wnt5a-Mut重组质粒与miRNA-155 Inhibitor或miRNA-155Inhibitor NC共转染至人气道上皮细胞(16-HBE细胞)中,置于37 ℃培养箱继续培养48 h,收集并裂解细胞,使用双荧光素酶报告基因分析。
1.3.5 采用Western blot法检测各组大鼠肺组织Wnt5a、STAT3、p-STAT3的蛋白表达水平取肺组织加入RIPA裂解液提取总蛋白,BCA法测定蛋白浓度,取50 μg上样经10%SDS-PAGE凝胶电泳后,半干转至PVDF膜上,将目的条带用5%脱脂奶粉中封闭1 h,TBST洗膜后加入一抗(1∶2000稀释),4 ℃过夜孵育,TBST洗膜后再加入辣根过氧化物酶标记的二抗(1∶3000稀释),室温下1 h,TBST洗膜后以ECL化学发光,于暗室成像拍照,以GAPDH为内标蛋白,计算各组蛋白相对表达水平。
1.3.6 采用ELISA法分别检测肺组织匀浆IL-6、TNF-α表达水平取肺组织置于玻璃匀浆器中,按体重体积比1∶9加入等渗盐水在冰浴中充分研磨,制成10%肺匀浆,然后以离心半径12 cm、5000 r/min离心10 min取上清,ELISA法检测各组大鼠肺匀浆中炎性细胞因子IL-6、TNF-α的表达水平。

2 结 果
2.1 各组大鼠肺功能结果与正常对照组相比,阴性对照组、miRNA-155表达抑制组大鼠肺功能指标FVC、PEF 、FEV1均显著降低(P<0.05),FEV1/FVC升高(P<0.05);与阴性对照组相比,miRNA-155表达抑制组大鼠FVC、PEF 、FEV1和FEV1/FVC差异均有统计学意义(P<0.05)。见表1。

表1 各组大鼠肺功能结果
2.2 各组大鼠肺组织病理形态学比较光镜下观察结果发现,正常对照组肺组织及支气管上皮结构完整、肺泡腔清晰、纤毛排列整齐、基本无或偶见少量炎症反应;阴性对照组肺泡结构被破坏,肺泡壁弥漫性增厚,有明显的炎性细胞浸润;miRNA-155表达抑制组病理改变较组明显减轻,表明抑制miRNA-155表达可改善哮喘大鼠肺组织病理变化。见图1。
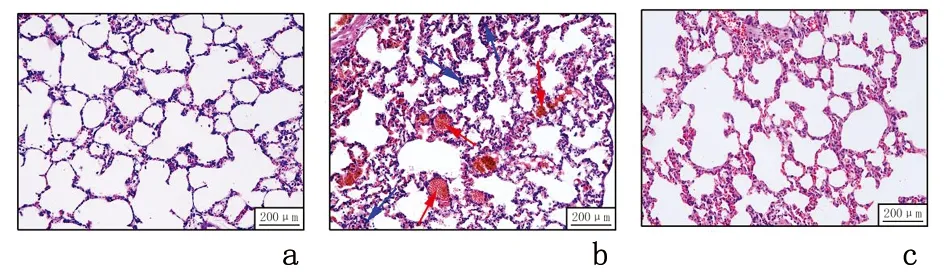
a:正常对照组; b:阴性对照组; c:miRNA-155表达抑制组
2.3 各组大鼠肺组织miRNA-155和Wnt5a mRNA表达水平与正常对照组比较,阴性对照组、miRNA-155表达抑制组miRNA-155表达水平升高(P<0.05),Wnt5a表达降低(P<0.05);与阴性对照组相比,miRNA-155表达抑制组miRNA-155表达水平降低,Wnt5a基因mRNA表达水平显著升高(P<0.05)。见图2。

a:miRNA-155; b:Wnt5a mRNA
2.4 双荧光素酶报告基因实验验证miRNA-155与Wnt5a的靶向关系双荧光素酶报告基因实验分析结果显示,miRNA-155与Wnt5a基因3′UTR存在互补结合位点,miRNA-155和Wnt5a能够靶向结合,miRNA-155:3′ugggGAUAGU—GCUAAUCGUAAUu5′,Wnt5a:5′ attgCTCACATTCTTTTAGCATTAt 3′。荧光素酶活性检测结果显示,miRNA-155表达抑制组Wnt5a-WT 3′UTR的荧光素酶活性较阴性对照组相比升高(P<0.05)。见图3。

与阴性对照组相比,*P<0.05
2.5 各组大鼠肺组织Wnt5a、STAT3、p-STAT3的蛋白表达水平与正常对照组相比,阴性对照组Wnt5a的蛋白表达水平降低而STAT3、p-STAT3的蛋白表达水平明显升高(P<0.05);与阴性对照组比较,miRNA-155表达抑制组Wnt5a蛋白表达水平显著升高(P<0.05),而STAT3、p-STAT3蛋白表达水平显著降低(P<0.05)。见图4。

1:正常对照组; 2:阴性对照组; 3:miRNA-155表达抑制组
2.6 各组大鼠肺组织匀浆IL-6、TNF-α表达水平与正常对照组相比,阴性对照组、miRNA-155表达抑制组大鼠肺组织IL-6、TNF-α表达水平均显著升高(P<0.05);而miRNA-155表达抑制组IL-6、TNF-α表达水平均显著低于阴性对照组(P<0.05)。见表2。

表 2 各组大鼠肺组织IL-6、TNF-α的表达水平
3 讨 论
哮喘是以T淋巴细胞及肥大细胞等多种炎性细胞和细胞组分共同参与的一种肺部炎症性疾病,过敏原可以诱发哮喘[11-12]。由于哮喘本身是一种由多种细胞介导的气道慢性炎症反应,其中CD4+T细胞在其发生发展过程中起到重要作用[13]。有研究发现,miRNA-155在哮喘小鼠肺组织及脾CD4+T细胞中的表达升高,并且随着接触过敏原时间的增加水平显著升高,在哮喘发病过程中CD4+T细胞内存在miRNA-155的内在调节作用[14]。研究表明,与未被激发的小鼠相比,在卵清蛋白(Ovalbumin,OVA)激发的小鼠的肺中,miRNA-155表达显著上调。与野生型小鼠相比,miRNA-155敲减小鼠的肺部粘液生成和炎症细胞,特别是由OVA哮喘诱导的嗜酸细胞均显著减少。miRNA-155在过敏性炎症中起着关键调节作用[15-16]。
本研究采用10% OVA和10%氢氧化铝混合液1.0 mL致敏后给予1% OVA雾化吸入建立哮喘大鼠模型,建模后进行miRNA-155抑制剂转染及干扰Wnt5a表达。结果发现,与正常对照组相比,阴性对照组、miRNA-155表达抑制组大鼠肺功能指标FVC、FEV1及PEF均显著降低而FEV1/ FVC升高;与阴性对照组相比,miRNA-155表达抑制组大鼠肺功能均有不同程度的提高。组织病理形态学结果表明抑制miRNA-155表达可改善哮喘大鼠肺组织病理变化。与正常对照组比较,阴性对照组miRNA-155表达水平升高,Wnt5a基因mRNA表达水平显著降低;与阴性对照组相比,miRNA-155表达抑制组miRNA-155表达水平降低,Wnt5a基因mRNA和蛋白表达水平均显著升高。进一步采用双荧光素酶报告基因实验验证miRNA-155与Wnt5a的靶向关系,结果显示,miRNA-155与Wnt5a基因3′UTR存在互补结合位点,Wnt5a是miRNA-155的靶基因。提示miRNA-155与Wnt5a呈负性表达,哮喘大鼠模型肺功能受损,肺组织结构破坏,炎性细胞浸润明显,而抑制miRNA-155表达水平可提高哮喘大鼠肺功能水平并可减轻肺组织炎性细胞浸润,从而改善大鼠哮喘。
作为转录因子,STAT3可调节各种细胞因子(包括TNF-α,IL-1β等)和免疫调节基因的表达,促进炎症反应[17]。杨远舰等[18]发现,使用屋尘螨抗原P1刺激16-HBE细胞建立哮喘模型,细胞中p-STAT3的蛋白水平显著升高,且细胞存活率降低;干扰STAT3后,16-HBE细胞的存活率出现回升,结果提示STAT3可能与哮喘所致支气管上皮细胞损伤有关。而miRNA-155作为STAT3信号通路的上游,可激活STAT3炎症通路促进炎症因子的生成和释放,但miRNA-155通过何种途径引起炎症反应目前尚不清楚[19-20]。张晓亮等[21]研究发现,转染miRNA-155模拟物上调miRNA-155后,可显著增加STAT3、p-STAT3的蛋白表达水平;抑制miRNA-155表达则后可显著抑制STAT3、p-STAT3的表达。本研究Western blot结果显示,与正常对照组相比,阴性对照组、miRNA-155表达抑制组STAT3、p-STAT3的蛋白表达水明显升高;miRNA-155表达抑制组STAT3、p-STAT3蛋白表达水平与阴性对照组相比显著降低。提示miRNA-155可促进STAT3信号通路激活,从而在哮喘中发挥炎症作用。
IL-6为致炎性细胞因子,可激活STAT3的磷酸化,活化的STAT3信号通路是感染时致炎因子信号转导的主要通路[22]。目前研究认为炎性细胞因子网络失衡在哮喘的发病机制中起着重要的作用。因此,本研究还检测了miRNA-155在哮喘大鼠模型中是否涉及炎症因子的释放,结果表明与正常对照组相比,阴性对照组、miRNA-155表达抑制组大鼠肺组织IL-6、TNF-α表达水平均显著升高;miRNA-155表达抑制组IL-6、TNF-α表达水平均显著低于阴性对照组。提示miRNA-155引起炎症因子的释放,提高哮喘大鼠肺组织炎性水平,促进病情的发展。
综上所述,miRNA-155通过靶向Wnt5a激活STAT3信号通路,导致炎性细胞因子升高,促进哮喘大鼠的发生发展,miRNA-155可能成为治疗哮喘的新靶点。

