代谢综合征血管损伤动物模型的建立与评价
陈 恂,燕晓茹,刘 晶,姚玉璞,张立平
0 引 言
代谢综合征的核心是肥胖、高血糖、血脂异常和高血压[1-3],是心、脑血管病变的病理基础[4-6]。最新的流行病学调查显示,我国的代谢综合征发病率已上升为33.6%[7]。与此同时,心脑血管疾病的发病率也随之成倍增加[8]。因此,研究代谢综合征早期血管病变对于延缓相关心脑血管病变的发生发展至关重要。建立代谢综合征血管损伤动物模型是实验研究的基础。目前,代谢综合征动物模型的构建大多通过饮食诱导来完成[9-11],但具体饲料的比例并不统一,缺乏既定的标准。血管损伤模型的构建也可通过饲喂高脂饲料来建立[12]。此外,对于代谢综合征各组分的研究较多,但对于相关血管内皮功能障碍的研究却较少。研究发现,在血糖控制不佳的2型糖尿病患者中,空腹状态下血清脂肪酸比健康的非糖尿病患者高出50%,餐后的棕榈酸水平(主要的饱和脂肪酸之一)几乎比健康的非糖尿病患者高3倍[13]。棕榈酸能诱导内皮细胞发生炎症反应,介导细胞凋亡[14-15],参与许多心血管疾病的发生发展。棕榈酸作为一种饱和脂肪酸,也常用于制备血管损伤细胞模型[16]。本课题组前期研究证实通过予SD雄性大鼠饲喂自拟高糖高脂高盐配方饲料能建立代谢综合征模型[17],本研究通过改进饲料配方以期建立代谢综合征血管损伤动物模型。
1 材料与方法
1.1 实验动物SPF级SD雄性大鼠53只,6~8周龄,体重(200±10)g。来源于北京维通利华实验动物技术有限公司,实验动物合格证号: SCXK(京)2016-0006,动物均饲养于北京中医药大学东方医院SPF级动物实验室中,室内温度:23~25 ℃,相对湿度(55±10)%,40 W日光灯照射,维持12 h光照和12 h黑暗的昼夜交替光照。随机数字表法分为对照组14只,模型组39只,实验前动物适应性饲养7 d,对照组以全价颗粒饲料喂养,模型组以全价颗粒饲料混合高糖高脂高盐饲料适应性喂养,自由饮水。实验中对实验动物的处理遵循3R原则,并通过北京中医药大学东方医院伦理委员会审议(伦理审批号:201902)。
1.2实验试剂与仪器高盐高脂饲料定制于北京科澳协力饲料有限公司,饲料配方为:50%基础饲料,10%熟猪油,10%蛋黄粉,2%胆固醇,7.5%奶粉,10%果糖,5%棕榈油,3%食用盐,2%鱼粉,0.5%胆盐。NO Elisa试剂盒购自美国RD公司(货号:KGE001),ET-1 Elisa 试剂盒购自美国RD公司(货号:DET100),10 kDa超滤管购自中国GE公司(货号:Vivaspin 500),Masson染色试剂盒购自北京索莱宝科技有限公司(货号:G1340),油红o染色液购自北京索莱宝科技有限公司(货号:G1260)。大小鼠无创血压仪(Softron BP-98A)、全自动生化检测仪(日立 7160),离心机(Eppendorf Centrifuge 5810R)。
1.3实验方法
1.3.1 造模及标本采集实验周期为8周,模型组给予高盐高脂高糖饲料喂养,对照组给予全价颗粒饲料喂养,2组均自由摄食、饮水。实验8周末2组按随机数表法随机选择7只大鼠,禁食不禁水12 h,采用1%戊巴比妥(40 mg/kg)对2组大鼠进行腹腔注射麻醉,沿腹壁正中线逐层切开腹部,于腹主动脉取血,静置2 h,置于离心机中4 ℃,离心半径:20.5 cm,转速:3000 r/min,离心15min,分离上层血清,分装后于-80 ℃冰箱保存待检。取血完成后,剪开胸腔,于胸腔后壁仔细剥离胸主动脉,切取约1.0 cm左右的胸主动脉,用冰等渗盐水冲洗后置于4%多聚甲醛中固定,切取约0.5 cm左右的胸主动脉于冻存管中,直接保存于-80 ℃冰箱中。余大鼠进行后续实验。
1.3.2体重、Lee′s指数及体脂率自造模第1天起每周测量2组大鼠体重。8周末大鼠麻醉后取仰卧位固定于手术台上,测量鼻尖至肛门距离记为大鼠身长,按公式计算两组大鼠Lee′s指数,公式如下:
Lee’s指数=体重(g)1/3×103/体长(cm)[18]
切取并称重肾周及睾丸周围脂肪,按公式体脂率计算两组大鼠体脂率,共同反应肥胖程度。公式如下:
体脂率=肾周及睾丸周围脂肪(g)/体重(g)×100%[9]
1.3.3血压实验8周末,采用Softron无创血压计BP-98A进行大鼠尾动脉无创容积血压测定。测量时,将大鼠放置在鼠袋中,保持38 ℃恒温,然后将感应器置于大鼠的尾根部,待大鼠处于安静状态下按下开始键,读数记录。测定3次,取其平均值作为收缩压。
1.3.4空腹血糖、血脂水平及血清NO、ET-1全自动生化分析仪测定血清空腹血糖(Glu)、三酰甘油(TG)、胆固醇(CHO)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C),按照ELISA 试剂盒说明书进行NO、ET-1的测定。
1.3.5血管切片将固定好的血管组织从多聚甲醛中取出,流水过夜后脱水机梯度脱水,常规石蜡包埋,以4 μm连续切片行HE 染色及Masson染色;将-80 ℃冰箱保存的血管组织以4 μm连续切片,100%异丙醇脱水后行油红o染色,光镜下观察大鼠血管病变情况。

2 结 果
2.1体重、Lee′s指数和体脂率结果对照组大鼠Lee′s指数、体脂率和收缩压均明显低于模型组(P<0.05),见表1。对照组和模型组大鼠体重均逐渐升高,第3~8周,模型组明显高于对照组(P<0.05),见表2。
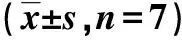
表 1 对照组和模型组Lee′s指数、体脂率和收缩压对比表
2.2空腹血糖、血脂水平和血清NO、ET-18周末,对照组大鼠血清中Glu、CHO、TG、LDLC、ET-1均低于模型组(P<0.01),而HDLC、NO明显高于模型组(P<0.01)。见表3。
2.3胸主动脉病理组织学改变结果HE染色结果表明:对照组大鼠胸主动脉血管内膜均一平滑,内皮细胞形态扁平,排列规整,中膜未见增厚,血管平滑肌细胞呈长梭形,排列规整,大小均一,模型组大鼠胸主动脉内膜欠光滑,内皮细胞排列紊乱,可见脱落,中膜明显增厚,平滑肌细胞肥大,排列不整,细胞核大小不一。Masson染色结果表明:对照组大鼠胸主动脉弹力纤维、胶原纤维排列正常,模型组大鼠胸主动脉弹力纤维明显减少,且排列紊乱,胶原纤维明显增多;油红o染色结果表明:模型组大鼠胸主动脉脂质沉积明显多于对照组。HE染色(内膜厚度)、Masson染色及油红O染色阳性面积(胶原纤维和脂滴)发现,模型组内膜厚度、胶原纤维和脂滴的面积均明显高出对照组(P<0.01)。见图1,表4。
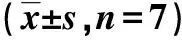
表 2 对照组和模型组体重变化比较
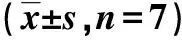
表 3 对照组和模型组空腹血糖、血脂水平对比表
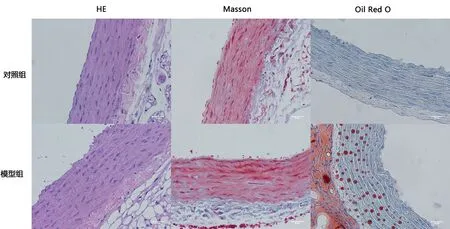
图 1 镜下观察对照组和模型组大鼠胸主动脉形态(×400)
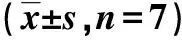
表 4 对照组和模型组胸主动脉内膜厚度和胶原纤维及脂滴面积对比表
3 讨 论
代谢综合征与心脑血管疾病关系密切,可明显增加心血管疾病的发病风险[19-20]。内皮细胞功能障碍是心血管事件的始动环节,可能导致胰岛素抵抗、血脂紊乱、血压升高等一系列病理改变,从而可能成为代谢综合征的早期预测因子[21]。对于代谢综合征的治疗,目前尚无统一、确切的治疗方案,因此早期干预血管内皮功能损伤,或许将成为延缓代谢综合征患者动脉粥样硬化风险及其并发症的关键[22]。建立合适的动物模型是相关研究开展的基础,但由于早期代谢综合征诊断标准不一,这给相应动物模型的构建造成困难。近年来,国内外均颁布了统一的代谢综合征诊断标准[1,23],均围绕肥胖、高血压、高血糖、血脂紊乱四个代谢综合征核心成分。诊断标准的制定为动物模型的构建奠定基础,本研究亦以此评价代谢综合征建模成功与否。
内皮素1(endothelin-1, ET-1)是一种由21个氨基酸组成,正常生理条件下由血管内皮细胞产生和释放的内源性血管收缩肽[24]。ET-1的增加是心血管疾病发生的重要致病因素[25],可与细胞间黏附因子、炎症细胞因子一同造成动脉粥样硬化[26]。新近一宗纳入76名患者的横断面研究同样发现[27]:与非代谢综合征患者相比,代谢综合征患者血清ET-1的水平显著升高(P<0.05)。且ET-1水平升高是血管功能紊乱及血脂异常的独立危险因素。提示ET-1是评价代谢综合征血管内皮损伤的指标。NO是一种重要的血管信号分子,在调控血管功能和调节血脑屏障中起重要作用[28]。其生物活性和/或生物利用度降低是内皮功能障碍的主要原因,也是心血管疾病和2型糖尿病的早期危险因素[29]。新近研究发现,代谢综合征相关的血管内皮损伤伴随NO含量降低,通过提高NO的含量,可以改善代谢综合征血管内皮损伤,提示NO亦是评价代谢综合征血管内皮损伤的指标[11]。本课题组既往研究以高糖高脂高盐饲料饲喂SD大鼠8周成功建立代谢综合征动物模型,并发现血清炎症因子(肿瘤坏死因子、白介素-6、核因子κB)及黏附因子(血管细胞粘附分子-1、细胞间黏附分子-1)均升高,提示存在血管损伤可能[17,22]。本次研究在前期研究基础上,调整饲料配方,加入富含棕榈酸的棕榈油,结果发现模型组39只大鼠,除2只体重不达标(低于对照组平均体重),2只测量血压时窒息死亡,余35只均造模成功,模型成功率为89.74%。8周末模型组大鼠较对照组出现明显的肥胖、高血压、高血糖和血脂紊乱,满足代谢综合征动物模型。在血管损伤方面,模型组大鼠血清NO较对照组明显降低,ET-1明显升高;血管病理染色显示明显内膜增厚,胶原纤维和脂滴沉积,可见血管损伤明显,提示造模成功。
研究中应当注意:①动物适口性的问题,当通过逐步替代的方法使实验动物适应高糖高脂高盐饲料;②油脂含量高的饲料质地较软,不适啮齿类动物啃咬,长期饲喂可能造成牙齿过尖长而不能进食,当提供小木棒帮助磨牙;③高脂饲料容易变质酸化,影响进食,饲料给予当少量多次,保证口感;④基础饲料和造模饲料中的基础饲料当保持一致,不同饲料公司提供的基础饲料可能会有差异。本研究仍存如下问题:①高糖高脂高盐饲料未能明确各营养组分,不利于今后各营养素和机体代谢关系的研究;②为增加进食量,饲料中的棕榈油以人造黄油的形式提供,不能排除食品添加剂对研究的影响;③仅动态观测体重变化,余指标未能动态观测,忽略了实验时间被缩短的可能。今后研究将进一步明确造模饲料各营养组分的配比情况,优化饲料组分,并增加相关指标的观测时间窗,找寻最优饲喂时长,为代谢综合征血管损伤动物模型的建立提供合适、经济的方法。代谢综合征血管损伤动物模型的建立可为相关研究提供支持,有利于早期干预代谢综合征预防相关心脑血管疾病的研究。

