动态监测血浆1,3-β-D-葡聚糖评价早产儿真菌性败血症药物疗效的价值
李 静, 庄 严, 肖丁良, 罗芳梅
(湖南省儿童医院, 1. 药学部, 2. 新生儿一科, 湖南 长沙, 410000)
流行病学研究[1]显示,新生儿重症监护室(NICU)院内感染病原菌中真菌占10%~15%。尤其是超低出生体质量儿(ELBW)侵袭性真菌感染(IFI)发生率及死亡率更高。早期抗真菌治疗是提高真菌性败血症生存率的关键。血真菌培养是诊断的“金标准”,但存在耗时长、阳性率低且易受抗真菌药物影响等问题[2]。
葡聚糖是真菌细胞壁的特异性成分,占其干燥质量的80%~90%, 而BDG(BDG)是由D-葡聚糖合成的细胞壁多聚糖,占真菌细胞壁成分的50%以上[3]。人体细胞、病毒和原核生物的细胞成分和细胞外液都不含有这种多聚糖,因此在机体的血液和其他体液(如脑脊液、腹水、胸水等)中检测BDG(G试验)可作为诊断IFI的有效依据[4]。研究[5-6]显示动态监测血浆BDG水平还可评价抗真菌药物的疗效及病情改善情况。本研究探讨动态监测真菌性败血症患儿血浆BDG浓度的价值,现报告如下。
1 资料与方法
1.1 一般资料
选取2018年1月—2019年12月本院NICU病房收治的真菌性败血症早产儿。诊断标准[7]: 依据《重症患儿侵袭性真菌感染诊断与治疗指南(2007版)》的相关标准,血液真菌培养呈阳性并排除污染,同时符合相关致病菌感染的临床症状与体征。排除标准: 未能在本院完成抗真菌治疗疗程的患儿; 抗真菌治疗后未能动态测定血浆BDG含量的患儿。
1.2 研究方法
诊断真菌性败血症时、抗真菌治疗后每隔7~10 d, 抽血测定血浆BDG含量,若患儿在抽血时已输注过白蛋白、球蛋白等血液制品,则抽血时间顺延至少3 d。
BDG测定方法: 采用光度法检测,参考BDG试剂盒说明书进行操作。采用无热源的肝素抗凝真空采血管采集静脉血2 mL, 3 000转/min离心10~15 min, 取上清液100 μL, 加入到900 μL样本处理液中,混匀置于70℃恒温环境中10 min, 取出后立刻放入冰盒中,冷却5 min后取上清液200 μL加入酶反应主剂中,轻轻混匀20 s, 待样本完全溶解后,全量移至平底试管中(注意不要产生气泡),迅速插入MB-80微生物快速动态检测系统中进行检测,反应结束后由仪器自动计算样本中的G含量。
G试验结果判定标准: 根据真菌BDG检测试剂盒使用说明书进行判定。BDG水平1~100 pg/mL判定为正常; BDG水平大于100 pg/mL, 怀疑为深部真菌感染,建议结合临床症状进行治疗并动态监测。
1.3 统计学方法
采用SPSS 17.0 统计学软件对数据进行统计分析。计数资料以构成比(%)表示,比较采用χ2检验。计量资料采用均数±标准差表示,比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
共纳入符合标准的患儿30例,其中男18例,女12例; 胎龄<28周8例(26.67%), 28~32+6周16例(53.33%), 33~34+6周4例(13.33%), 35~36+6周2例(6.67%); 出生体质量740~2 250 g, 平均(1 219.67±371.08)g, 其中<1 000 g者5例(16.67%), 1 000~<1 500 g者20例(66.66%), ≥1 500 g者5例(16.67%); 入院日龄为生后1 h~103 d, 其中5例为出生后24 h内入院,入院日龄中位数为9.00 d; 住院时间19~371 d, 中位数为77.50 d; 治愈或好转出院28例(93.33%), 放弃或死亡2例(6.67%); 感染前使用氟康唑预防真菌感染17例(56.67%); 均为极低出生体质量儿,其中5例为超低出生体质量儿。
2.2 危险因素
30例患儿均存在多个相关危险因素,包括静脉营养28例(93.33%), 中心静脉置管21例(70.00%), 气管插管12例(40.00%), 行外科手术5例(16.67%), 曾使用激素治疗4例(13.33%), 留置导尿管2例(6.67%)。所有患儿在真菌感染前均使用头孢类抗生素或半合成青霉素,其中12例(40.00%)使用过碳青霉烯类抗生素(美罗培南7例,亚胺培南5例)。抗真菌治疗前,使用过万古霉素者5例(16.67%)、利奈唑胺1例(3.33%)、阿米卡星1例(3.33%)。
2.3 病原菌分布
30例患儿血真菌共培养56株,其中近平滑假丝酵母菌22株(39.29%), 白色假丝酵母菌15株(26.78%), 光滑假丝酵母菌10株(17.86%), 热带假丝酵母菌7株(12.50%), 葡萄牙假丝酵母菌2株(7.69%)。PICC导管末端真菌培养13株,其中近平滑假丝酵母菌5株(38.47%), 白色假丝酵母菌2株(15.38%), 光滑假丝酵母菌3株(23.08%), 热带假丝酵母菌2株(15.38%), 葡萄牙假丝酵母菌1株(7.69%)。见表1。血培养出其他细菌包括人葡萄球菌2株、表皮葡萄球菌2株、产气肠杆菌1株、嗜麦芽窄食单胞菌1株。其他体液培养结果: 痰培养肺炎克雷伯2株、白假丝酵母菌1株; 腹水培养白假丝酵母菌1株。
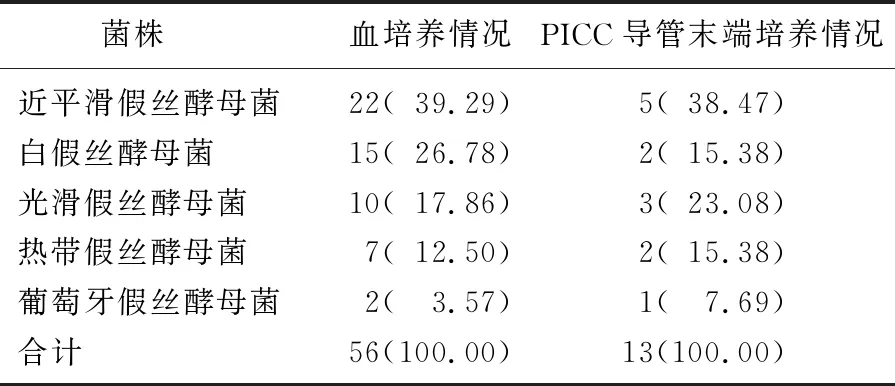
表1 真菌性败血症患儿病原菌分布情况[n(%)]
2.4 BDG浓度与抗真菌治疗的关系
30例真菌性败血症患儿的G试验动态监测结果显示, 28例患儿经过抗真菌治疗后BDG水平呈下降趋势,感染均得到有效控制,其中8例BDG降至正常水平(<100 pg/mL), 20例停药时BDG未降至正常水平; 2例患儿应用抗真菌药物后血浆BDG水平仍持续升高,最后死亡。28例治疗有效患儿中, 5例患儿根据血浆BDG水平变化调整抗真菌药物,血浆BDG水平均有下降, 1例甚至降至正常水平。见表2、3、4。
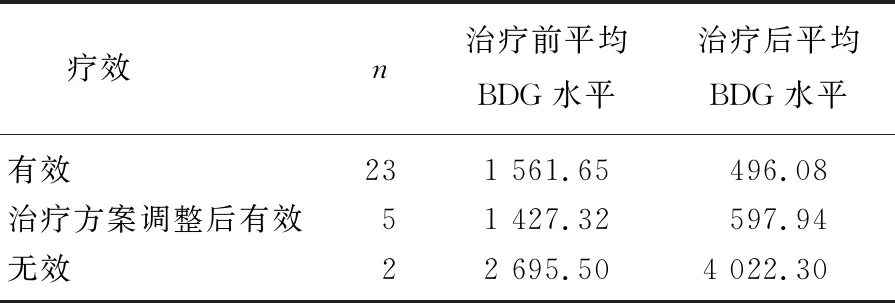
表2 30例患儿BDG水平与抗真菌治疗效果的关系 pg/mL
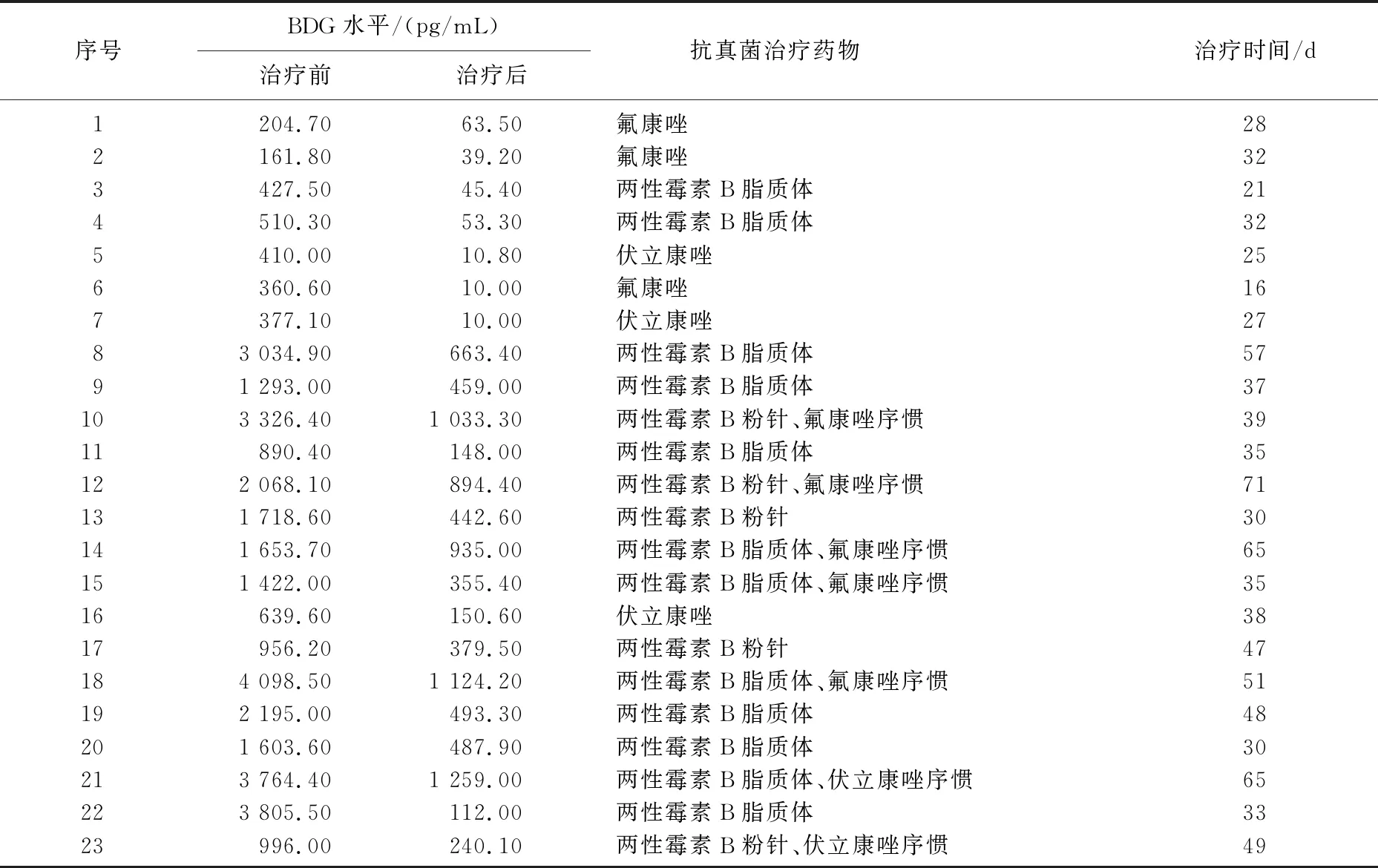
表3 治疗有效患儿抗真菌治疗前后的BDG水平
2.5 BDG水平与疗程的关系
28例治疗有效患儿中, 8例血浆BDG水平降至正常,抗真菌治疗时间16~32 d, 平均(25.63±5.42) d; 20例血浆BDG水平未降至正常,抗真菌治疗时间24~71 d, 平均(44.52±13.86) d。BDG未降至正常水平患儿的抗菌药物治疗时间长于BDG降至正常水平患儿,差异有统计学意义(P<0.05)。
3 讨 论
早产儿、出生低体质量儿的免疫功能发育尚未完善,容易发生侵袭性真菌感染。研究[8-10]显示NICU中侵袭性假丝酵母菌感染的发病率取决于研究队列的平均胎龄和出生体质量,早产的ELBW(出生体质量<1 000 g)感染风险最高。研究[11-12]显示ELBW侵袭性假丝酵母菌血流感染发生率为5%~15%, 是NICU足月儿的25~30倍,病死率为23%~66%, 且存活的患儿中神经系统后遗症发生率高达57%[13]。美国儿科学会和美国感染病学会[14-15]建议对VLBW和ELBW给予抗真菌药物预防治疗。
假丝酵母菌是新生儿真菌性败血症的主要致病菌,其中近平滑假丝酵母菌的感染率有上升趋势[16-17]。本研究分离的56株真菌中,分离最多的是近平滑假丝酵母菌(39.29%), 其次为白假丝酵母菌(26.67%), 其他假丝酵母菌包括光滑假丝酵母菌、热带假丝酵母菌、葡萄牙假丝酵母菌[18-19]。氟康唑和两性霉素B是目前治疗新生儿真菌性败血症的主要药物,尤其两性霉素B是某些致命性全身真菌感染的唯一有效治疗药物。研究[20]显示,两性霉素B脂质体成功治疗新生儿假丝酵母菌菌血症,并且不会引起严重的不良反应。
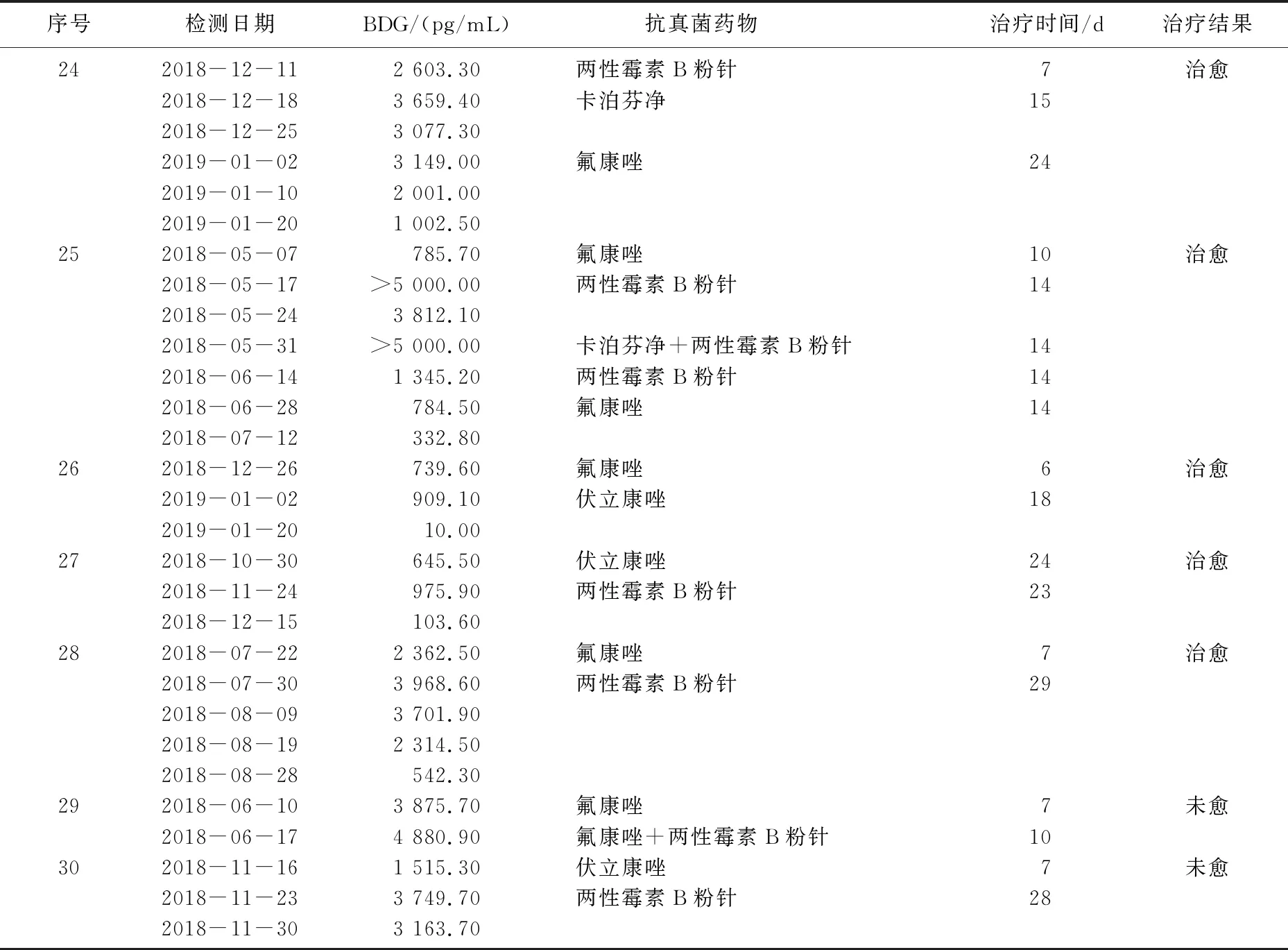
表4 抗真菌药物的调整与BDG水平及疗效的关系
G试验用于诊断新生儿IFI具有快速、敏感性高的特点,可作为传统的真菌涂片及培养等实验室诊断方法的补充。李世荣等[5]、SENN L等[6]动态监测血浆 BDG水平与氟康唑组菌落计数的相关性,证明抗真菌药物的疗效与血浆BDG水平呈线性关系,表明G试验的动态监测可以评价所选抗真菌药物的有效性。温冬华等[21]动态监测BDG水平以评价IFI的抗真菌药物疗效,结果表明,经过抗真菌治疗后, 95.38%IFI患者BDG水平呈下降趋势,直至降至正常水平。
本研究结果显示,治疗有效患儿(n=23)、治疗方案调整后有效患儿(n=5)血浆BDG水平均呈下降趋势,而2例治疗无效患儿血浆BDG呈进行性上升并处于高水平状态,表明G试验的动态监测可以评价所选抗真菌药物的有效性。值得注意的是,本研究完成抗真菌治疗后仍有67.86%患儿血浆BDG水平高于正常值(100 pg/mL), 提示不能将G试验恢复正常作为抗真菌治疗停药指标,这可能导致药物使用时间延长。本研究还发现, BDG未降至正常水平患儿的抗菌药物治疗时间长于BDG降至正常水平患儿,差异有统计学意义(P<0.05), 提示在抗真菌治疗过程中,血浆BDG下降趋势不明显的患儿可能需要适当延长抗真菌治疗时间,且应结合患儿临床症状及其他检查结果综合确定抗真菌治疗疗程。
综上所述,动态监测血浆BDG水平可评价所选抗真菌药物的有效性,且在评价真菌性败血症患儿预后方面也有一定的价值,抗真菌治疗后G试验未降至正常水平并不是延长药物疗程的依据。

