HBcAg特异性辅助性T淋巴细胞22在HBV感染者中的变化和意义
靳 娟, 黄小正, 靖新艳, 张 媛, 尹金玲, 李佳佳, 王思思, 郭雅玲, 李 瑛
西安市第八医院 a.抗病毒门诊; b.医务科; c.肝病科, 西安 710061
HBV感染的临床结局与机体的免疫状态密切相关,且依赖于病毒复制[1]。急性乙型肝炎(acute hepatitis B, AHB)患者细胞免疫应答增强,细胞毒性T淋巴细胞在发挥直接杀伤作用的同时,可分泌大量IFNγ及TNFα等炎性细胞因子,可清除病毒感染,亦可诱导肝脏炎症损伤。慢性乙型肝炎(CHB)则因存在机体免疫功能不全或衰竭,不能有效清除病毒,导致感染慢性化[2]。辅助性T淋巴细胞(Th)22是一类新发现的CD4+T淋巴细胞亚群,主要分泌IL-22,芳香烃受体(aryl hydrocarbon receptor, AhR)是调控Th22细胞分化的主要转录因子[3]。Th22细胞参与了HBV的发病过程,但病毒特异性Th22细胞在HBV免疫发病中的作用尚未完全阐明。因此,本研究观察了AHB和CHB患者中HBcAg特异性Th22细胞的变化,以期初步阐释病毒特异性辅助性T淋巴细胞亚群在HBV感染免疫发病中的作用。
1 资料与方法
1.1 研究对象 选取2018年3月-2019年3月在本院就诊的乙型肝炎患者(包括AHB患者和CHB患者)。AHB患者诊断标准:(1)既往无乙型肝炎病史,HBsAg阴性;(2)当次检查HBsAg阳性,HBV DNA阳性;(3)抗-HBc-IgM阳性;(4)ALT>10倍正常值上限。CHB患者诊断标准符合《慢性乙型肝炎防治指南(2015更新版)》[4]中的诊断标准:(1)HBsAg阳性且HBV DNA阳性超过6个月;(2)ALT>2倍正常值上限。排除标准:(1)年龄<18岁或>65岁;(2)既往曾接收IFN和/或核苷(核苷酸)类似物抗病毒治疗;(3)合并其他肝炎病毒或HIV感染;(4)合并自身免疫性疾病;(5)合并恶性肿瘤;(6)妊娠期和哺乳期妇女。AHB患者均未接受抗病毒治疗,仅给予保肝、退黄、降酶等对症支持治疗,分别于基线和6个月后随访采集外周血。CHB患者均接受富马酸替诺福韦二吡呋酯片(TDF,葛兰素史克制药)300 mg/d抗病毒治疗,分别于基线和治疗6、12个月后随访采集外周血。选择同时期在本院进行健康查体的抗-HBs阴性的志愿者作为健康对照(HC)。
1.2 方法
1.2.1 血浆和外周血单个核细胞(PBMC)的分离 采集EDTA抗凝外周血10 ml,于1000 r/min离心10 min,收集上层血浆冻存备用。下层血细胞使用北京索莱宝公司的Ficoll人淋巴细胞分离液、采用密度梯度离心法分离PBMC,冻存备用。
1.2.2 流式细胞术检测Th22细胞 复苏PBMC,加入RPMI1640和10%胎牛血清,在24孔板中,于37 ℃、5% CO2条件下培养,每位志愿者的PBMC设立2个复孔,每孔106个PBMC。其中一孔加入佛波酯(50 μg/ml)、伊乌诺霉素(1 μg/ml)刺激培养6 h,同时加入莫能霉素(10 μg/ml)抑制分泌。另一孔加入重组HBcAg(以色列ProSpec公司,2 μg/ml)刺激培养12 h,同时加入莫能霉素(10 μg/ml)抑制分泌。收集刺激培养的细胞,PBS洗涤2次,加入CD3-PerCP(美国BD Bioscience公司)和CD4-APC(美国eBioscience公司),4 ℃避光孵育30 min,PBS洗涤2次后加入破膜固定液A,4 ℃避光孵育15 min,PBS洗涤2次后加入破膜固定液B,同时加入IL-22-PE(美国eBioscience公司),4 ℃避光孵育30 min。PBS洗涤2次后加入4%多聚甲醛固定。使用FACS Calibur流式细胞仪分析,使用FlowJo V10软件分析流式结果。
1.2.3 ELISA检测IL-22水平 IL-22 ELISA检测试剂盒购自美国eBioscience公司,操作按说明书进行。向每孔中加入50 μl样本稀释液,然后向每孔中加入50 μl标准品和血浆样本,混匀后室温孵育2 h。洗板5次,每孔中加入100 μl辣根过氧化物酶标记的氯霉素结合物,室温孵育2 h。洗板5次,每孔中加入100 μl底物溶液,室温避光孵育30 min,加入100 μl终止液。立即读取OD450nm,绘制标准曲线,计算血浆样本中IL-22的浓度。
1.2.4 实时定量PCR检测AhR mRNA水平 每位志愿者取106个PBMC,使用美国Invitrogen公司的Trizol试剂提取总RNA,使用NanoDrop对RNA进行定量。取1 μg总RNA,使用TaKaRa公司的PrimeScript反转录试剂盒将总RNA反转录为cDNA,反转录反应体系:5×PrimeScript Buffer (for Real Time) 2 μl、PrimeScript RT Enzyme Mi×10.5 μl、Oligo dT Primer (50 μmol/L) 0.5 μl、Random 6 mers (100 μmol/L) 0.5 μl、总RNA 1 μg、加入RNase Free dH2O至10 μl。反转录反应条件:37 ℃ 15 min,85 ℃ 5 s。使用TaKaRa公司的TB Green Premix Ex Taq Ⅱ进行实时定量PCR反应,实时定量PCR反应体系:TB Green Premix Ex Taq Ⅱ (Tli RNaseH Plus) (2×) 10 μl、PCR上游引物(10 μmol/L) 0.8 μl、PCR下游引物(10 μmol/L) 0.8 μl、ROX Reference Dye Ⅱ (50×) 0.4 μl、RT反应液(cDNA溶液)2 μl、dH2O 6 μl,总体积为20 μl。实时定量PCR反应条件:预变性 95 ℃ 30 s,95 ℃ 5 s、60 ℃ 30 s,
40个循环。使用美国Applied Biosystems公司的ABI7500实时定量PCR仪进行PCR反应,引物序列参考文献[5]合成,采用2-ΔΔCT法对目的基因进行半定量分析。
1.3 伦理学审查 本研究方案通过西安市第八医院伦理委员会批准(EHEC-2018-01-008),符合《赫尔辛基宣言》伦理要求,入组志愿者均签署知情同意书。
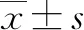
2 结果
2.1 一般资料 共入组AHB患者11例,CHB患者38例,HC 16例。3组研究对象在性别比例和年龄的差异无统计学意义,AHB患者和CHB患者在HBV DNA、HBeAg阳性率之间的差异亦无统计学意义。入组志愿者的一般资料见表1。
2.2 3组患者的非特异性和HBcAg特异性Th22细胞、血浆IL-22、AhR mRNA的变化 根据前向角散射和侧向角散射对淋巴细胞圈门,选择淋巴细胞中CD3+CD4+细胞,检测CD3+CD4+细胞中分泌IL-22的细胞,即为Th22细胞(CD3+CD4+IL-22+),佛波酯和伊乌诺霉素刺激产生的非特异性Th22细胞和HBcAg刺激产生的特异性Th22细胞的典型流式分析图见图1。AHB患者非特异性Th22细胞比例(2.86%±0.45%)高于CHB患者(1.39%±0.33%)和HC(0.80%±0.13%),差异均有统计学意义(t值分别为11.80、17.30,P值均<0.001),CHB患者非特异性Th22细胞比例亦高于HC(t=6.825,P<0.001)。HC中不存在HBcAg特异性Th22细胞,AHB患者HBcAg特异性Th22细胞比例高于CHB患者(2.97%±0.52% vs1.22%±0.22%,t=16.58,P<0.001)(图2)。AHB患者血浆IL-22水平[(130.7±39.97)pg/ml]高于CHB患者[(66.59±20.83)pg/ml]和HC[(50.63±11.07)pg/ml],差异均有统计学意义(t值分别为7.176、7.662,P值均<0.001),CHB患者血浆IL-22水平亦高于HC(t=2.887,P=0.006)。AHB患者PBMC中AhR mRNA(11.45±3.03)高于CHB患者(4.81±1.25)和HC(1.10±0.17),差异均有统计学意义(t值分别为10.85、13.75,P值均<0.001),CHB患者AhR mRNA亦高于HC(t=11.77,P<0.001)(图2)。

表1 入组志愿者的一般资料
2.3 非特异性和HBcAg特异性Th22细胞、血浆IL-22、AhR mRNA与HBV DNA和ALT的相关性分析 在AHB患者和CHB患者中,非特异性Th22细胞比例、HBcAg特异性Th22细胞比例、血浆IL-22和AhR mRNA水平与HBV DNA均无显著相关性(P值均>0.05),非特异性Th22细胞比例、AhR mRNA水平与ALT无显著相关性(P值均>0.05)。而HBcAg特异性Th22细胞比例在AHB患者和CHB患者中均与ALT水平呈显著正相关(r值分别为0.638、0.830,P值分别为0.035、0.002),血浆IL-22水平在AHB患者和CHB患者中亦均与ALT水平呈显著正相关(r值分别为0.552、0.431,P值分别为0.001、0.007)。
2.4 AHB患者恢复期非特异性和HBcAg特异性Th22细胞、血浆IL-22、AhR mRNA的变化 AHB患者出院6个月后随访观察,11例AHB患者出院6个月后HBV DNA和HBsAg阴转,7例患者ALT水平复常,4例患者ALT水平轻度升高(均未超过2倍正常值上限)。非特异性Th22细胞比例在6个月后与基线比较差异无统计学意义(2.81%±0.47% vs 2.86%±0.45%,t=0.399,P=0.698),HBcAg特异性Th22细胞比例在6个月后较基线显著降低(2.79%±0.56% vs 2.97%±0.52%,t=3.055,P=0.012),血浆IL-22水平在6个月后亦较基线显著降低[(105.8±25.23)pg/ml vs (130.7±39.97)pg/ml,t=2.362,P=0.040],而AhR mRNA水平在6个月后和基线比较差异无统计学意义(11.86±1.54 vs 11.45±3.03,t=0.415,P=0.687)(图3)。

图1 非特异性Th22细胞和HBcAg特异性Th22细胞的典型流式分析

图2 3组中非特异性Th22、HBcAg特异性Th22、血浆IL-22、AhR mRNA的比较

图3 AHB患者6个月后非特异性Th22、HBcAg特异性Th22、血浆IL-22、AhR mRNA与基线比较的变化
2.5 TDF治疗对CHB患者非特异性和HBcAg特异性Th22细胞、血浆IL-22、AhR mRNA的影响 所有CHB患者均接受TDF抗病毒治疗,分别于治疗6个月和12个月时进行随访。治疗6个月时,所有患者HBV DNA均低于检测值下限,达到病毒学应答,29例患者ALT水平复常,23例HBeAg阳性患者中2例患者实现HBeAg阴转,但未发生HBeAg血清学转换。治疗12个月时,所有患者HBV DNA仍低于检测值下限,33例患者ALT水平复常,23例患者中5例患者实现HBeAg阴转,1例患者发生HBeAg血清学转换,无患者发生HBsAg阴转。非特异性Th22细胞比例在基线(1.39%±0.33%)、治疗6个月(1.30%±0.27%)、治疗12个月(1.31%±0.18%)比较差异无统计学意义(F=1.454,P=0.238),HBcAg特异性Th22细胞比例在治疗6个月(1.13%±0.16%)和治疗12个月(1.11%±0.15%)均显著低于基线(1.22%±0.22%)(t值分别为4.353、3.927,P值均<0.001),但在治疗6、12个月HBcAg特异性Th22细胞比例的差异无统计学意义(t=1.440,P=0.158),血浆IL-22水平在治疗6个月(54.95±10.07)pg/ml和治疗12个月(52.23±8.17)pg/ml均显著低于基线[(66.59±20.83)pg/ml](t值分别为4.426、4.810,P值均<0.001),但在治疗6、12个月IL-22水平的差异无统计学意义(t=1.786,P=0.082),而AhR mRNA水平在基线(4.81±1.25)、治疗6个月(5.01±1.14)、治疗12个月(4.97±0.99)比较差异无统计学意义(F=0.360,P=0.737)(图4)。

图4 CHB患者接受TDF治疗6个月和12个月后非特异性Th22、HBcAg特异性Th22、血浆IL-22、AhR mRNA与基线比较的变化
3 讨论
Th22主要分泌IL-22,根据细胞因子发挥作用的微环境及不同疾病诱导机体免疫应答的差异,IL-22具有促进免疫炎症应答和免疫保护的双重功能[6]。因此,Th22也是具有双重功能的效应性CD4+T淋巴细胞亚群。但是,IL-22在HBV感染中所发挥的作用尚存在争议。IL-22和分泌IL-22的CD4+T淋巴细胞在HBV感染者中的水平升高[7]。虽然IL-22不具备直接抗病毒效应[8],但重组IL-22可募集多种炎性细胞和炎性介质进入肝脏,诱导HBV感染小鼠模型和CHB患者肝脏炎症损伤[9-10]。也有研究[11]发现,在HBV感染小鼠模型和CHB患者中,IL-22均可促进肝脏干细胞的增殖,促进肝细胞再生,对病毒感染诱导的肝细胞损伤进行修复。本研究发现, HBV感染者外周血中Th22(非特异性和HBcAg特异性)、IL-22、转录因子AhR水平均显著高于HC,而AHB患者中Th22细胞、IL-22和AhR水平亦高于CHB。上述研究结果与在HBV感染所致的慢加急性肝衰竭[12]和慢性丙型肝炎[13]中的发现一致,提示Th22参与了HBV的发病。本研究亦发现,Th22、IL-22和AhR与HBV复制无关,进一步说明IL-22抗病毒活性较弱,更为重要的是,无论在AHB还是CHB患者中,HBcAg特异性Th22和血浆IL-22水平均与ALT水平呈显著正相关,提示IL-22主要与患者肝脏炎症损伤相关。由于IL-22主要由免疫细胞分泌,作用的靶细胞主要是包括肝细胞在内的多种实质细胞[14-15],因此,推测HBV感染可能诱导CD4+T淋巴细胞分泌IL-22增多,病毒特异性Th22水平升高,而升高表达的IL-22进一步作用于肝细胞,诱导肝细胞坏死和凋亡,导致肝脏炎症损伤,促进疾病进程。
有效的抗病毒治疗不但可抑制HBV复制,还可调控机体免疫应答,打破免疫耐受,增强机体免疫系统的抗病毒效应[16]。急性HBV感染属自限性疾病,95%以上的患者可实现病毒自发清除,无需进行抗病毒治疗,6个月后可实现HBV DNA阴转和HBsAg清除。本研究发现,AHB患者在出院6个月后,非特异性Th22和AhR水平与基线比较未见明显变化,但HBcAg特异性Th22和IL-22水平则明显降低。而CHB患者接受TDF抗病毒治疗后也有相似的发现,HBcAg特异性Th22和外周血IL-22水平在CHB患者实现病毒学和血清学应答后显著下降。这与既往替比夫定片治疗CHB患者过程中IL-22水平降低的发现[17]一致。但HBcAg特异性Th22和IL-22水平与HBV DNA水平无显著相关性,提示上述指标的变化可能与病毒复制抑制无关。由于HBcAg特异性Th22主要与肝脏炎症损伤相关,而在HBV感染病情恢复的过程中,非特异性Th22水平未发生明显变化,而HBcAg特异性Th22和IL-22水平显著降低,提示HBV感染者外周血中升高表达IL-22可能主要来源于病毒特异性Th22,而非特异性Th22在HBV感染的免疫和炎症应答中的作用尚不明确,仍需进一步研究证实。
综上所述,HBcAg特异性Th22及其分泌的IL-22与HBV感染炎症应答密切相关,可能通过诱导肝细胞损伤,发挥促进肝脏免疫炎症损伤的作用。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:靳娟、靖新艳、张媛负责实验操作,数据分析,论文撰写;黄小正、尹金玲、李佳佳、王思思负责收集数据,修改论文;李瑛、郭雅玲负责课题设计,资料分析,拟定写作思路,指导撰写论文并最后定稿。

