精原干细胞体外三维培养法的研究进展
姚莹,武露明,何晓,张学红
近年临床上通过放疗和化疗成功治疗了70%以上的儿童癌症,但是这些治疗所致性腺损害后引起的不育症是长期影响癌症患者的不良症状之一,相关学者通过冷冻保存睾丸组织保持男性生育能力和预防年轻癌症患者不育症[1-2]。然而,由于冻融睾丸组织的自体移植存在癌细胞再次植入风险,所以从冻存的睾丸组织中分离精原干细胞(spermatogonial stem cells,SSCs)并且通过体外培养促进SSCs增殖分化产生功能性单倍体精子给不育男性带来极大的希望。此外,SSCs体外培养对其他不育患者(如非梗阻性无精子症,睾丸唯支持细胞综合征等)恢复生育力也具有非常重要的意义[3-4]。但是睾丸组织中的SSCs数量较少[5]。因此,探索支持SSCs增殖并维持其功能和遗传完整性的良好培养方法是未来研究的重点方向。目前,为了模拟精子发生,已有不少学者开发了各种体外培养系统,尽管尚未达到体外完全生精的最终目的,但在该领域也取得了很大的进步。本文主要综述SSCs体外三维培养系统,以便为进一步改良培养方法提供思路。
1 SSCs
SSCs是位于睾丸曲细精管基底膜上的一小群生殖细胞,持续进行着高度协调有序的精子发生。SSCs作为生殖干细胞,与胚胎干细胞一样具有增殖、分化潜能。对于成年男性来讲,SSCs是唯一可以不断地产生精子并将遗传信息传递给下一代的生殖细胞。SSCs的自我更新和分化受内因和外因的精确调控。SSCs存在的微环境称作干细胞生态位,也称壁龛。SSCs壁龛中的体细胞(如支持细胞)为SSCs增殖分化提供重要的生长因子:碱性成纤维细胞生长因子(bFGF)和胶质细胞源性神经营养因子(GDNF)[6-7]。间质细胞和管周细胞为SSCs提供定位所必需的指导信号[8],主要由胶原蛋白Ⅳ、层黏连蛋白、巢蛋白和基底膜聚糖组成的基底膜为SSCs提供锚固基础[9]。然而,目前对SSCs的认识还远不够,在辅助生殖技术和干细胞治疗方面还没有充分发挥其潜力,这在很大程度上是由于缺乏对SSCs壁龛组成以及SSCs自我更新所涉及的复杂调控途径的全面了解。
2 SSCs体外培养
为了提高体外培养中SSCs的增殖分化效率、进行相关基因和药理学研究,从20世纪80年代至今,SSCs体外培养法得到了逐步的改进和完善。传统的二维体外培养法是在培养皿上涂一层薄薄的明胶、胶原蛋白或基质[10],在此基础上根据有无饲养细胞的添加可分为饲养层细胞培养法和无饲养层细胞培养法。Maghen等[11]用人脐带间充质细胞作为饲养层与SSCs共培养,发现SSCs增殖能力显著提高。虽然饲养层细胞培养法可以为SSCs体外生长提供机械支持和各种生长因子,但此培养条件复杂且不可控。Suyatno等[12]在无血清和饲养层条件下用多聚赖氨酸包被培养皿,并在培养皿中添加GDNF和牛白血病抑制因子(bLIF),发现牛的SSCs体外培养可长达2个月。虽然二维体外培养法也取得了一定研究成果,但是由于二维培养法缺乏相对立体的空间结构而不能有效地模拟体内SSCs壁龛,导致SSCs分化效率相对较低。为了探索一种能有效替代基底膜和体细胞的体外环境剂,以构建支持精子发生发展的小管结构,三维培养系统越来越受关注。SSCs的三维培养,是把从曲细精管中分离出的生殖细胞植入到相对较厚(几毫米至几厘米)的半固体培养基中,为SSCs和其他体细胞的接触提供支持媒介,维持或部分维持干细胞龛(niche)的功能,从而完成精子发生过程[10]。Sun等[13]通过减数分裂染色质扩散和DNA含量测定表明人类SSCs在三维培养下可以分化为功能性单倍体精子,并且此单倍体精子能够使小鼠卵母细胞受精,使杂交胚胎的发育成为可能。此外该研究还发现,与二维培养法相比,三维培养法在SSCs分化为精母细胞和精细胞过程中诱导基因表达的作用更好。
3 三维培养法
现有4种三维培养法的组成和特点,见表1。下面详述各方法的研究现状。
3.1 软琼脂三维培养法 琼脂是一种从红海杂草中提取的生物相容性复杂多糖,Lin等[14]首次使用琼脂建立三维软琼脂培养系统(soft-agar culture system,SACS),发现了骨髓干细胞的克隆扩增特征。此后,多个研究小组利用三维SACS研究雄性生殖细胞的体外增殖分化。2008年有学者在SSCs体外培养中引入三维SACS,该系统是由基于不同琼脂浓度的两个部分组成,包括富集SSCs的凝胶相和富含体细胞(如支持细胞)的固体相[10]。将从10日龄小鼠获得的SSCs与凝胶相(0.35%琼脂)混合在固体相(0.5%琼脂)中孵育时,观察到减数分裂阶段的特异性标志物表达,表明将体细胞与生殖细胞共培养能有效地促进生殖细胞增殖、分化。2012年Abu Elhija等[15]在小鼠实验中发现三维SACS可作为减数分裂前生殖细胞向减数分裂后生殖细胞分化并且最终产生功能性单倍体精子的体外培养法。由于所有技术在用于临床前必须在其他物种包括在人类中进行重复成功验证。2016年Reda等[16]在大鼠实验中同样发现SSCs在三维SACS体外培养中可成功分化为具有圆形精子形态特征和蛋白标记的单倍体精子。有研究发现与小鼠相比,大鼠睾丸放疗后生精功能恢复延迟,但恢复期比人类短,所以大鼠模型的应用被认为是从小鼠模型向临床应用迈进的过程[17]。2019年Mohammadzadeh等[3]从非阻塞性无精子症患者中分离的SSCs先置于指定培养基上增殖3周,然后将增殖的SSCs分别置于三维SACS组、明胶组和对照组中培养2周,三维SACS组的细胞团数量明显高于其他两组,培养前仅在睾丸细胞中观察到Oct4(SSCs干细胞性标记基因)表达,培养7 d后,在三维SACS组和明胶组中观察到Stra8(减数分裂前标记基因)的最大表达,但在培养14 d后,其表达显著降低(P<0.05)。与其他组相比,三维SACS组14 d后Scp3(减数分裂中标记基因)和Acrosin(减数分裂后标记基因)的表达更高,说明三维SACS对人SSCs的增殖和分化具有积极作用,同时由于三维SACS组克隆的细胞团数明显高于明胶组,进一步表明三维培养系统优于二维培养系统。然而,SACS在体外生精中的应用并非没有缺陷,有研究发现在培养的最初24 h内,有相当一部分鼠类SSCs(40%~70%)从SACS的上层凝胶阶段丢失,这可能是由于细胞相互作用的丧失和随后触发的凋亡级联反应,甚至有证据表明人类生精细胞无法有效地在三维SACS中完成整个生精周期[18-19]。
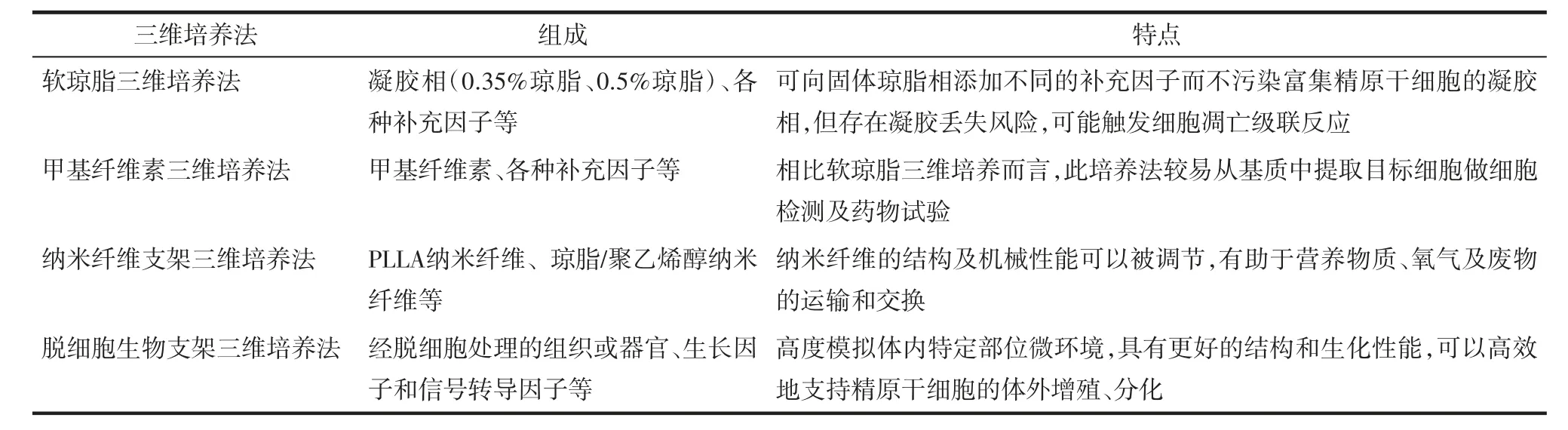
表1 4种三维培养法的组成及特点
3.2 甲基纤维素三维培养法 甲基纤维素是一种非离子纤维素醚,其是通过醚化在纤维素中引入甲基而制成的。甲基纤维素有4种重要功能:增稠、表面活性、成膜性以及形成热凝胶(冷却时熔化)。2009年Stukenborg等[18]提出甲基纤维素培养系统(methylcellulose culture system,MCS)可作为生殖细胞体外培养的另一种三维培养法,该系统允许小鼠减数分裂前的雄性生殖细胞在体外通过减数分裂成熟为形态正常的精子。2015年Huleihel等[20]用取自恒河猴(一种高度进化的灵长类动物)的SSCs在三维甲基纤维素系统(由42%的甲基纤维素组成)中培养,表明MCS三维培养系统可以提供有助于SSCs增殖分化至关重要的元素。2018年Abofoul-Azab等[21]首次在经历放射治疗的青春期前癌症患者的睾丸中分离出具有生物活性的SSCs,发现SSCs在体外MCS三维培养中可以增殖,并且向不同的精子形成阶段分化(如减数分裂中或者减数分裂后),最终成功分化出单倍体精子样细胞,此发现可能为青春期前癌症男孩的生育保护和无精子症患者的新治疗策略提供思路。2019年又有研究首次从无精子的睾丸唯支持细胞综合征患者活检睾丸组织中分离出SSCs,并在体外MCS三维培养系统中诱导SSCs发生减数分裂和减数分裂后变化[4]。此研究一方面表明,睾丸唯支持细胞综合征患者无法在体内完成精子形成可能与睾丸微环境和支持细胞功能受损有关,另一方面也证明甲基纤维素三维培养系统可以提供一种近似体内微环境的培养条件。相比胶原作为培养基质,MCS的使用使我们有更多机会从三维基质中提取培养细胞,随后使用流式细胞术对细胞进行更详细的分析,流式细胞术对细胞的评价可以进一步验证分子、形态学和免疫组织化学等方法对细胞的分析结果[18]。
3.3 纳米纤维支架三维培养法 纳米纤维基质可以模拟天然细胞外基质(ECM)的结构和功能,其支架为SSCs提供更好的三维空间、生物模拟和信号传递,纳米纤维支架三维培养系统可用于再生医学、组织工程、辅助生殖技术以及治疗青春期前癌症患者的不育症[9]。纳米纤维支架的特性(例如纤维排列,纤维直径和孔径,以及机械性能)都可以被调节以高度模拟体内特定部位微环境。相比无支架体外培养,纳米纤维支架的多孔结构(>80%~95%)有助于营养物质、氧气和废物的大规模运输和交换,进而更有利于SSCs的体外培养。此外,在较长时间的细胞培养实验中,细胞培养基的交换相对容易,而且纳米纤维支架也可以被不同的活性化合物(如细胞外基质蛋白)包覆,以满足目标实验需要[22-23]。2013年Eslahi等[24]研究了未成熟小鼠冻融的SSCs和冻融睾丸组织碎片在聚L乳酸(PLLA)纳米纤维支架中的培养情况,3周后精原性标记基因(Itgα6、Itgβ1、PLZF和Oct4)的表达得以维持,PLLA纳米纤维支架上新鲜和冻融的SSCs的增殖明显增加;此外,在纳米纤维上培养的冻融细胞中某些精原特异基因的表达明显减少以及精原细胞分化标记基因(c-Kit)的表达增加,说明纳米纤维支架也可以用于SSCs的分化。体外培养中使用的另一种纳米纤维支架是聚酰胺纳米丝状物,其是由不规则的静电纺丝制成,其结构与基膜相似,为细胞聚集创造了更好的条件[25]。Shakeri等[26]报道了在体外培养过程中,由静电纺聚酰胺纳米丝状物组成的三维纳米纤维基质对从6日大的小鼠睾丸中获取的SSCs增殖分化以及功能的影响。在纳米纤维表面培养7 d后,SSCs细胞团数量、每个细胞团的细胞数量和细胞团的平均面积均有所增加(P<0.05)。此研究发现纳米纤维为支持细胞维持其旁分泌提供更好的微环境,并且可以影响SSC的增殖和分化。2020年Ziloochi等[27]在研究琼脂/聚乙烯醇纳米纤维(PVA)支架对新生儿睾丸SCCs增殖效率和分化潜能的影响中发现,琼脂/PVA支架与生长因子补充的培养基相结合协同增加了小鼠SSCs向精母细胞和减数分裂后细胞的分化率。因此,琼脂/PVA纳米纤维支架在修复不育特别是无精子男性不育方面具有潜在的应用价值。
3.4 脱细胞生物支架三维培养法 脱细胞是用于组织工程的一种常用方法[28],为了保护组织的调节蛋白和结构蛋白,模拟器官功能,可以使用酶、化学、物理或这些方法的结合去除目标组织的细胞和DNA。组织工程的主要成分是支架(又称细胞外基质),细胞、生长因子和信号转导因子等可以在支架中组合使用[28]。值得注意的是,脱细胞支架比人工合成支架(如软琼脂、甲基纤维素、纳米纤维素等三维培养法)具有更好的结构和生化性能,这些特点可以更好地支持细胞迁移、增殖、分化、组织形成以及蛋白表达[29]。2018年Vermeulen等[30]将猪的未成熟睾丸组织(ITT)用不同的方案进行脱细胞处理以产生细胞相容性支架,苏木精伊红染色显示,在所有脱细胞组织中,睾丸结构保存完好,空的生精小管清晰可辨,免疫组化发现所有脱细胞方案后ECM相关蛋白同样保存完好,与不使用支架培养的干细胞相比,使用支架培养的干细胞增殖率更高,干细胞因子分泌量也更大。但是该研究没有此培养条件下SSCs的分化情况。2019年Vermeulen等[31]再次对猪低温保存ITT进行脱细胞处理开发水凝胶来创建睾丸类器官,发现脱细胞ITT开发的睾丸类器官中生长因子保存较好,因此具有较好的恢复生殖能力的潜力。2020年Majidi Gharenaz等[32]用脱细胞小鼠全睾丸作为培养SSCs的天然三维支架,此支架经注射SSCs后被重新细胞化,培养8周对细胞化支架进行组织学评估发现,注射的SSCs固定在生精小管基底膜上,实时聚合酶链反应(PCR)分析显示SSCs发生减数分裂,表明SSCs注入脱细胞睾丸支架后可增殖分化为精母细胞,但是培养8周后并未发现圆形精子,提示SSCs并没有完成产生功能性精子的全过程。
4 三维培养法的优点和不足
4.1 三维培养法的优点 ①高度模拟体内SSCs壁龛微环境,加深对生殖细胞与体细胞之间以及生殖细胞与ECM之间相互作用的认识,摸索SSCs体外增殖、分化所需要的最佳时间和空间条件。②体外精子发生三维培养体系的建立也将使一些在体内难以直接进行的实验成为可能,如新药或潜在毒物对人类精子发生的药学或毒理学研究。③人类单倍体男性生殖细胞的体外成功产生,将为那些因癌症治疗面临不育的青春期前癌症患者,或者其他原因造成的成年男性不育患者保留生育能力带来希望。
4.2 三维培养法的不足 ①用于确定SSC干细胞特性的标记物不统一。②SSCs分化产生的精子数量较少。③不能直接检测精子活力,无法确定受精能力。④软琼脂培养系统难以从凝胶中回收细胞,脱细胞生物支架培养系统仍需优化脱细胞方案避免对ECM造成损伤。
5 结语
精原干细胞三维体外培养法的不断改进对研究精子发生相关分子机制、临床治疗及再生医学具有重要价值。相比软琼脂培养法存在细胞间相互作用丢失的可能,甲基纤维素培养法可以相对简单的获取培养细胞,纳米纤维素培养法便于更换培养基、相对延长培养时间,脱细胞天然三维培养方法更贴合体内微环境。然而SSCs三维体外培养法仍较多地应用于动物实验,许多问题亟待解决,例如:SSCs样本获取有限、体外分化效率低、不能有效检测生殖细胞活性等问题,以及尚未明确人类生殖细胞发育的适用性和精子产生后代的功能。因此,积极解决上述问题将成为男性生殖及再生医学领域新的研究重点。

