精子发生过程中凋亡机制的研究进展
任 娟, 张希伟, 金花子*
(1.延边大学农学院,吉林 延吉 133002;2.汪清县动物检疫站,吉林 汪清 133201)
精子的发生过程又称为生精过程。生精过程中精子凋亡机制被不恰当激活或抑制,会过度凋亡导致疾病的发生。在生精过程中的各个环节均会伴随着细胞凋亡的现象以维持精子发生的动态平衡,国内外近年来研究发现各个环节中发生精子凋亡的现象都会受到众多内在因素和外在因素的影响,其中有些影响因素会打破这种平衡,使精子在发生过程中细胞凋亡率增高。细胞死亡的方式有两种,包括细胞坏死和细胞凋亡。细胞坏死,长期以来被认为是因病理而产生的被动死亡,如物理性或化学性的损害因子及缺氧与营养不良等均导致细胞坏死。坏死细胞的膜通透性增高,致使细胞肿胀,细胞器变形或肿大,早期核无明显形态学变化,最后细胞破裂。细胞凋亡又称是程序性死亡,是有机体在自身控制下有序性死亡的方式,细胞凋亡是指为维持内环境稳定,控制细胞自主、有序性的死亡方式[1-2],细胞在收到凋亡信号后,粘附细胞开始变成圆形,细胞核固缩、DNA断裂,细胞核崩裂成染色质片段,最后,细胞裂解为几个囊泡,即凋亡小体,被周围细胞吞噬。
细胞凋亡涉及的领域比较广泛,在肿瘤疾病方面,细胞凋亡与肿瘤细胞有着密不可分的关系。在衰老方面,随着机体各个器官生长因子合成降低,机体骨骼肌、心脏、中枢神经系统和免疫器官衰老等,都存在着细胞凋亡[3-5]。在内分泌疾病方面,自身免疫性甲状腺疾病、糖尿病心肌细胞凋亡和I类糖尿病都与细胞凋亡息息相关。在自身免疫疾病方面,机体自身免疫力降低,会导致机体发生一系列疾病,此时机体的树突状细胞、Th22细胞与细胞凋亡有着联系。在发育生物学,细胞凋亡还扮演一个比较重要的角色,就是用来保护机体,以免受到有害细胞的损伤。细胞凋亡在生长发育调控中的重要事件,主要是对生长和发育的调控,凋亡的控制是有利于机体的发育往正常的的方向发展。在精子形成的过程中会存在大量发育异常细胞,清除异常细胞是由细胞凋亡途径来实现。因此,细胞凋亡在精子发育过程中起着至关重要的作用,它可以更好的提高受精率,可进一步提高胚胎质量[6-8]。
1 细胞凋亡机制
细胞凋亡机制包括细胞上游诱导阶段,细胞凋亡下游执行阶段和细胞凋亡降解阶段[9-11]。最新的细胞凋亡机制的研究进展,当细胞凋亡程序开始后,Caspase(又称半胱氨酸蛋白酶)会有一系列蛋白酶发生活化反应,在活化反应发生时,可以激活核内的酸内切酶,染色体会出现一系列降解反应,Bcl-2家族和Caspase家族是主要调节哺乳动物细胞凋亡蛋白家族[12-14]。Bcl-2家族有两个大的分类,分别是抗凋亡蛋白和促凋亡蛋白。Caspase家族属于细胞凋亡的下游效应分子之一,包括启动阶段和执行阶段2大类[15-16],(图1)所示[17-18]。
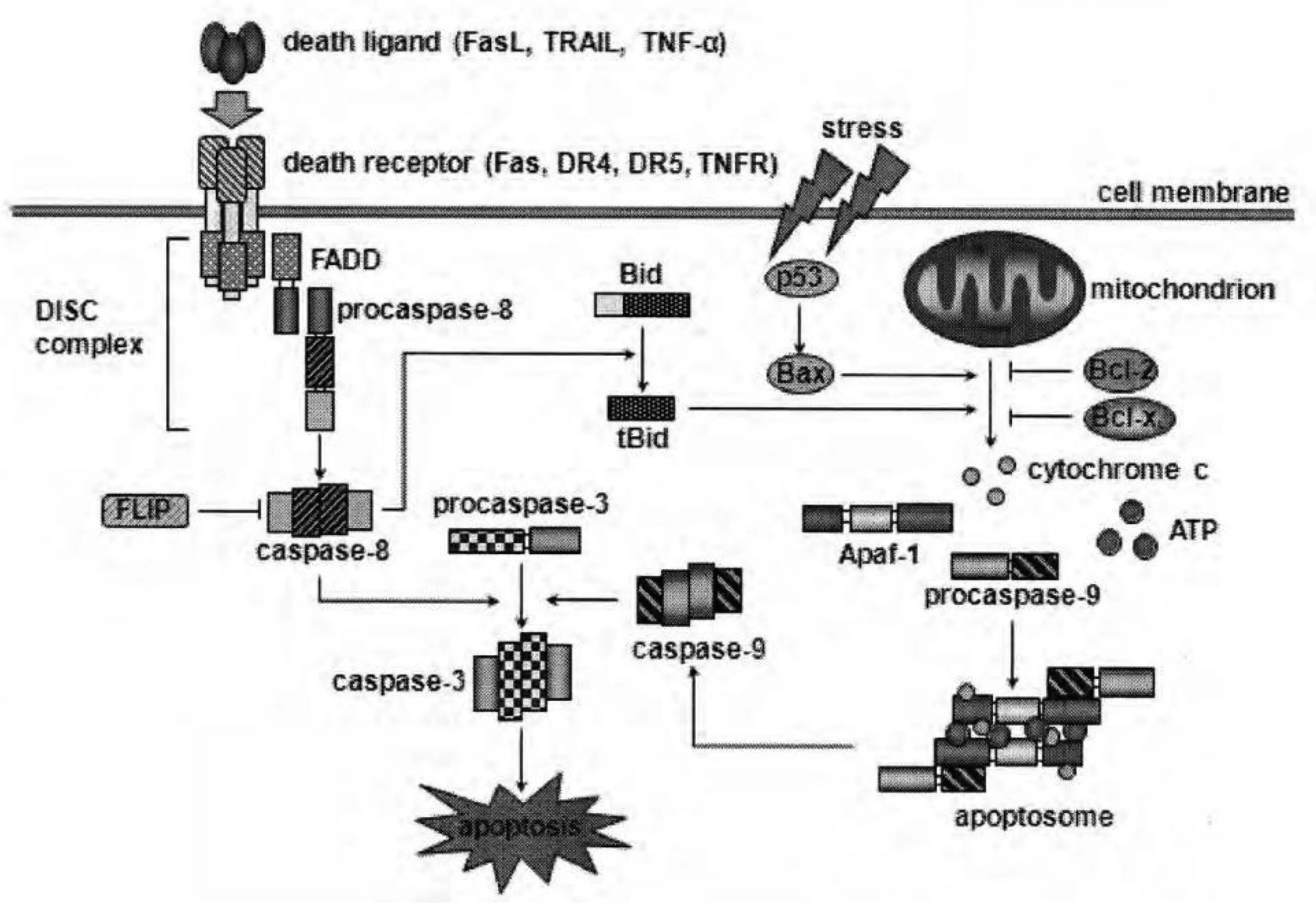
图1 细胞凋亡信号途径模式图(引自Naoko I等,2011;Fuko M等,2012)
2 细胞凋亡的信号通路
细胞凋亡的过程大致可分为以下几个阶段:接受凋亡信号,凋亡调控分子间的相互作用,蛋白水解酶的活化(Caspase),进入连续反应过程。根据细胞凋亡启动阶段的不同,可分为3条主要通路,线粒体通路、内质网通路及死亡受体通路。
2.1 线粒体通路
线粒体通路,即通过线粒体释放凋亡酶激活因子激活Caspase[19]。线粒体是细胞生命活动控制中心,它不仅是细胞呼吸链和氧化磷酸化的中心,而且是细胞凋亡调控中心。该通路为含BH3结构域的Bcl-2家族成员(Bid、Bad、Bim、Harikari、Noxa等)与另外的结合在线粒体外膜或存在于胞浆的Bcl-2家族成员(Bax亚家族成员Bax,Bak等)相互作用,导致后者的寡聚并插入线粒体膜,从而引起线粒体膜通透性改变,跨膜电位丢失,释放细胞色素C(Cytc)和其他蛋白。Cytc的释放是线粒体凋亡路径的关键步骤。释放到细胞浆的Cytc在dATP存在的条件下能与凋亡相关因子1(Apaf-1)结合形成多聚体,而后通过Apaf-1氨基端的Caspase募集结构域(caspase recruitment domain,CARD)募集胞质中的Caspase-9前体,使Caspase-9与其结合形成凋亡小体,被激活的Caspase-9能激活其它的Caspase如Caspase-3和Cspase-7等,从而诱导细胞凋亡。此外,线粒体还释放凋亡诱导因子,如AIF,参与激活Caspase,诱导Cytc释放和凋亡小体的形成。
2.2 内质网通路
内质网通路,即由内质网失常引起的不以细胞膜或线粒体为靶点的凋亡信号触发[20]。内质网是细胞内蛋白质合成的主要场所,同时也是Ca2+的主要储存库。内质网Ca2+平衡的破坏或者内质网蛋白的过量积累是内质网通路中的关键,它们会诱导位于内质网膜的Caspase-12的表达,同时诱导胞质的Caspase-7转移到内质网表面。Caspase-7可激活Caspase-12,而被激活的Caspase-12可进一步激活Caspase-3从而引发细胞凋亡。
2.3 死亡受体通路
死亡受体凋亡通路是细胞凋亡的主要途径之一,接头蛋白在路径中发挥着重要作用[21]。死亡受体通路由各种外界因素作为细胞凋亡的启动剂[22],通过不同的信号传递系统传递凋亡信号,引起细胞凋亡。死亡受体为一类跨膜蛋白,属于肿瘤坏死因子受体(TNFR)基因超家族。其胞外部分有一富含半胱氨酸的区域,胞质区有一由同源氨基酸残基构成的结构,有蛋白水解功能,称“死亡区域”(death domain:DD)。已知的死亡受体有5种,TFR-1(又称CD120a或p55),Fas(CD95或Apo1),DR3(死亡受体3,又称Apo3,WSL-1,TRAMP,LARD),DR4和DR5(Apo2,TRAIL-R2,TRICK2,KILLER)。前3种受体相应的配体分别为TNF,FasL(CD95L),Apo-3L(DR3L),后2种均为Apo-2L(TRAIL)。例如配体FasL可首先诱导Fas三聚体化,三聚化的Fas和FasL结合后,使3个Fas分子的死亡结构域相聚成簇,吸引了胞浆中另一种带有相同死亡结构域的蛋白FADD,在细胞膜上形成凋亡诱导复合物,从而激活Caspase-8,进而引起随后的级联反应,细胞发生凋亡。
3 精子凋亡检测
3.1 Annexin V/PI双染色法
细胞凋亡早期改变发生在细胞膜表面,但目前早期识别仍有困难。这些细胞膜表面的改变之一是磷脂酰丝氨酸(PS)从细胞膜内转移到细胞膜外,PS暴露在细胞膜外表面。PS是一种带负电荷的磷脂[23-24],正常主要存在于细胞膜的内面,在细胞发生凋亡时细胞膜上的这种磷脂分布的不对称性被破坏而使PS暴露在细胞膜外。
Annexin V是一种Ca2+依赖的磷脂结合蛋白,具有很强的抗凝血特性,和易于结合到磷脂类如PS的特性,对PS有高度的亲和性。因此,该蛋白可充当一敏感的探针检测暴露在细胞膜表面的PS。
PS转移到细胞膜外不是凋亡所独有的,也可发生在细胞坏死中。2种细胞死亡方式间的差别是细胞凋亡在初始阶段细胞膜是完好的,而细胞坏死在其早期阶段细胞膜的完整性就破坏了。因此,可以建立一种用Annexin V结合在细胞膜表面作为凋亡的指示并结合一种染料排除试验以检测细胞膜的完整性的检测方法[25]。
3.2 DNA ladder法
该方法为收集凋亡细胞,进行洗涤裂解细胞,在对其进行蛋白处理,DNA的沉淀,以及洗涤、溶解DNA,然后测定DNA的浓度,最后用2%琼脂糖凝胶在80 V电压下电泳2 h。凋亡细胞出现梯状电泳条带,最小的条带为180~200 bp,其他的条带为其整倍数大小。坏死细胞则出现弥散的电泳条带,无清晰可见的条带。正常细胞DNA基因条带因分子量大,迁移距离短,故停留在加样孔附近。
发生细胞凋亡时,内源性核酸酶被激活,染色体DNA链在核小体之间被切割,形成180~200个碱基或其整数倍的DNA片段,将这些DNA片段抽提出来进行电泳,可得到DNA梯状条带(DNA)[26],如图2所示。
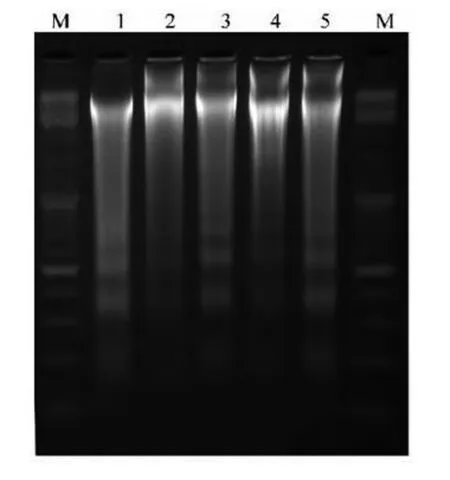
图2 细胞凋亡的典型特征-DNA梯状条带(引自金爱花,等.2016)
3.3 DNA断裂的原位末端标记法
DNA断裂的原位末端标记法是指转移酶介导的dUTP缺口末端标记测定法(TUNEL)。使用不需要模板的脱氧核糖核苷酸末端转移酶,对DNA分子断裂缺口中的3′-OH进行原位标记,凋亡细胞的核DNA断裂后产生3′-OH末端,因此,可借助一种可观测的标记物如荧光素对单个凋亡细胞核或凋亡小体进行原位染色,(图3)[27]。
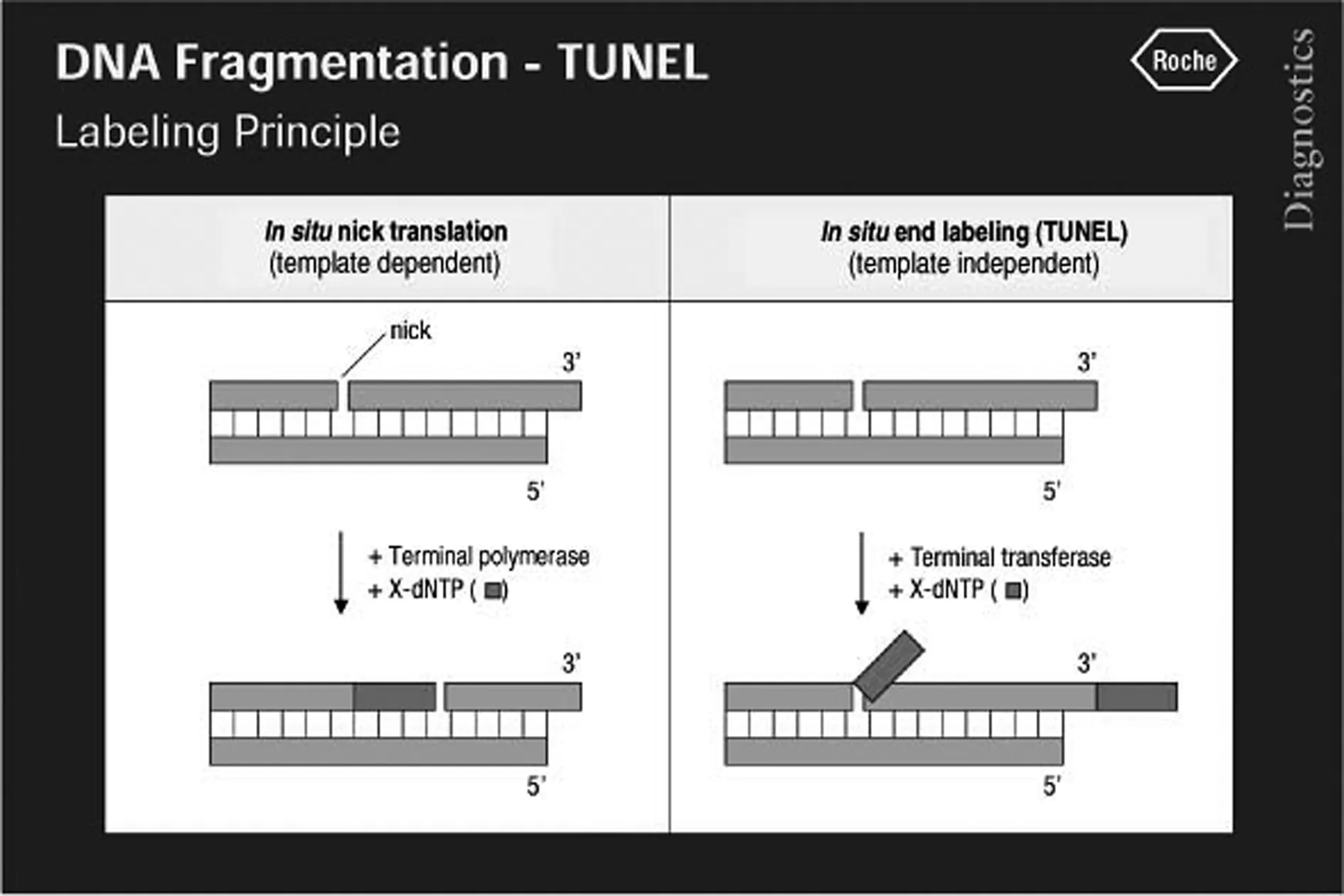
图3 转移酶介导的dUTP缺口末端标记测定法(TUNEL)原理图(引自何玉婷,等.2019)
细胞凋亡中染色体DNA的断裂是个分阶段的过程,染色体DNA首先在内源性的核酸水解酶的作用下降解为50~300 kb的大片段。然后大约30%的染色体DNA在Ca2+和Mg2+依赖的核酸内切酶作用下,在核小体单位之间被随机切断,形成180~200 bp核小体DNA多聚体。由于正常的或正在增殖的细胞几乎没有DNA的断裂,因而没有3'-OH形成,很少能够被染色。低分子量的DNA分离后,也可使用DNA聚合酶进行缺口翻译(nick translation),使低分子量的DNA标记或染色,然后分析凋亡细胞。脱氧核糖核苷酸衍生物地高辛[(digoxigenin)-11-dUTP]在TdT酶的作用下,可以掺入到凋亡细胞双链或单链DNA的3-OH末端,与dATP形成异多聚体,并可与连接了报告酶(过氧化物酶或碱性磷酸酶)的抗地高辛抗体结合。在适合底物存在下,过氧化物酶可产生很强的颜色反应,特异准确的定位出正在凋亡的细胞,因而可在普通光学显微镜下进行观察。
3.4 磷脂酰丝氨酸外翻分析(Annexin-V法)
磷脂酰丝氨酸(Phosphatidylserine,PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。Annexin-V是一种分子量为35~36 KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin-V进行荧光素(FITC、PE)或biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。碘化丙啶(Propidine Iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。因此将Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来,染色结果[28]中Annexin-V和PI二重染色时,Annexin-V阳性(膜绿色)而PI阴性为凋亡表现;Annexin-V(膜绿色)和PI(核红色)均阳性为坏死表现。
4 哺乳动物精子凋亡影响因素
哺乳动物精子发生发育是个相对复杂的过程。在精子发生发育整个过程中,每个阶段都有细胞凋亡的发生。导致哺乳动物精子细胞凋亡的因素有很多,包括内在因素(生精细胞和间质细胞)和外在因素(保存条件、光照和辐射、基因、空气质量、疾病和药物、运动及其他因素)的影响[29-30]。
4.1 生精细胞和支持细胞
吴夏颖等[31]人采用不同产地的雷公藤多苷,检测对大鼠睾丸组织及生精细胞凋亡的影响。3种不同产源的雷公藤多苷对睾丸生精细胞凋亡率有一定影响。龙治峰等[32]人研究大鼠隐睾复位固定术对生精细胞凋亡影响,隐睾内生精细胞凋亡增加时,复位固定术能降低生精细胞凋亡。崔红旺等[33]人用皮瓣重新建立兔阴囊,导致睾丸局部温度升高,睾丸生精细胞凋亡就会增加。郑程等人研究结果表明[34],高脂高糖组大鼠的睾丸生精细胞凋亡数量高于其他2组。买买提祖农·买苏尔等[35]人发现,异常黏液质型阳痿病症会在大鼠睾丸组织的模型发生一系列生理病理学改变,生精细胞异常凋亡,伊木萨克片的干预,能减少细胞的凋亡。郭炫佐等[36]人研究结果表明,当模型组大鼠精子质量降低时,生精细胞凋亡率及凋亡因子的表达明显升高。西药组(阿奇霉素组)精子质量以及细胞凋亡率和凋亡因子表达均降低,中药组(知柏地黄)对精子质量改善明显。
Przemyslaw S等[37]人研究结果表明,EMF诱导氧化和亚硝化应激能介导DNA发生损伤,导致p53/p21依赖性细胞周期停滞和细胞凋亡。周围环境中存在的电磁场,会诱导p53/p21介导细胞周期停滞和细胞凋亡,最后会直接损害雄性生殖力。
Song W Y等[38]人研究结果表明,miR-188-3p抑制剂导致小鼠生精细胞凋亡水平升高。Ren L[39]首次给药后第45天,SiNPs增加了精子的畸形,降低了附睾精子的活力和浓度,SiNPs在睾丸中诱导氧化应激并导致生精细胞的凋亡和坏死。
赵文红等[40]人,采用不同浓度草甘膦对小鼠睾丸支持细胞培养24 h,小鼠睾丸支持细胞会有不同程度缩小、脱落、甚至破碎,草甘膦能诱导细胞凋亡及抑制细胞增殖。
4.2 保存条件
当新鲜精液由体温快速降至10 ℃以下时,精子受到冷打击,不可逆地失去活力而很快死亡,这种现象称为“精子冷休克”。在保存精液时,常需降温处理,尤其是从20 ℃以上急剧降至0 ℃时,由于冷刺激,会使精子遭受冷休克而丧失活力。这是因为精子内的缩醛磷脂融点较高,低温下容易凝结,从而导致精子的代谢不能正常进行而造成不可逆的冷休克死亡。王昕等[41]人研究结果表明,采用低温冷冻环境保存猪精子,导致猪的精子细胞发生比较严重的凋亡现象。丁丽等[42]人用不同保护剂冷冻猪精子,冷冻保存会影响凋亡启动子在猪精子的表达,添加甘油、蔗糖、乳糖,可以有效抑制猪精子冷冻解冻造成的凋亡。Yadav H P等[43]人研究结果表明,CLC(胆固醇载环糊精)补充会减少精子冷冻后的细胞凋亡率。
4.3 疾病与药物
石汉振等[44]人研究结果表明,除正常组之外,其他3组(少精子症组、弱精子症组、精子畸形组)精液里面都存在质量差的精子,所以凋亡率高。李东航等[45]人,证实,对羟基苯甲酸丁酯具有细胞毒性,能降低精子活动能力,促进精子活性氧的生成和细胞凋亡的增加。
杨柳娜等[46]人研究表明,用不同浓度桔梗皂苷和0.31 mmol/L壬苯醇醚-9(N-9),桔梗皂苷D(PD)对人精子有显著的瞬间杀灭效应,能引起精子晚期凋亡。
王鸿祥等[47]人试验结果表明,精浆Leptin水平,精子Omi蛋白含量与精子凋亡间存在显著相关性,可能是促凋亡因子之一。许春爽等[48]人采用Percoll梯度离心法提取精子培养于含有不同浓度赤霉素的培养液中,再用流式细胞仪检测精子凋亡情况,结果显示赤霉素可通过氧化应激反应降低精子运动力,从而促进精子细胞凋亡。杨欣等[49]人采用精子染色质结构分析(SCSA)法对精子DNA的完整性进行检测,通过对比使用生精合剂先后的精子凋亡率,显示生精合剂能提高不育男子的精子浓度和活力(P<0.05)且可显著降低不育男性精子凋亡率(P<0.05)。康锦祥等[50]人研究发现25~100 μg/mL HBs可诱发精子胞膜磷酯酰丝氨酸外翻,胞内Caspase-3、-8、-9激活和DNA损伤,从而致使人精子凋亡以影响精子的功能。黄建忠等[51]人实验观察发现淋球菌感染主要损伤精子颈部,尾部缺损;治愈后,精子可发生停止于未成熟精子细胞及凋亡精子细胞增多,是影响男性生殖能力,造成不育的重要因素。马晓萍等[52]人采用Western blot和免疫荧光分别检测人精子DCXR蛋白的表达和定位,采用TUNEL法检测精子凋亡,结果发现,解脲脲原体感染阳性导致精子DCXR蛋白表达和精子凋亡有明显改善,精子DCXR蛋白的表达具有保护精子并减少精子凋亡率的作用。苗晶等[53]人分析发现,多糖不仅可以作为某些物质的基本组分以及体内的供能物质还在细胞间的识别、细胞间的物质运输、细胞的转化、肿瘤细胞的凋亡等过程中发挥重要作用,如刺五加多糖( acanthopanax senticosus polysaccharide,ASPS)对人小细胞肺癌H446细胞株凋亡有诱导作用,且凋亡率与ASPS的浓度呈正相关。熊宪献等[54]人实验发现,日粮中添加1.0%的复方中草药对青脚麻鸡脾脏发育、抗氧化性和细胞增殖具有显著促进作用,而对细胞凋亡具有明显抑制作用。魏文科[55]设计了不同浓度的HCPT作用于体外培养的肺癌细胞的试验并通过形态学观察生化特征的观察及流式细胞仪检测等方法证明HCPT可以诱导肺癌细胞发生凋亡。
4.4 环境与基因
葛平玉等[56]人通过对照试验,将FITC-AV/PI染色后的精子用流式细胞仪检测凋亡率,并采用化学比色法对睾丸组织NOS含量进行检测,采用硝酸还原法对睾丸NO含量进行测定,数据表明汽油尾气可导致大鼠精子凋亡率升高,精子凋亡率与睾丸组织NOS、NO含量正相关。
潘阳阳等[57]人研究结果显示不同浓度的EGF(表皮生长因子)可以降低耗牛冷冻精子的细胞凋亡。石溢[58]提到LPS引起精子凋亡率显著降低,L-聚组氨酸与TLR4结合,阻断LPS诱导精子凋亡途径,可以降低精子凋亡。王桐生等[59]人通过组织学和超微结构检查在文章中讨论得出,p73基因调控精子的发生及成熟,影响雄性生殖能力,p73基因有2种具有不同功能的亚型(TAp73和ΔNp73),不仅影响生殖细胞与Sertoli细胞间的粘附与迁移,而且影响精子的凋亡。郑立宏等人采用抽样调查的方法,对有机磷农药接触男性与非接触男性进行对照试验,应用TUNEL法检测精子凋亡,光学显微镜和透射电镜观察凋亡精子的形态结构改变,结果发现,接触有机磷农药男性组精子凋亡率显著增高,而且凋亡精子出现形态的异常。故得出长期接触有机磷农药导致精子凋亡率升高,从而导致男性生育力下降的结论。
4.5 运动
张海英[60]研究发现,运动作为一种特殊刺激,可造成一定的机体损伤,引起细胞坏死和凋亡。游泳运动可以改善高脂肪诱导的精子凋亡。刘树超等[61]人提到,对大鼠进行皮下注射尼古丁会出现精子异形和凋亡现象。葛平玉等[62]人试验结果表明,用汽车尾气毒染大鼠睾丸组织,会导致精子凋亡率升高,精子的凋亡与睾丸组织的NO和一氧化氮合酶含量密切相关。Yang H等[63]人发现,X射线照射会导致小鼠GC1精子细胞凋亡。Rayborn M K等[64]人提到,辣椒素预处理显著抑制生殖细胞死亡,辣椒素有抗凋亡活性,通过阴囊热疗引起的精原细胞死亡的保护作用。韦秀霞等[65]人实验研究发现,高膳食纤维可诱导雄性SD大鼠营养性肥胖,并引起脂代谢紊乱,睾丸组织结构改变及睾丸组织细胞凋亡增加明显。通过TUNEL检测大鼠睾丸细胞凋亡情况发现,有氧运动可明显改善高膳食引起的脂代谢紊乱,同时通过降低炎症因子TNF-α及其受体表达干预肥胖症大鼠机体内的精子凋亡。
5 展望
精子在哺乳动物的繁殖中起重要的作用。目前,在整个精子发生过程中,对精子保护不够完善,存在内在和外在因素的影响,内在和外界环境的变化导致精子无法马上适应,精子就会出现一系列反应过程,此时就会有细胞凋亡现象发生。现在动物克隆技术、T细胞免疫激活、动物胚胎移植和人工受精,内在和外在因素,都有可能对精子质量产生一些影响,会直接影响受精卵形成,大大降低动物繁殖率。研究精子细胞凋亡影响因素,是为了更好完善内在和外在环境条件,降低精子的凋亡率,改善精子质量,进一步提高受精卵质量和受精率,为雄性不育的病理生理学分析、遗传学病因解析及临床诊断治疗奠定坚实的理论,对提高动物的繁殖效率具有特别的意义。

