解淀粉芽孢杆菌的分离、鉴定及对4种人参病害防治效果的初步研究
吕 云, 魏帛轩, 闫非凡, 葛长明, 赵洪颜, 朴仁哲*
(1.延边大学农学院,吉林 延吉 133002;2.敦化市农业农村局,吉林 敦化 133700)
人参(PanaxginsengC. A. Mey.)是五加科人参属多年生药用植物[1],主要栽培在吉林省长白山区[2]。人参病害一直是抑制人参产业健康发展的重要因素之一,据报道,我国每年由于病害所造成的产量损失可达总产量的20%~50%[3],且严重影响了我国人参产业在国际市场上的竞争力[4]。目前,已报道的人参病害有数十种之多,其中,人参锈腐病原菌(Cylindrocarpon destructans)、人参根腐病原菌( Fusarium solani )、人参灰霉病原菌(Botrytis cinerea )、人参黑斑病原菌(Alternaria panax )是人参栽培的主要病害[5]。目前人参病害主要依赖于栽参前土壤改良和化学农药防治,由于农药防治效果不理想,大剂量农药的使用增加了病原微生物的抗药性,同时严重影响了生态环境因子和人参根际微生物系统[6]。此外,人参根部的农药残留也极大的影响了人参产品的安全性。因此,绿色生物防控手段[7]是减少化学农药使用和人参农药残留超标的有效措施。
芽孢杆菌是植物病害高效、安全的生物防治资源菌之一,能够拮抗常见的植物病原菌[8]。已报道芽孢杆菌是人参生防微生物的重要组成部分,在人参生物防治过程中发挥重要作用。前人研究表明:芽孢杆菌对人参几种主要病害的病原菌均有抑制作用[9-10],但抑菌率有差异,而且对锈腐菌的抑菌率普遍偏低,研究较为广泛的是枯草芽孢杆菌。目前,解淀粉芽孢杆菌作为一种高效的生防菌,已报到对多种植物病原菌有强烈抑制作用[11-13],但对人参病害的防治报道较少[14]。
该试验从人参根际土壤中分离得到解淀粉芽孢杆菌,以人参锈腐病原菌、人参根腐病原菌、人参灰霉病原菌、人参黑斑病原菌为研究对象,通过拮抗试验和致病性试验评价解淀粉芽孢杆菌对人参病害防治的可行性,为人参病害生物防治提供参考依据。
1 材料与方法
1.1 供试菌株分离
1) 供试土壤:采集于吉林省延边朝鲜族自治州敦化市青沟子乡(43°47'57.8"N 128°20'54.3"E)老参地土壤,用于根际细菌的分离。
2) 分离培养基:牛肉浸膏3 g,胰蛋白胨10 g,氯化钠10 g,琼脂18 g,环己酰亚胺120 mg,用蒸馏水定容至1 000 mL,调pH值至7.2,121 ℃高压灭菌20 min。
3) 真菌培养采用PDA(马铃薯)培养基:土豆20 g/L,葡萄糖20 g /L,琼脂粉15 g /L[15];细菌培养采用LB培养基:胰蛋白胨10 g /L,酵母提取物5 g /L,氯化钠10 g /L。
1.2 供试菌株
人参锈腐病原菌(Cylindrocarpon destructan)、人参根腐病原菌( Fusarium solani )、人参灰霉病原菌(Botrytis cinerea )、人参黑斑病原菌(Alternaria panax ),上述病原菌由延边大学农学院植物病理教研室李熙英教授保存并提供。
1.3 方法
1.3.1 细菌分离、纯化与保存
采用梯度稀释法分离土壤样品中的细菌菌株。采回土样编号分组,过40目筛,分别称10 g土加入90 mL无菌水及玻璃珠放在摇床以150 r/min震荡30 min得到土壤悬液,在无菌操作台中用无菌水将土壤悬液稀释成10-1~10-6不同浓度的土壤稀释液,分别取100 μL菌悬液均匀的涂布在LB培养基上,每处理3次重复[16],28 ℃恒温避光培养2~3 d,待细菌长出后,挑取差异明显的菌落在新的培养基上纯化培养,4 ℃保存备用。
将纯化好的细菌挑入LB液体培养基中,在28 ℃,120 r/min条件下富集培养9 h,然后将富集培养液与甘油以3:2的比例充分混匀后放置于-80 ℃以便长期保存。
1.3.2 细菌鉴定方法
将富集好的菌液送至上海生工测序,通过对基因序列进行BLAST分析,比较与GenBank中注册的其他序列的相似性,完成病原体的分子鉴定。
1.3.3 拮抗性测定
拮抗性测定采用平板对峙法,将4种培养好的人参病原菌用打孔器在培养基外缘打成菌饼,将菌饼接入新的PDA培养基中间,在距离菌饼中间2 cm的对称位置接种细菌,放置在25 ℃条件下培养,并以只接病原菌不接拮抗菌的为对照,待对照长至培养基70%左右面积时,测量处理组病原菌菌落直径[17]。
抑菌率=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-打孔器直径)×100%
1.3.4 致病性测试
将3年生人参根用70%乙醇消毒5 min,再用1%的次氯酸钠消毒5 min[18],再用无菌水反复冲洗3次,然后将人参根放在无菌滤纸上,用无菌手术刀切成圆盘(0.5 cm厚),装入培养皿中,培养皿放入无菌滤纸,并加入等量的无菌水保持湿度,在人参圆盘上先接种20 μL锈腐病原菌孢子悬液(106个/mL),再接种20 μL细菌悬液(OD600=2.5),放置在25 ℃条件下培养观察人参圆盘腐烂状况,分别以只加无菌水和锈腐菌液的处理为阴性对照和阳性对照。腐烂等级划分如下:0级,无腐烂;1级,腐烂1%~10%;2级,腐烂10%~30%;3级,腐烂30%~50%;4级,腐烂50%~70%;5级,腐烂70%~100%(或完全腐烂)[19]。每个处理10次重复。

1.3.5 不同浓度的解淀粉芽孢杆菌菌液对锈腐菌的抑制作用
将分离出的13号菌株挑取单菌落至LB培养基中,28 ℃、150 r/min培养18 h后用LB培养基依次稀释为1×101、1×102、1×103、1×104、5×104、1×105倍,吸取100 μL稀释好的菌液在PDA培养基上涂布均匀,再将锈腐菌菌饼接种在培养基中央,培养7 d后测量锈腐菌直径并计算抑菌率。抑菌率计算公式同1.3.3。
1.3.6 解淀粉芽孢杆菌发酵液对锈腐菌的抑制作用
将13号菌株接种于LB培养基中,28 ℃以150 r/min培养48 h,发酵物在9 000 r/min下离心10 min,吸取上清液备用。一部分发酵液过0.22 μm无菌滤膜除菌,另一部分发酵液经115 ℃,20 min高压灭菌除菌,将上述发酵液与PDA培养基混合,分别配置成含发酵液浓度为0、1、5、25、125、300、600 μL/mL的PDA平板,再接上锈腐菌菌饼,培养7 d后测量锈腐菌直径并计算抑菌率。抑菌率计算公式同1.3.3。
用抑菌率转化成几率值,将其作为依变量(Y),浓度值的对数值作为自变量(X),建立回归方程并求出EC50值[21]
1.4 数据处理
用Spss20.0进行数据的统计分析,Origin软件进行绘图。
2 结果与分析
2.1 拮抗细菌的分离纯化
通过对人参根际土壤进行细菌分离纯化,共得到9株细菌,将所得到的细菌与病原真菌进行对峙实验,有1株细菌对4种病原菌均有良好抑制效果,并且对人参锈腐菌的抑菌率最高,将其编号为13。
2.2 拮抗菌的鉴定
2.2.1 13号拮抗菌的形态学鉴定
如图1所示,革兰氏染色结果说明13号菌株是革兰氏阳性菌,菌落为乳白色,凸起的菌落有褶皱,有时边缘起伏,无色素产生。
2.2.2 13号拮抗菌的分子生物学鉴定
在NCBI Genbank上进行的16S rDNA序列分析表明,13号菌株属于芽孢杆菌属,与Bacillus amyloliquefaciens strain (登录号:MT081100.1)在同一分支,并且同源性为100%,其BLAST得分(Max Score)为2 556,E-value为0.0,并结合菌落形态特征,13号菌株鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens strain)(图2)。
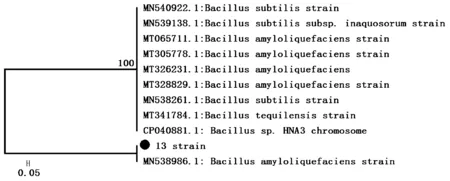
图2 13号菌株系统发育树
2.3 拮抗菌对4种人参病原菌拮抗效果研究
将拮抗菌与4种人参病原菌做平板对峙实验,结果如图3和表1所示,13号菌株对4种病原真菌均有强烈的抑制作用。13号菌株生长的很快,几乎将黑斑菌和灰霉菌包围在其中,使得黑斑菌和灰霉菌不能正常生长,从菌落直径来看,黑斑菌和灰霉菌对照的菌落直径分别为72.00和63.67 mm,与阳性对照相比,这2种病原菌的菌落直径明显减小,分别为23.33和16 mm,仅为阳性对照菌落直径的32.40%和25.13%,同时,抑菌率达到76.04%和85.64%;13号菌对这2种地上病害的病原菌抑菌率高,是因为这2种病原菌菌丝生长以及孢子繁殖的速度慢,从而抑制率高。13号菌对根腐菌的抑制效果虽没有以上2种菌的效果好,但抑菌率也达到了73.24%;锈腐菌是造成人参根部病害最严重的一种菌,13号菌对锈腐菌的抑菌率达到了71.85%,虽然低于对其他3种菌的抑菌率,但远高于张晓云[22]研究的解淀粉芽孢杆菌对锈腐菌的抑菌率(40.24%),这使得13号菌更值得研究。

表1 拮抗菌对4种人参病原菌的拮抗作用
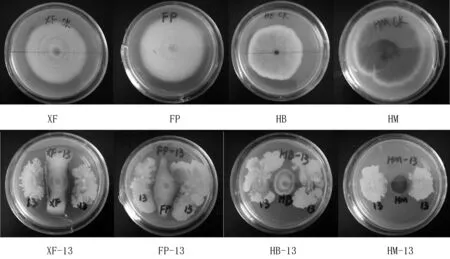
图3 拮抗菌与4种人参病原菌的对峙结果图
2.4 拮抗菌株对锈腐菌的防治效果研究
分别将无菌水、锈腐菌液和13号菌液接种到人参圆盘上,在2、4和6 d时观察人参的腐烂情况并计算病情指数(图4,5)。接种无菌水的处理在2和4 d时几乎无变化,接种6 d时,人参圆盘上变为褐色,有轻微腐烂症状,这时的病情指数仅为20,这是人参分泌了多酚氧化酶等,产生酚类物质造成人参变褐腐烂[23];接种锈腐菌的处理在2 d时,人参圆盘中间有锈腐菌的菌丝,说明锈腐菌正在繁殖阶段;接种4 d后,菌丝体长满人参圆盘表面,人参逐渐变为褐色,病情指数已由32增长到70,接种6 d后,菌丝体已将人参圆盘完全覆盖,并且变为褐色严重腐烂,被完全侵染,病情指数达到100;接种锈腐菌和解淀粉芽孢杆菌的处理在2 d时,人参圆盘无明显变化,接种4 d时,圆盘表面有少许菌丝体,并且有褐色腐烂出现,病情指数仅为18,接种6 d时,人参圆盘外围长满菌丝体,但中间并无菌丝体,人参有一些褐色的腐烂症状,这时病情指数为46。表明13号菌株对锈腐菌有良好的防治作用,并且在前期的防治作用较强。因此,在生产中可以通过提前施加13号菌株菌剂来预防锈腐病的发生。

注:CK为接种无菌水处理;XF为接种锈腐菌液处理;

图5 拮抗菌株对锈腐菌的防治效果
2.5 不同浓度的解淀粉芽孢杆菌菌液对锈腐菌的抑制作用
将培养18 h的解淀粉芽孢杆菌依次稀释不同倍数,在PDA培养基上涂布后接种锈腐菌,锈腐菌生长的菌落直径如图6所示。对照的菌落直径为6.97 cm,其它处理的菌落直径无显著差异,均在1.4 cm左右,抑菌率90%左右,说明解淀粉芽孢杆菌对锈腐菌的生长产生抑制作用,并不是由解淀粉芽孢杆菌的浓度造成,抑制率的高低不会随菌液浓度的高低而改变,而是由于解淀粉芽孢杆菌产生了抑菌代谢产物,将菌液稀释到1×105倍后,抑菌率仍然可以达到90%,说明代谢产物的抑菌活性非常高。
2.6 不同浓度过滤发酵液对锈腐菌生长的影响
解淀粉芽孢杆菌发酵液对锈腐菌生长有明显的的抑制作用,并且随着发酵液浓度增加抑菌率也在逐渐升高(表2),发酵液抑制锈腐菌菌丝生长的毒力方程为Y=0.913 X+3.315 6(R2=0.940 7),有效中浓度EC50为69.919 8 μg/mL。

图6 不同浓度菌液对菌落生长的影响

表2 不同浓度发酵液对绣腐菌菌落生长的影响
2.7 不同浓度灭菌发酵液对锈腐菌生长的影响
将发酵液高压灭菌后配置成不同浓度的培养基,接种锈腐菌,锈腐菌菌落直径如图7所示。CK与1 μg/mL处理的菌落直径无显著差异;5 μg/mL与25 μg/mL处理的菌落直径无显著差异,抑菌率仅为15%左右;125、300和600 μg/mL处理的菌落直径无显著差异,抑菌率为34%左右。说明经过高压灭菌后,使一些具有抑菌活性产物的结构发生变化,使得抑菌活性降低或者失去抑菌活性;另一些可以耐高温高压的抑菌活性物质在起作用,但作用并不强,600 μg/mL处理的抑菌率为35.17%。由此可以看出,起主要作用的抑菌活性物质是不耐高温高压的。
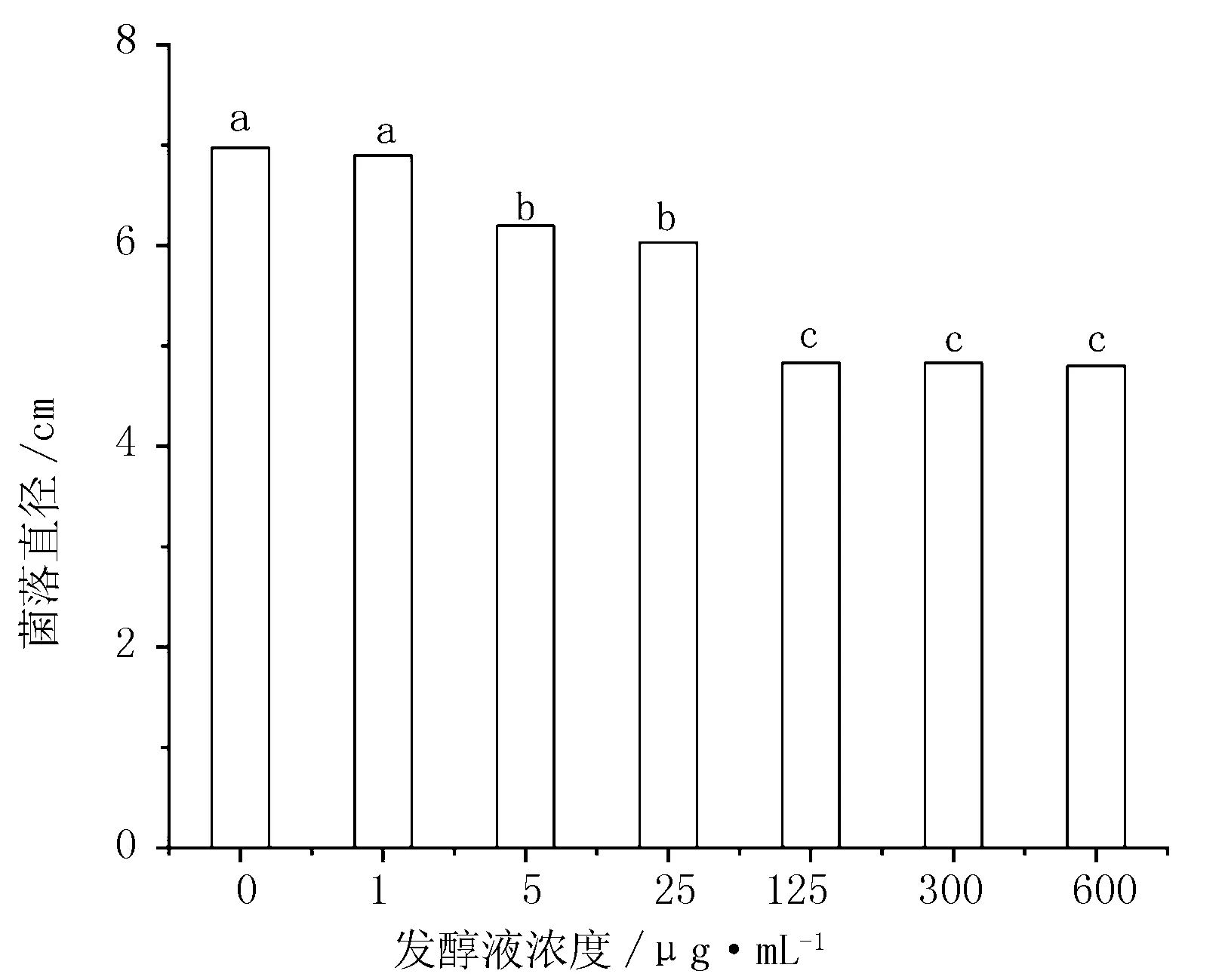
图7 不同浓度灭菌发酵液对菌落生长的影响
3 讨论
该研究的目的是研究解淀粉芽孢杆菌的有益作用。从人参根际土壤中分离出的13号菌通过形态和分子鉴定被确定为解淀粉芽孢杆菌。在培养基中,13号菌显示出对4种人参病原菌具有良好的抑制生长作用,可作为针对人参病害有效的生物防治剂。同时经过研究发现,13号菌对人参锈腐病有较强的防治作用,这可以解决实际生产中因锈腐病导致人参腐烂,品质降低的问题。
芽孢杆菌属物种通常存在于土壤、水和空气中,对多种植物病原真菌具有抑制作用并具有促进植物生长的功能[24-25]。在该研究中,解淀粉芽孢杆菌对人参病原真菌具有抑制作用,是因为在病原体感染周期中抑制了菌丝体生长及病原孢子萌发[19],但细菌没有对真菌菌丝产生寄生作用[26],说明解淀粉芽孢杆菌分泌了抑菌活性物质,抑制了病原菌的生长。解淀粉芽孢杆菌可作为生物防治的潜在菌种,建议用作生物防治时应提前施用,以便使其在土壤中大量繁殖,起到更好的效果。

