制备方法对Ni基甲烷化催化剂活性和抗硫性能的影响
秦志峰,韩 勋,班红艳,孙鹏程,刘 毅,李聪明,常丽萍,谢克昌
(1.太原理工大学 煤科学与技术教育部与山西省重点实验室,太原 030024;2.山西省环境规划院博士后科研工作站,太原 030002;3.清华大学 环境科学与工程博士后流动站,北京 100084)
天然气作为一种清洁高效的能源,2017年进口比例高达39%,随着城市化进程的加快,其缺口将不断增大[1-2]。焦炉煤气富含H2、CH4、CO、CO2等组分,通过甲烷化合成天然气既能改善国内天然气短缺的现状,又因其具有工艺流程短、投资小、能量利用率高及经济效益好等优势,是焦炉煤气资源化利用的最佳方式,符合我国的循环经济发展理念,具有良好的发展前景[3-5]。
焦炉煤气除含有有效组分外,还含有H2S等多种形态硫化物,在合成天然气过程中,硫与催化剂中的镍会形成较强的配位键作用,可以稳定地吸附在活性金属Ni表面,破坏催化剂表面活性位,阻止或者改变反应物分子进一步吸附,从而使催化剂活性下降导致失活[6-7]。为了提高镍基甲烷化催化剂的活性,助剂的选择、载体的选择和制备方法的选择已成为研究的重点[8-10]。制备方法与催化剂活性和选择性有直接关系,HU et al[9]等将活性组分Ni浸渍于不同比表面积的Al2O3载体上,研究发现活性金属Ni在比表面积较大的载体上分散度较高,Ni晶粒的尺寸也较小。而沉淀法制备催化剂过程中,其活性组分与载体之间能够产生较强的相互作用力,使活性组分均匀分散,有利于形成更细小尺寸的金属颗粒[10-11],在反应过程中表现出较好的催化性能。为此,本文采用水解共沉淀法分别制备了20Ni-Al2O3催化剂和高比表面积的Al2O3载体,然后以高比表面积的Al2O3为载体采用传统浸渍法制备20Ni/Al2O3催化剂进行对比研究,在固定床微反应装置中考察镍基催化剂的CO甲烷化活性和抗硫性能,并利用H2化学吸附、N2吸附、XRD、H2-TPR、Raman以及XPS表征手段探讨催化剂的构效关系。
1 实验
1.1 催化剂制备
1.1.1沉淀法催化剂制备[12-13]
1.1.2浸渍法催化剂制备
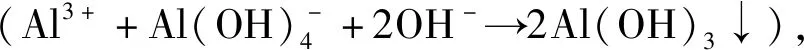
1.2 催化剂活性评价
在微型固定床反应装置中考察镍基甲烷化催化剂的低温活性和抗硫性能。将0.5 g(40-60目)催化剂样品装填于反应管中,在H2气氛下升温至550 ℃还原100 min;降温至200 ℃时通入V(CO)∶V(H2)=1∶3的混合气体,在p=0.1 MPa、WHSV=20 000 mL·g-1·h-1条件下每隔20 ℃进行数据采集,反应温度区间200~360 ℃;低温活性测试完成后催化剂床层温度升高至550 ℃,每隔30 min脉冲注射0.3 mL的H2S(99.9%),测试催化剂的抗硫性能。甲烷化反应产物从反应器出口流出,经冷凝、气液分离、干燥(内装变色硅胶)进入上海海欣GC-950气相色谱仪进行在线分析,检测系统由1个TCD检测器和1个FID检测器串联,由计算机自动釆集数据。色谱分析条件:TDX-1填充柱(2 m×2 mm),热导池温度70 ℃,桥流70 mA,FID检测器温度150 ℃,高浓度H2、CO、CH4和CO2采用TCD检测器测定,低浓度CO、CH4和CO2(现有2%)通过镍转化炉采用FID检测器测定。催化剂性能由CO转化率(XCO)和CH4收率(YCH4)进行分析,计算公式为:
(1)
(2)
式中:Nin和Nout分别为反应器进口和出口气体的体积流量,mL/min;yin和yout分别为反应器进口和出口气体的体积分数。
1.3 催化剂表征
采用浙江泛泰仪器有限公司FINSORB-3010型化学吸附仪对催化剂样品进行H2化学吸附测试。首先将200 mg(40-60目)催化剂样品置于石英样品管中,在Ar气氛下10 ℃/min从室温程序升温至550 ℃,切换为10%H2-90%Ar混合气(体积分数)还原60 min后,再切换为Ar吹扫冷却至室温;设定TCD温度为60 ℃,桥流为60 mA,通入纯H2,气体流量为20 mL/min,脉冲8次吸附至饱和,由TCD检测H2吸附量。依据催化剂表面Ni晶粒的H2吸附量计算Ni的分散度和催化剂活性金属表面积,假设表面的每个Ni原子化学吸附一个氢原子(H/Nisurface=1).催化剂的活性金属比表面积Scat和金属分散度DNi分别根据以下公式计算得出:
(3)
(4)
式中:化学计量系数Sf=2;Vads表示吸附量,mL/g;标况下H2气体摩尔体积Vg=22 414 mL/mol;阿伏伽德罗常数Na=6.023×1023mol-1;金属Ni的摩尔质量M=58.69 g/mol;w表示Ni的质量分数,%;金属Ni原子的面积σm=6.49×10-20m2.
采用湖南三德科技股份有限公司SDS-IVa定硫仪测试催化剂吸收硫含量,配置电解液:称取5 g碘化钾,5 g溴化钾,溶于250 mL蒸馏水中,然后加10 mL冰醋酸搅拌均匀;燃烧炉升温到1 150 ℃后,打开电解池上方的橡皮塞,将电解液加入,塞紧橡胶塞以防漏气;开动搅拌,缓慢调节搅拌调节旋钮至适当速度;称取(50±0.2)mg的硫中毒催化剂样品在瓷舟上,上面覆盖一层三氧化钨,将瓷舟放入石英舟上,输入样重,按下开始按钮,试样经燃烧后,库伦滴定自动进行,计算公式如下:
(5)
式中:S为全硫含量(质量分数),%;Q为电量,C;m为试样质量,g.
采用北京金埃谱科技有限公司V-Sorb4800P型物理吸附仪对催化剂样品的比表面积、孔体积和孔径进行测定。样品测定前经过300 ℃真空脱气处理4 h,在77.4 K下测试N2吸附脱附等温线,采用BET方程和BJH公式计算得到样品比表面积、孔体积及孔径分布。
采用浙江泛泰仪器有限公司FINSORB-3010型化学吸附仪对催化剂样品进行H2-TPR,在Ar气氛下升温至100 ℃进行预处理,随后通入10%H2-90%Ar混合气,以10 ℃/min程序升温至900 ℃,进行催化剂的还原,由TCD检测H2吸附量。
采用日本理学的Rigaku Mini Flex 600型X射线衍射仪对催化剂的晶体结构进行测定。测试条件为Cu靶Kα射线,管电压40 kV,管电流15 mA,步长0.02°,扫描速率10 (°)/min,扫描范围5°~85°.
XPS使用Thermal VG公司生产的Escalab Xi+型X射线光电子能谱分析仪进行测试,测试前将催化剂样品的一小块装入双粘胶带上放入真空室进行分析,采用单色Al Kα射线源,先对催化剂上所有元素进行全谱扫描,然后对活性组分Ni、Mo、P进行窄谱扫描,在分析过程中采用外来污染碳的C1s作为基准峰对样品进行荷电校正,以测量值和参考值(284.8 eV)之差作为荷电校正值(Δ)来校正谱中其他元素结合能。
2 结果和讨论
2.1 低温性能评价
图1为浸渍法和水解沉淀法制备的镍基甲烷化催化剂的活性评价结果。如图1所示,随着反应温度的升高,CO转化率和CH4收率逐渐上升。当反应温度升高至240 ℃时,CO转化率和CH4收率在水解沉淀法制备的20Ni-Al2O3催化剂上分别达到99%和97%以上;而对于浸渍法制备的20Ni/Al2O3催化剂,CO转化率达到99%以上时,反应温度需要升高至280 ℃,同时其CH4收率仅为90%,因此水解沉淀法制备的镍基甲烷化催化剂有较好的低温活性。
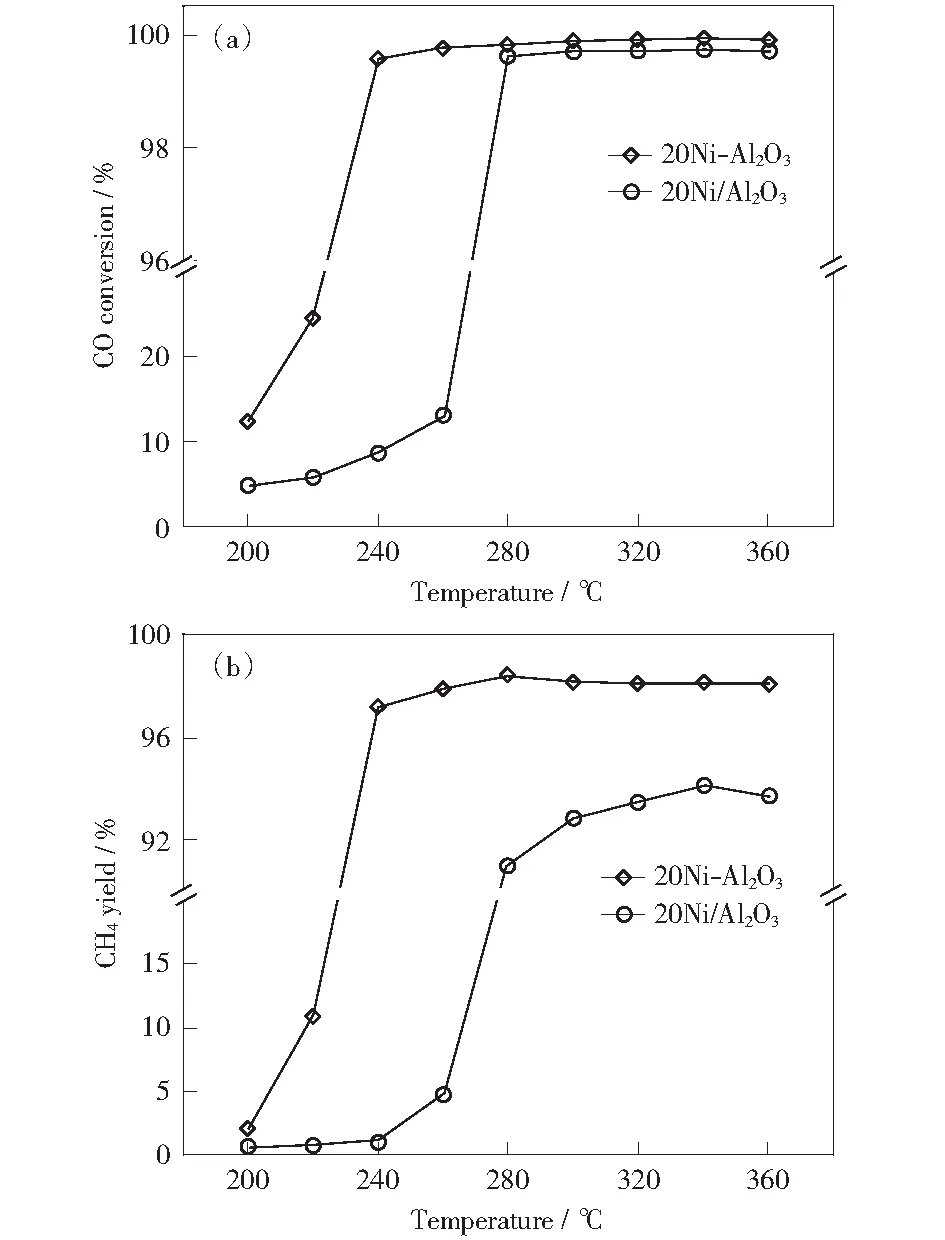
Reaction condition:V(H2)/V(CO)=3∶1,p=0.1 MPa, WHSV=20 000 mL·g-1·h-1图1 镍基催化剂的低温活性评价Fig.1 Low temperature activity evaluation of nickel-based catalysts
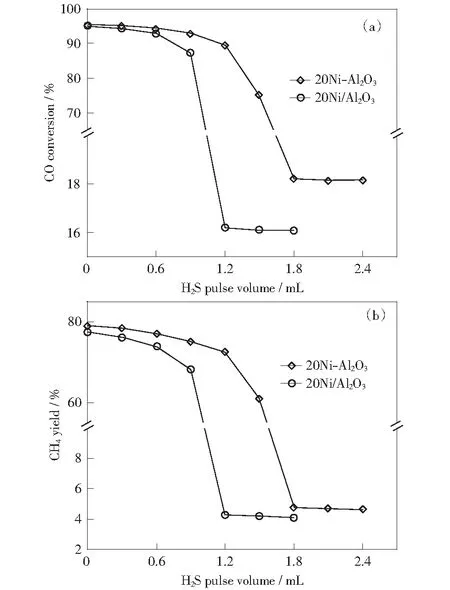
Reaction condition:V(H2)/V(CO)=3∶1,t=550 ℃,p=0.1 MPa,WHSV=20 000 mL·g-1·h-1图2 镍基催化剂的抗硫性能评价Fig.2 Evaluation of sulfur resistance of nickel-based catalysts
2.2 抗硫性能评价
催化剂抗硫性能评价是在550 ℃下反应稳定2 h后开始测试,每隔30 min脉冲注入0.3 mL的H2S,直到催化剂活性显著下降为止,随后停止注入H2S,每隔30 min再次测试活性。图2为浸渍法和水解沉淀法制备的镍基甲烷化催化剂抗硫性能测试结果。从图中可以看出,当H2S累计脉冲注入达到一定量时,催化剂的活性迅速下降。在20Ni-Al2O3催化剂上,H2S脉冲注入量累计达1.8 mL时,CO转化率和CH4收率分别下降至18.2%和4.7%,而在20Ni/Al2O3催化剂上,H2S脉冲注入量累计达1.2 mL时,催化剂的活性迅速下降,CO转化率和CH4收率分别下降至16.1%和4.0%.在催化剂上吸附H2S后CO转化率和CH4收率下降,至稳定时,20Ni-Al2O3催化剂比20Ni/Al2O3催化剂吸附较多的H2S,因此水解沉淀法制备的镍基催化剂表现出较好的抗硫性能。
2.3 新鲜催化剂H2化学吸附和吸硫后催化剂全硫测定
表1为新鲜催化剂H2化学吸附测定的催化剂金属镍的活性比表面积和分散度及吸硫后催化剂的全硫含量测定。催化剂的活性与活性金属Ni的表面积有直接关系[12-13],根据H2吸附量计算催化剂上活性Ni的比表面积和分散度(所有计算均假设一个氢原子吸附在一个表面镍原子上[14-15])。从表中看出,20Ni-Al2O3催化剂的H2吸附量为53.76 μmol/g,活性金属Ni比表面积和分散度分别为4.20 m2/g和4.02%,而20Ni/Al2O3催化剂的H2吸附量仅为15.83 μmol/g,活性金属Ni比表面积和分散度分别为1.24 m2/g和1.18%,水解沉淀法制备的催化剂的活性金属Ni表面积和分散度优于浸渍法制备的催化剂,对比分析显示,催化剂活性金属Ni表面积与图1中催化活性的变化趋势一致,其优越的低温催化活性可能由于催化剂高的活性Ni表面积所致。根据图2中20Ni-Al2O3和20Ni/Al2O3催化剂的抗硫性能测试结果计算出催化剂理论吸收硫含量(质量分数)分别为0.51%和0.34%;并通过定硫仪精确测试吸硫催化剂中硫含量(质量分数)分别为0.28%和0.16%,其理论硫含量与实测值差异的主要原因是由于催化剂评价过程中空速大(WHSV=20 000 mL·g-1·h-1),注入的H2S不能完全被催化剂吸收,但20Ni-Al2O3催化剂吸收硫是20Ni/Al2O3催化剂的1.5倍以上,表明水解沉淀法制备的催化剂抗硫性能优于浸渍法制备的催化剂,原因是水解沉淀制备的催化剂中活性金属Ni表面积较大,导致其对H2S的吸附容量增加,进一步减缓了催化剂硫中毒,提高了催化剂的抗硫性能。
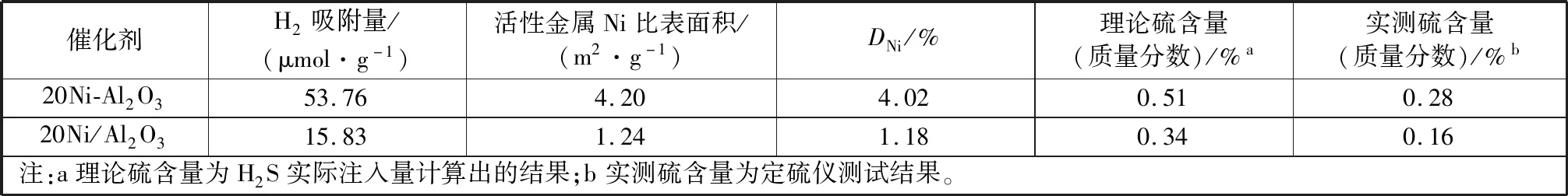
表1 镍基催化剂的活性金属Ni表面积、分散度及其吸收H2S后全硫测定Table 1 Surface area, dispersion of active metal Ni, and total sulfur after H2S absorption of nickel based catalysts
2.4 N2吸附
对制备的Al2O3载体、20Ni/Al2O3和20Ni-Al2O3进行了N2吸附表征。图3为镍基催化剂样品的N2吸脱附等温线和孔径分布曲线。从图中可以看出,水解沉淀法和浸渍法制备的镍基催化剂样品吸脱附等温线均属于Ⅳ型等温线,表明两种催化剂均具有典型的中孔材料特征[16];此外,等温线均具有H4型吸附回滞环,根据de Boer’s理论的解释,样品的孔道为分布不规则的狭缝孔[17]。孔径分布曲线表明,水解沉淀法制备的镍基催化剂平均孔径低于浸渍法制备的催化剂。
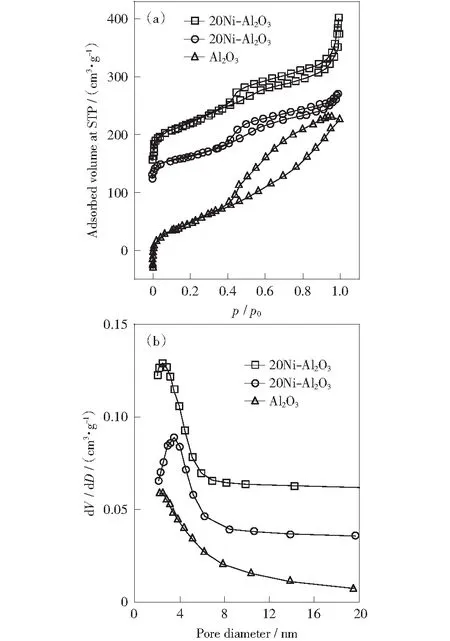
图3 镍基催化剂的N2吸脱附等温线(a)和和孔径分布图(b)Fig.3 (a) N2 adsorption desorption isotherm and (b) pore size distribution of nickel-based catalyst
表2为Al2O3载体和制备的镍基催化剂的织构参数,从表中可以看出,浸渍法制备催化剂过程中,Al2O3载体的比表面积达326.41 m2/g、孔体积为0.39 cm3/g,负载20%的NiO后,催化剂的比表面积下降至170.23 m2/g、孔体积降至0.24 cm3/g,原因是NiO负载于Al2O3载体表面堵塞载体孔道导致催化剂比表面积、孔径大幅下降;而水解沉淀法制备的催化剂比表面积和孔体积分别达到258.96 m2/g和0.29 cm3/g,通过比较20Ni-Al2O3和20Ni/Al2O3催化剂的物性参数,表明催化剂的制备方法对其物理结构影响较大。
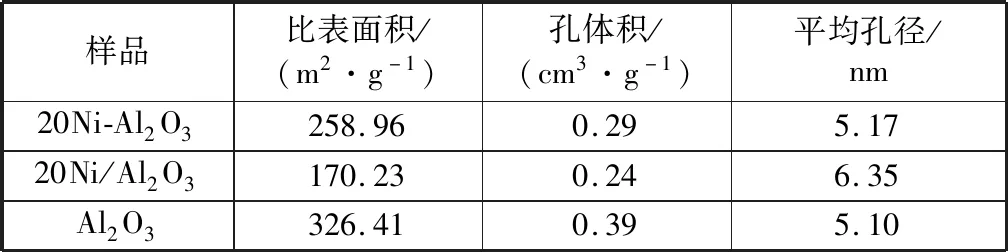
表2 镍基催化剂物理特性Table 2 Physical characteristics of nickel-based catalysts
2.5 H2-TPR
为了分析催化剂表面NiO和Al2O3间的相互作用力,对催化剂进行程序升温还原。图4为镍基催化剂的H2-TPR谱图。根据文献报道[18-22],H2-TPR曲线可以按还原温度分为以下三个区域:区域Ⅰ为游离态α-NiO,其与载体的相互作用较弱或者无相互作用;区域Ⅱ为高度分散的β-NiO,其与载体之间的相互作用较强,介于游离态α-NiO和尖晶石结构NiAl2O4相之间,β1代表包含在Al3+中的镍富相,NiO物种易被还原,而β2代表Ni2+中的铝富相,NiO还原性较差;区域Ⅲ为尖晶石结构NiAl2O4的固定相γ-NiO,其与载体的相互作用力最强,NiO较难移动且较难还原。
由图4可以看出,与20Ni/Al2O3催化剂相比,20Ni-Al2O3催化剂中β1-NiO、β2-NiO以及NiAl2O4的固定相γ-NiO的还原峰温度明显下降,并且在20Ni-Al2O3催化剂中β1-NiO的相对含量较高,NiAl2O4固定相γ-NiO含量较低,在550 ℃下可以完全还原β1-NiO,说明20Ni-Al2O3催化剂中NiO与载体间的相互作用较弱,不易形成NiAl2O4尖晶石结构。而20Ni/Al2O3催化剂中主要形成β2-NiO物种,并且含有少量游离态α-NiO,催化剂表面β1-NiO物种含量少且需要在大于600 ℃下才能完全还原,表明催化剂的制备方法对其表面结构影响较大。表面游离态NiO和弱相互作用的NiO更容易形成较大的晶体颗粒,这是低温活性的主要镍物种,这一结论与文献研究结果一致[23-24]。
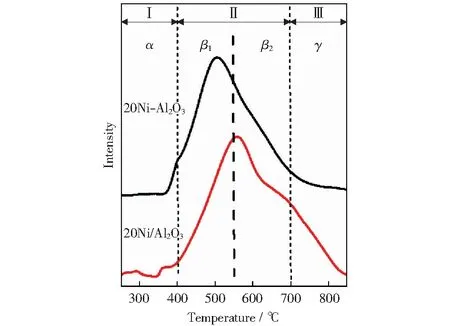
图4 镍基催化剂H2-TPR谱图Fig.4 H2-TPR spectra of nickel-based catalysts
2.6 XRD
图5为Al2O3载体和制备的镍基催化剂样品的XRD谱图。从图中可以看出,出现在2θ=37.6°、43.3°、62.9°、75.5°和79.5°处的峰为NiO的特征衍射峰(JCPDS No 47-1049),在2θ=19.4°、31.9°、37.6°、39.5°、45.8°、60.9°、67.1°和85.1°处的衍射峰归属于γ-Al2O3(JCPDS No 10-0425),2θ= 37.0°、45.0°、59.6°和65.5°处的衍射峰为NiAl2O4尖晶石特征衍射峰(JCPDS No 10-0339),此外,由于NiAl2O4的特征衍射峰与γ-Al2O3的衍射线发生部分重叠,因此不能清晰地观察到NiAl2O4晶相[12,25],但是H2-TPR表征结果证实催化剂中有少量NiAl2O4晶相存在。20Ni/Al2O3催化剂中NiO的特征衍射峰强度高,说明其NiO的晶粒尺寸变大,而20Ni-Al催化剂中NiO的特征衍射峰强度较弱,说明水解沉淀法制备的镍基催化剂中NiO的结晶程度较差,分散性较好。
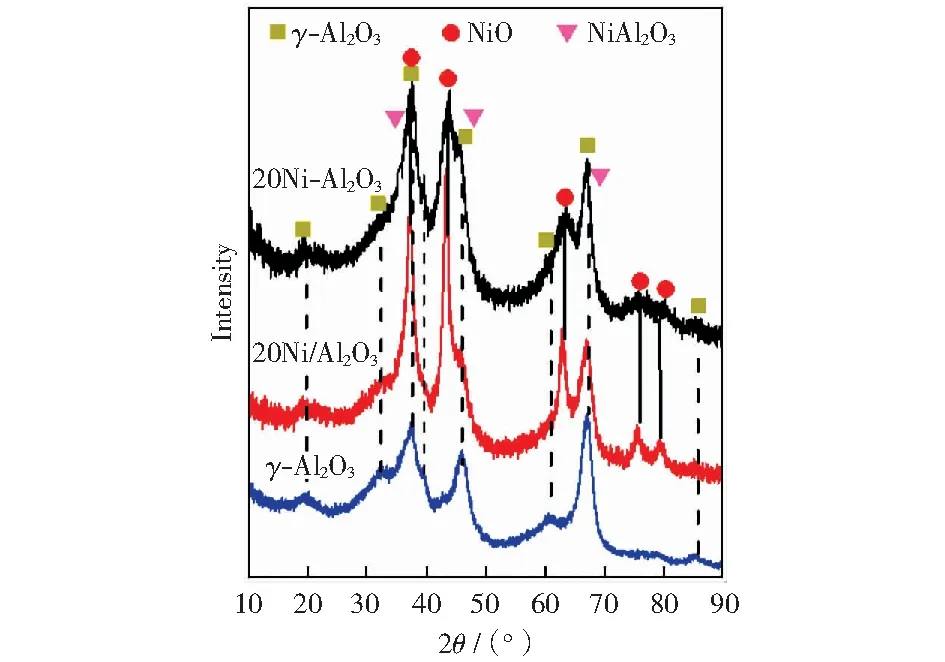
图5 镍基催化剂XRD谱图Fig.5 XRD patterns of nickel-based catalysts
2.7 Raman光谱
图6为镍基催化剂的Raman图谱。有文献报道[26-27],所有Al2O3组成中仅有α-Al2O3晶型可以显示拉曼光谱,所以拉曼图谱中不能看到γ-Al2O3的拉曼光谱。NiO拉曼信号[26]出现在430~450 cm-1、550 cm-1、700 cm-1以及1 080 cm-1位置,从拉曼图谱中可以看出只有在550 cm-1及1 080 cm-1位置上出现NiO拉曼信号,其代表表面高分散的金属NiO.可以明显看出,20Ni-Al2O3催化剂在550 cm-1及1 080 cm-1处特征谱峰强度明显强于20Ni/Al2O3催化剂,表明水解沉淀法制备的镍基催化剂表面可还原的NiO含量较多,以上分析结果与XRD、H2-TPR和H2化学吸附表征结果一致。
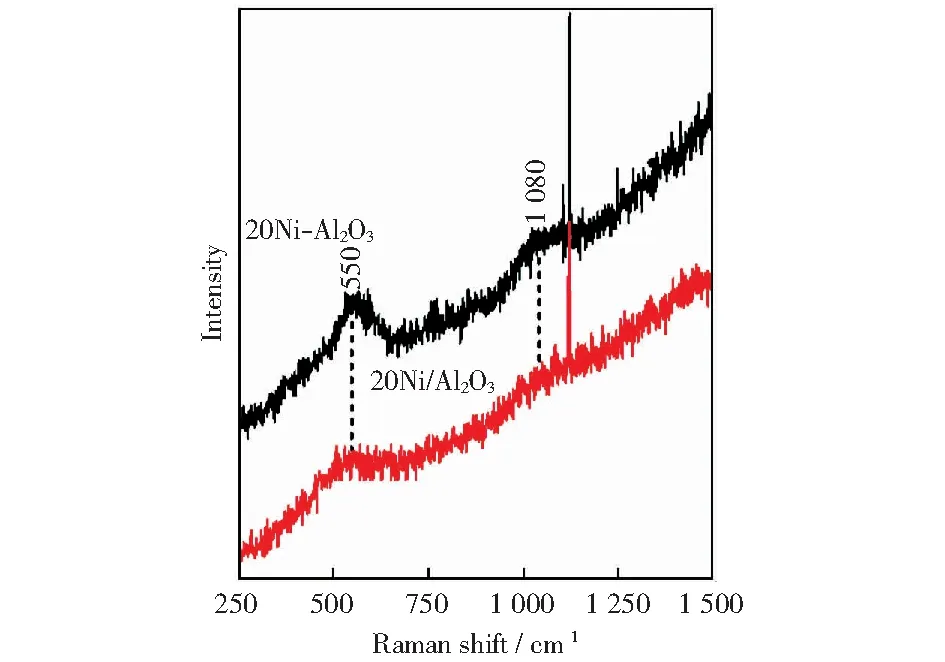
图6 镍基催化剂Raman谱图Fig.6 Raman spectra of nickel-based catalysts
2.8 XPS
图7为镍基催化剂的Ni2p3/2、Al2p和O1s谱。图中显示,催化剂样品的Ni2p3/2谱中主峰值(BE~855.5 eV)与卫星峰值相距~6 eV[28],处于NiO结合能(854.1 eV[29])和NiAl2O4结合能(856.2 eV[30])之间,这表明Ni2+和Al3+有相互作用并且它们之间存在亚稳相的结构[31]。表3为催化剂表面元素结合能,可以看出,催化剂20Ni-Al2O3中Ni2p3/2、Al2p和O1s的结合能小于催化剂20Ni/Al2O3中的结合能,说明镍物种和载体的作用力较弱,与H2-TPR表征结果一致。对表3中催化剂表面Ni和Al元素含量比例进行分析发现,水解沉淀法制备的催化剂20Ni-Al2O3中n(Ni)∶n(Al)比例为24.07%,大于浸渍法制备的催化剂20Ni/Al2O3的n(Ni)∶n(Al)比例10.14%,表明水解沉淀法制备的催化剂表面Ni含量高产生较多的活性位,分析结果与H2化学吸附表征结果一致,进一步证明催化剂表面较多的Ni活性位对低温甲烷化活性和H2S的吸附量有显著提高。
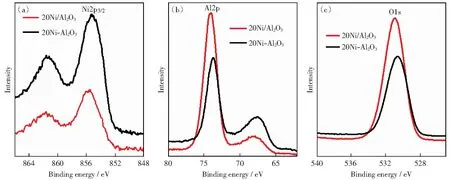
图7 镍基催化剂表面Ni2p3/2、Al2p和O1s的XPS谱图Fig.7 XPS spectra of Ni2p3/2, Al2p, and O1s on nickel-based catalysts surfaces
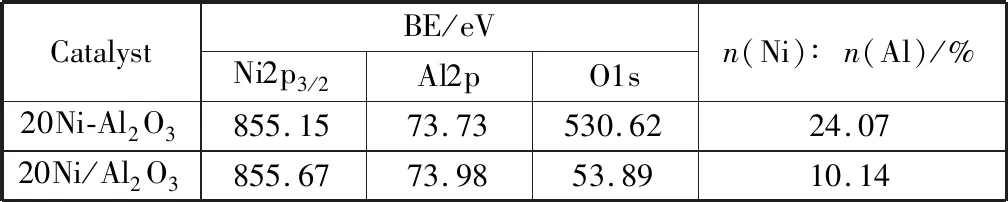
表3 催化剂表面元素的结合能及金属元素含量比例Table 3 Binding energies of various elements and surface atomic ratio of the metal elements in nickel-based catalysts by XPS
3 结论
采用浸渍法和水解沉淀法制备NiO质量分数为20%的镍基催化剂,在固定床微反应装置上进行CO甲烷化反应的活性和抗硫性能评价,对于20Ni-Al2O3催化剂,在操作条件(t=240 ℃、p=0.1 MPa、WHSV=20 000 mL·g-1·h-1)下,CO转化率和CH4收率分别达到99%和97%以上,当反应温度升高至550 ℃稳定反应后,H2S脉冲注入量累计达1.8 mL时,CO转化率和CH4收率分别下降至18.2%和4.7%;而对于20Ni/Al2O3催化剂,CO转化率达到99%以上时,反应温度需要升高至280 ℃,H2S脉冲注入量累计仅1.2 mL时,CO转化率和CH4收率则迅速下降至16.1%和4%,因此水解沉淀法制备的20Ni-Al2O3催化剂表现出较好的低温活性和抗硫性能;通过表征发现水解沉淀法制备的20Ni-Al2O3催化剂比表面积大和NiO分散度高,其表面Ni的活性比表面积较大,产生更多的活性位,导致其低温活性较高,对H2S的吸附量增加减缓硫中毒,提高了催化剂的抗硫性能。

