-15℃下Na+,K+,Mg2+//Cl-,NO3-,SO42--H2O体系相平衡研究
王雪莹,黄雪莉,黄河,罗清龙,邹雪净
(新疆大学化学化工学院,新疆煤炭清洁转化与化工过程自治区重点实验室,新疆乌鲁木齐830046)
引 言
新疆具有独特的天然硝酸盐资源,包括钠硝石和钾硝石矿,存在液相矿、固相矿以及两者并存的矿床[1-3]。新疆的硝酸盐型固体矿已进行多年的开采与加工,而卤水矿由于含有Na+、K+、Mg2+、Cl-、NO3-、SO42-等离子,较固体矿更为复杂,特别是存在镁离子,通过常规的常温或较高温下操作,将产生众多复盐,导致分离路线复杂,甚至得不到纯的目标产品。本课题组通过对不同体系低温相平衡研究发现[4-6],对于复杂的含硫酸盐水盐体系,低温能够抑制某些复盐析出;另外,盐湖常位于气候干旱、冬季寒冷漫长地区,探索开发低温下盐湖化工工艺具有重要意义[7-12]。
相平衡理论是指导盐湖化工技术开发的基础,目前在低温相平衡研究方面已取得一些进展。Spenser 等[13-14]用HMW 模型预测了部分水盐体系在低温下的相平衡关系;桑世华等[15-18]研究了低温下含硼水盐体系相图,温度多为0℃及15℃;Deng 等[19]研究了含溴体系在15℃的相平衡;Cao 等[20-21]对Na+,K+,NH4+,Mg2+//Cl-,SO42--H2O 的相关体系在0℃下的相平衡进行了详细研究并讨论了实际生产中的应用。目前六元体系Na+,K+,Mg2+//Cl-,NO3-,SO42--H2O及其相关子体系在低温下的相平衡研究报道较少,不足以指导卤水硝酸盐资源的开发,因此有必要进行该六元体系及相关子体系在低温下的相平衡研究。
本文采用等温溶解平衡法研究了Na+,K+,Mg2+//Cl-, NO3-, SO42--H2O 体系在-15℃下,NaCl·2H2O 饱和时的相平衡,构建了干盐立体相图,明确划分了各相区,并进行分析与讨论。
1 实验部分
1.1 实验试剂和装置
试剂:NaCl、KCl、NaNO3、Na2SO4、KNO3、MgSO4·7H2O、Mg(NO3)2·6H2O 均为分析纯或基准试剂,去离子水(pH≈6.6、电导率<1×10-4S·m-1);仪器:DHJF-4010 低温恒温搅拌反应浴(范围-40~99℃,精度±0.2℃);754 型紫外可见分光光度计;X 射线衍射仪(D8 advance,Bruker,德国)。
1.2 实验方法
1.2.1 相平衡研究 采用等温溶解平衡法[22],依据次级体系的共饱点,选取实验点计算其组成,准确称量样品放入玻璃瓶中,加入去离子水,搅拌溶解,放入-15℃低温恒温反应浴搅拌直至平衡。平衡时间的确定基于液相组分不再随时间而变化,预实验表明该体系达到平衡时间至少30 h,静置时间至少6 h。待固液相两者完全分离后,用预先在低温下冷藏的取样器取上清液稀释到容量瓶中分析其组成,取出固相,用X射线晶体衍射法鉴定其组成。
1.2.2 动态降温实验研究 配制模拟卤水样品,置于-15℃的低温恒温反应浴中,当温度达到目标温度后取上层清液,分析测定其液相组成。
1.3 化学分析方法
参考文献[23-24]方法,Cl-:硝酸银容量法,相对误差≤±0.3%;Mg2+:EDTA 容量法,相对误差≤±0.5%;K+:四苯硼钠重量法,相对误差≤±0.2%;SO42-:比浊法,相对误差≤±0.2%;NO3-:重铬酸钾氧化法,相对误差≤±0.6%;Na+:差减法。每个样品均进行三次平行测定,结果取其平均值,以保证测定结果的准确性。固相鉴定采用X射线晶体衍射法综合进行。
2 结果与讨论
2.1 -15℃、NaCl·2H2O 饱和条件下该六元体系的固液相平衡
2.1.1 相平衡数据 在-15℃、NaCl·2H2O 饱和条件下该六元体系含有四个相关的五元子体系和六个四元体系,溶解度数据见表1。
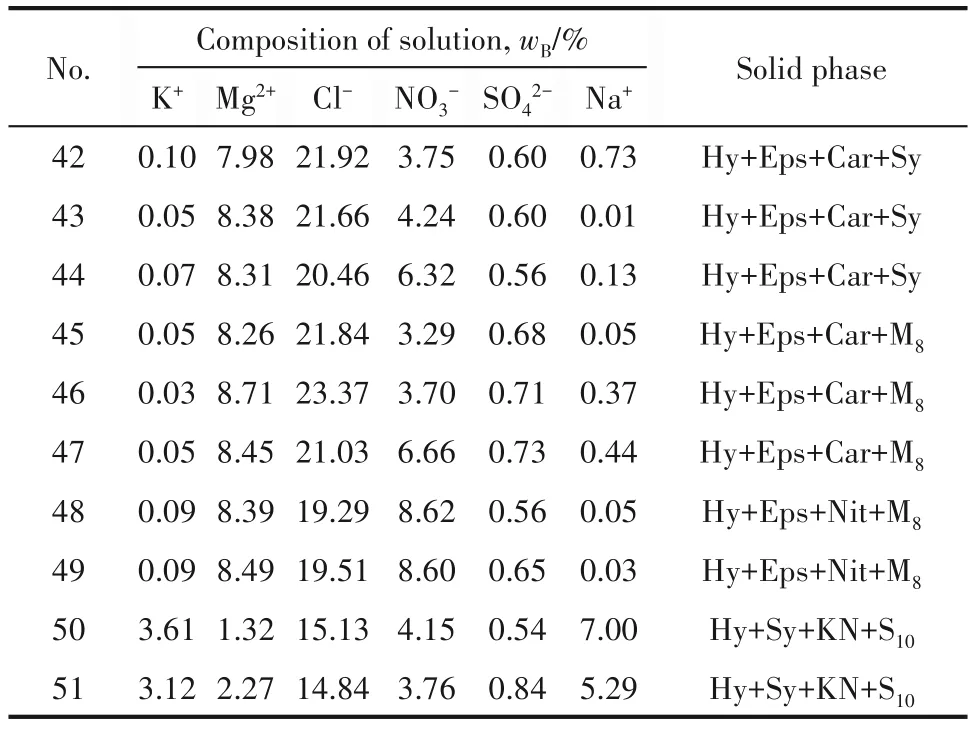
2.1.2 相图的构建 结合文献[3]采用正三棱柱来表示该体系的无氯无水干盐相图,水和氯化钠的含量可以另外用水图和氯图表示,也可以隐含在实验数据点中,直接进行计算。正三棱柱干盐相图纵坐标为SO42-离子的Jänecke 指数,底面三角形顶点分别为K+、Mg2+、NO3-,代表三个三元体系中与NaCl·2H2O共饱的点,分别对应体系:Na+, K+//Cl--H2O、Na+,Mg2+//Cl--H2O和Na+//Cl-,NO3--H2O;空间三条棱和底面三条边分别对应六个四元体系Na+,K+//Cl-,SO42--H2O、Na+, Mg2+//Cl-, SO42--H2O、Na+//Cl-, NO3-, SO42--H2O、Na+,K+,Mg2+//Cl--H2O、Na+,K+//Cl-,NO3--H2O 和Na+,Mg2+//Cl-,NO3--H2O;一个底面和三个侧面分别对应四个五元体系Na+,K+,Mg2+//Cl-,NO3--H2O、Na+,K+, Mg2+//Cl-, SO42--H2O、Na+, Mg2+//Cl-, NO3-, SO42--H2O和Na+,K+//Cl-,NO3-,SO42--H2O;内部则为该六元体系中与NaCl·2H2O 共饱区域。根据表1 中的溶解
度数据,分别计算出SO42-、Mg2+、2NO3-的Jänecke 指数,单位为mol/(100 mol [2K++Mg2++2NO3-]),由此构建出相图见图1 和图2,为更加直观和清晰,做出各盐的结晶相区分割图如图3所示。

表1 -15℃,在NaCl·2H2O饱和下Na+,K+,Mg2+//Cl-,NO3-,SO42--H2O的溶解度Table 1 The solubilities of Na+,K+,Mg2+//Cl-,NO3-,SO42--H2O saturated with NaCl·2H2O at-15℃
续表1
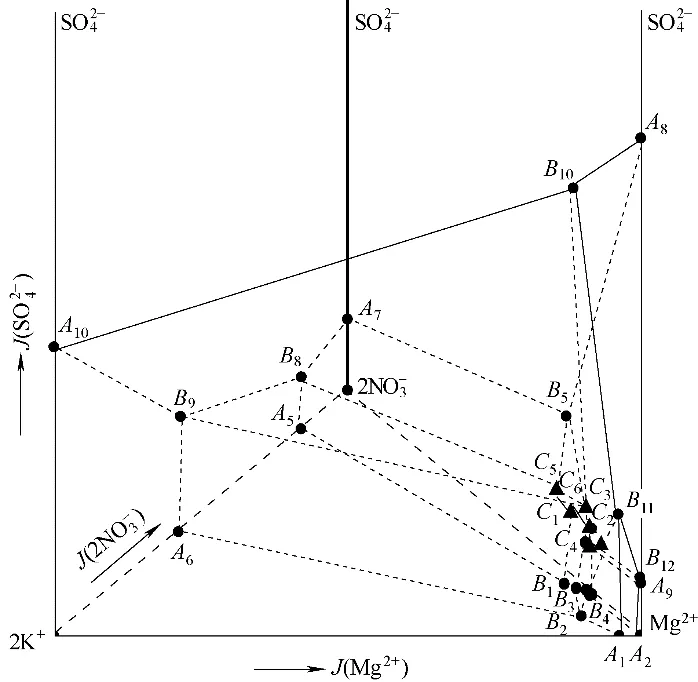
图1 -15℃,NaCl·2H2O饱和下六元体系Na+,K+,Mg2+//Cl-,NO3-,SO42--H2O的相图(仅绘出共饱点)Fig.1 Phase diagram of the system Na+,K+,Mg2+//Cl-,NO3-,SO42--H2O saturated with NaCl·2H2O at-15℃(only invariant points)

图2 图1的局部放大图Fig.2 Partial enlargement diagram of Fig.1

图3 图2中各结晶区的分割图Fig.3 The shapes of crystallization regions of Fig.2
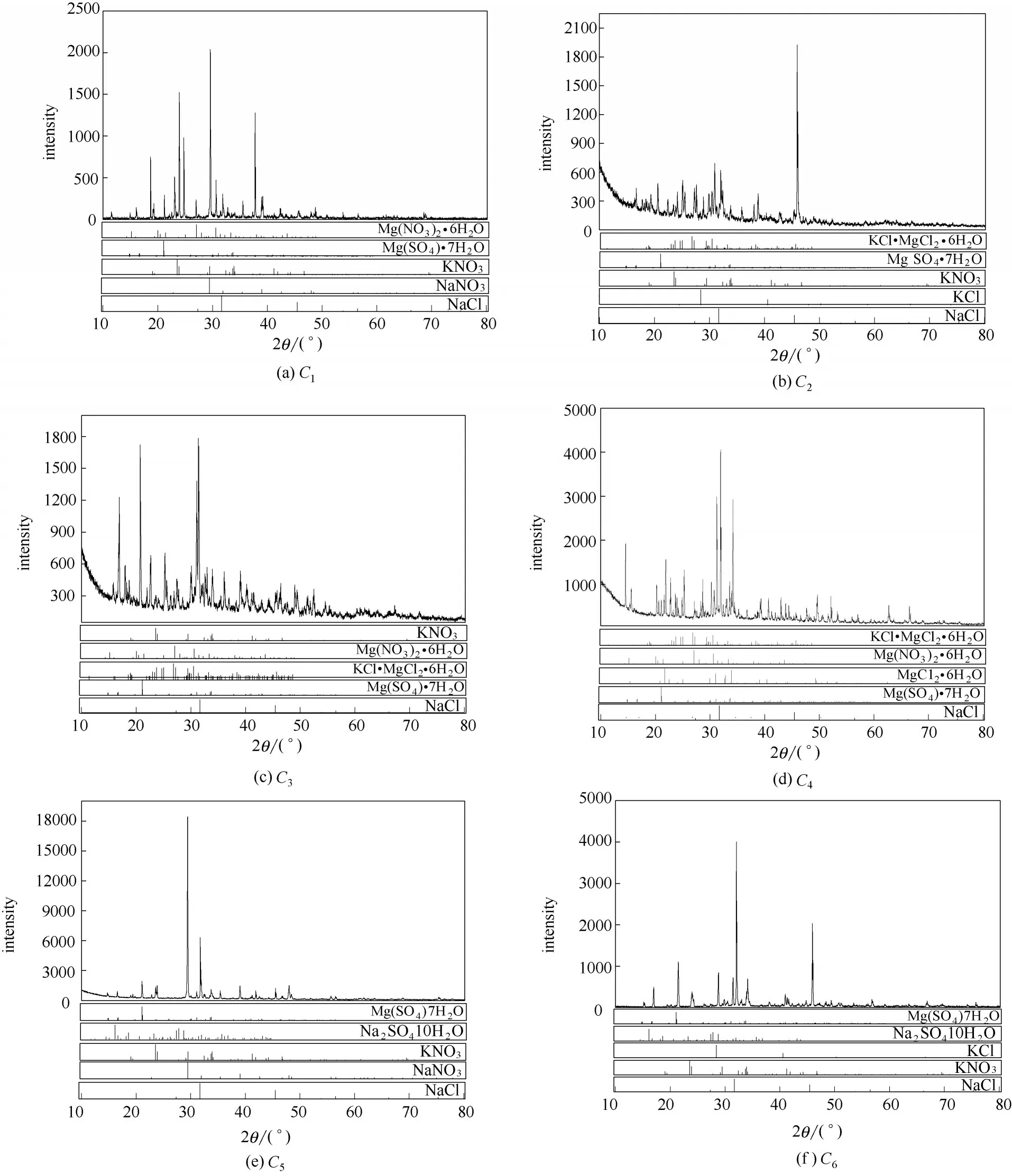
图4 共饱点C1、C2、C3、C4、C5和C6的固相XRD谱图Fig.4 XRD patterns of solid phase of the invariant points C1,C2,C3,C4,C5 and C6
2.1.3 结果分析与讨论 该六元体系相图中有六个零变量点和八个两盐结晶区,仅存在一种复盐。与25℃下的相图相比,零变量点由25 个减少至6个、复盐由6 种减少至1 种,相关系大大简化。采用X 射线衍射仪对各个零变量点的固相进行鉴定,得到XRD 谱图,如图4 所示。结合文献[13-14,25-29],推断NaCl的结晶形式为NaCl·2H2O,MgCl2的结晶形式为MgCl2·8H2O。文献[13-14,25,30-32]指出硫酸镁的结晶形式可能是MgSO4·11H2O或MgSO4·7H2O,但均没有进行实验鉴定,本文通过XRD,并结合部分文献,基本推断硫酸镁以MgSO4·7H2O(JPCDS No. 36-0419)的形式存在。由于盐的水合物形式只有在特定的温度和压力范围内才稳定,随着温度的变化水合物形式变化很快,在室温下二水氯化钠和八水氯化镁极易脱水。此外,由于实验条件和设备的限制,没有相应的低温X 射线衍射测试仪,用常温下的X 射线衍射法很难检测到NaCl·2H2O 和MgCl2·8H2O,故本文中XRD 谱图中显示为无水NaCl(JPCDS No. 05-0628)和MgCl2·6H2O(JPCDS No. 25-0515)。此外,其他几种盐对应的PDF 标准卡片分别为:Na2SO4·10H2O(JPCDS No. 11-0647)、KCl(JPCDS No. 41-1476)、KNO3(JPCDS No. 05-0377)、NaNO3(JPCDS No. 36-1474)、KCl·MgCl2·6H2O(JPCDS No. 21-1353)、Mg(NO3)2·6H2O(JPCDS No.14-0101)。
相图的八个两盐结晶区分别为:Na2SO4·10H2O+NaCl·2H2O(A7A8A10B5B8B9C5C6)、NaNO3+NaCl·2H2O(A3A5A7B1B5B6B8C1C5)、KCl+NaCl·2H2O(A1A6A10B2B9B10B11C2C6)、KNO3+NaCl·2H2O(A5A6B2B3B8B9C1C2C3C5C6)、MgSO4·7H2O+NaCl·2H2O(A8A9B5B6B7B10B11B12C1C2C3C4C5C6)、MgCl2·8H2O+NaCl·2H2O(A2A4A9B4B7B12C4)、Mg(NO3)2·6H2O+NaCl·2H2O(A3A4B1B3B4B6B7C1C3C4)、KCl·MgCl2·6H2O+NaCl·2H2O(A1A2B2B3B4B11B12C2C3C4)。由此可见低温时,NaCl·2H2O 和Na2SO4·10H2O 的共晶区最大,Na2SO4溶解度最小,在降温过程中易于从溶液中结晶出来。
2.2 不同组成特征的卤水动态降温析盐规律
按照实际生产中卤水的组成[3],配制了编号为1#和2#的模拟卤水样品,进行降温实验,组成见表2。将实验过程中的液相组成的Jänecke 指数标在-15℃,NaCl·2H2O 饱和条件下六元体系Na+, K+,Mg2+//Cl-, NO3-, SO42--H2O 相图上,降温过程中液相组成变化趋势见图5,各离子的百分含量随温度的变化趋势见图6。

表2 卤水组成Table 2 Brine compositions
图5 1#和2#卤水样品降温过程中液相组成变化趋势Fig.5 Change trend of liquid composition of 1#and 2#brine in cooling process
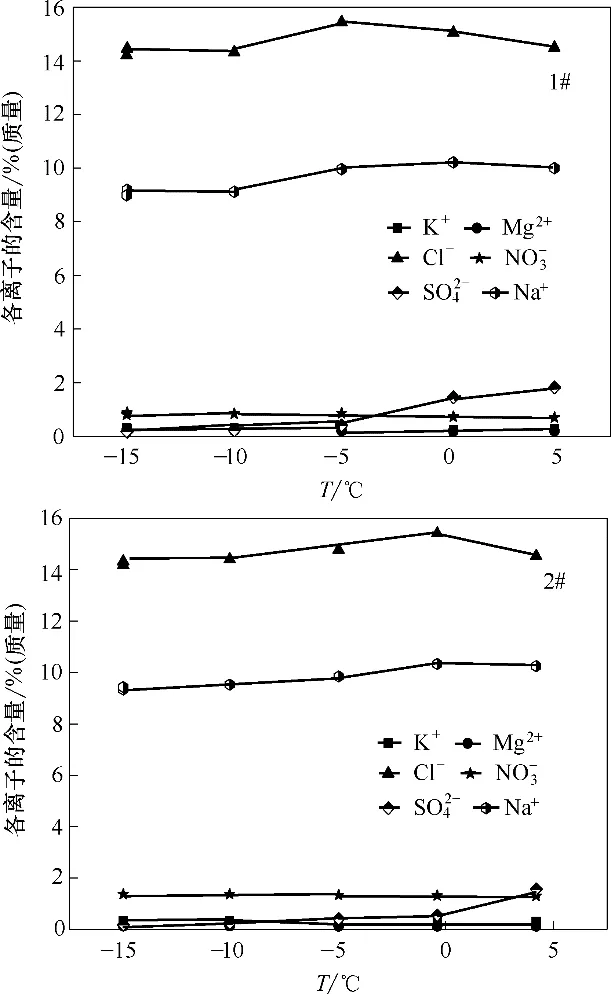
图6 1#和2#卤水样品液相中各离子含量随温度的变化Fig.6 The contents of ions change with temperature in liquid phase of 1#and 2#brine
由图5 和6 可知,1#和2#实验体系在降温至-15℃的过程中,液相组成中硫酸根含量持续减少,温度降到0℃左右时,液相中SO42-含量减少明显;K+和Mg2+含量逐渐增加,推断是由于液相中Na+和SO42-离子以固相Na2SO4·10H2O 形式大量析出,导致水量减少所引起的。对应于相图上降温过程中复盐结晶区逐渐缩小至消失,Na2SO4·10H2O 的结晶区逐渐扩大,1#和2#实验体系始终在Na2SO4·10H2O 的结晶区,因此不断析出。通过计算,在降温至-15℃时,卤水中大约90%的硫酸盐以Na2SO4·10H2O 的形式结晶出来,可以被去除。
3 结 论
(1)六元体系Na+, K+, Mg2+//Cl-, NO3-, SO42--H2O在-15℃、NaCl·2H2O 饱和条件下的相图中有六个零变量点和八个两盐结晶区,其中只存在一种复盐KCl·MgCl2·6H2O,与25℃下的相图相比,-15℃下的相关系大大简化。
(2)针对新疆硝酸盐型卤水,低温冷冻可以去除卤水中大部分硫酸根,有利于硝酸盐的分离。
(3)六元体系在-15℃、NaCl·2H2O 饱和的条件下的相平衡研究可以为含钾及硝酸盐卤水在降温或蒸发等过程中探索液相组成变化和析盐规律提供理论基础。

