2'-岩藻糖基乳糖的酶法合成研究进展和展望
史然,江正强
(中国农业大学食品科学与营养工程学院,北京 100083)
人乳寡糖(human milk oligosaccharides,HMOs)是人乳中一系列结构复杂、不可消化的碳水化合物,对婴幼儿的健康及生长发育起到关键作用。HMOs 在初乳中含量为22~24 g/L,在正常乳中含量为5~12 g/L,是人乳中仅次于脂肪和乳糖的第三大固体成分。HMOs在牛乳及其他哺乳动物乳中含量极低[1-2]。目前,母乳中已发现200 多种HMOs,已完全解析将近100 种HMOs 的结构[3]。根据单糖组成及结构特点[图1(a)],HMOs 又分为中性岩藻糖基(neutral fucosylated)、中性非岩藻糖基(neutral non-fucosylated)、唾液酸(sialylated)和其他HMOs(表1)[4]。2'-岩藻糖基乳糖(2'-fucosyllactose,2'-FL)在HMOs 中含量最为丰富,具有调节肠道菌群、抵抗病原菌的黏附、免疫调节及促进神经系统发育和修复等多种功能活性[5]。FDA和欧盟均已批准2'-FL和乳酰-N-新四糖(lacto-N-neotetraose,LNnT)可添加到婴幼儿奶粉、膳食补充剂以及医疗食品中。目前,工业上已成功生产出包括2'-FL 在内的几种HMOs,Glycom A/S、 Jennewein Glycosyn/Friesland Campina Domo、Inbiose/DuPont等几家公司是HMOs的主要生产商。2'-FL的主要获取途径为从母乳中提取、化学合成、全细胞合成以及酶法合成[6]。
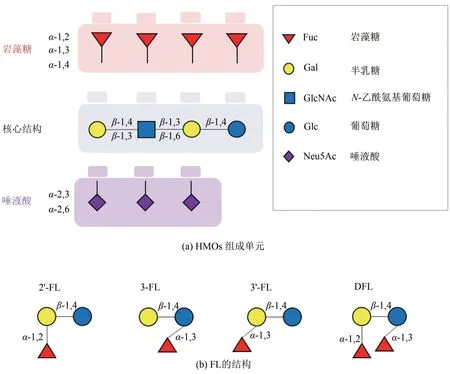
图1 HMOs组成单元及连接方式(a)和几种FL的结构(b)[4]Fig.1 General structure and linkage types of HMOs(a)and structures of fucosyllactoses(b)[4]
1 岩藻糖基乳糖(FL)
人乳中主要寡糖的结构及含量见表1。2'-FL在HMOs 中约占31%(摩尔分数),含量为0.06~3.93 g/L,是人乳中相对丰度最高的寡糖;3-岩藻糖基乳糖(3-fucosyllactose,3-FL)在HMOs 中约占5%,含量为0.03~1.34 g/L,2',3-二岩藻糖基乳糖(2',3-difucosyllactose, 2',3-FL 或DFL) 在HMOs中约占4%,含量为0.28~0.43 g/L[4,6]。
FL 由岩藻糖和乳糖连接而成[图1(b)],岩藻糖残基可通过α-1,2-糖苷键连接到乳糖的半乳糖残基上构成2'-FL;或通过α-1,3-糖苷键连接到乳糖还原端的葡萄糖构成3-FL;或同时通过这两种糖苷键连接到乳糖上构成2',3-FL 或DFL[6]。另外,岩藻糖还可以通过α-1,3-糖苷键连接到乳糖的半乳糖残基上构成3'-岩藻糖基乳糖(3'-fucosyllactose,3'-FL)[7]。上述几种FL中,2'-FL、3-FL 和DFL 均存在于人乳中,3'-FL尚未在人乳中发现,有研究显示α-L-Fuc1,3Gal糖苷键存在于一种人乳低聚九糖的侧链上[8]。
2 2'-FL的功能活性
2'-FL具有多种功能活性,包括调节肠道菌群、抵抗病原菌的黏附、免疫调节及促进神经系统发育和修复等[6]。
2.1 调节肠道菌群
研究表明,2'-FL对婴儿早期肠道菌群的建立有重要影响[9]。体外试验发现,2'-FL可促进长双歧杆菌(Bifidobacterium longum,即B.longum)、两歧双歧杆菌(Bifidobacterium bifidum, 即B. bifidum)ATCC 15696、婴儿双歧杆菌(Bifidobacterium infantis,即B.infantis)M-63等双歧杆菌的增殖[10-13]。这些双歧杆菌利用2'-FL的机制基于自身表达的2'-FL转运体(ABC转运体)和/或相关的岩藻糖苷水解酶发挥相应功能。有研究发现B.bifidum可将α-1,2-岩藻糖苷酶分泌至胞外或细胞表面对2'-FL 进行水解,而B.longum和B.infantis则依靠细胞表面的ABC转运体先将2'-FL转运到胞内,再利用胞内的α-1,2-岩藻糖苷酶对2'-FL进行水解[14-15]。研究表明,一些肠杆菌科(Enterobacteriaceae)的菌株不能利用2'-FL[16]。
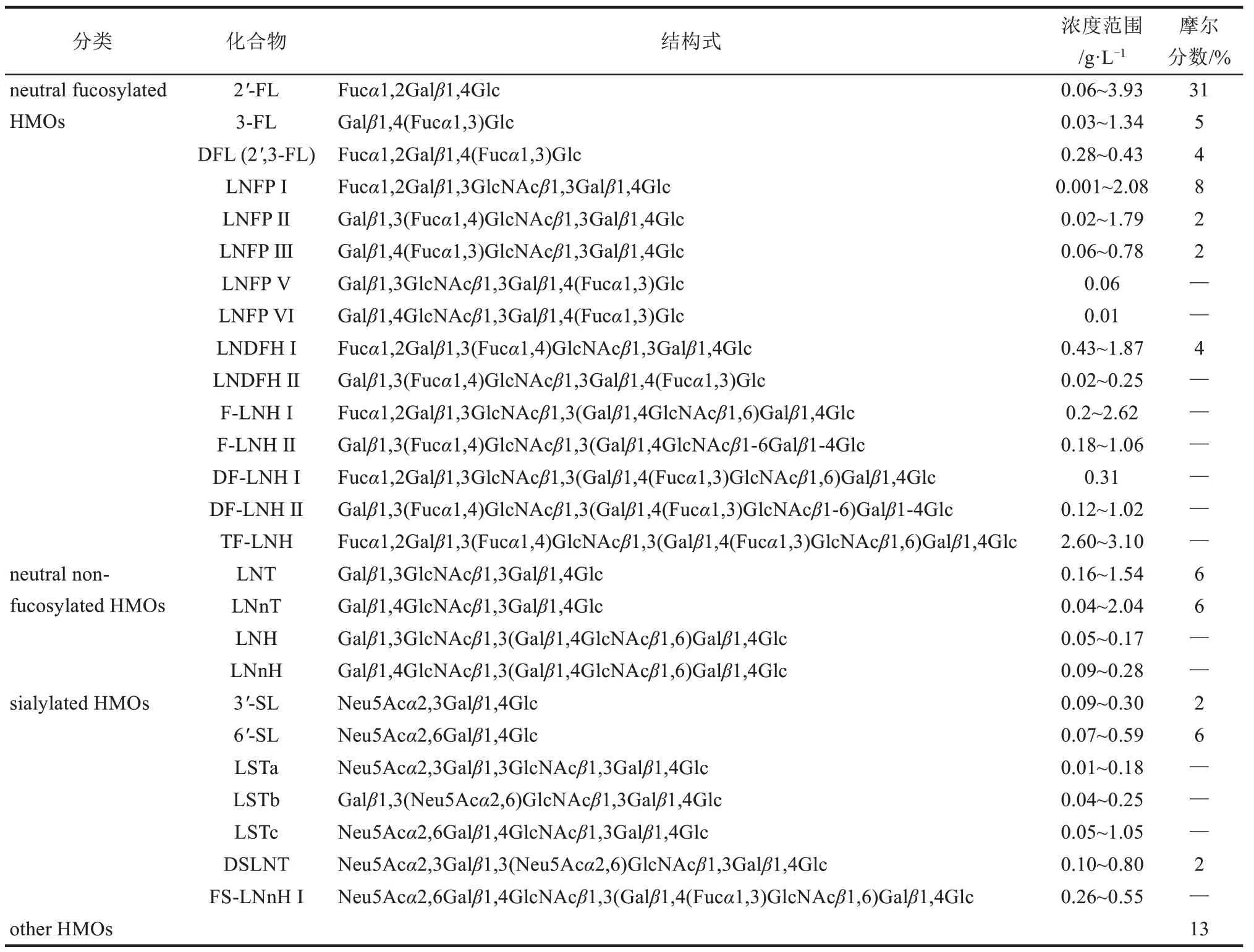
表1 主要HMOs的分类、结构及含量[4,6]Tab.1 Structures and contents of major HMOs[4,6]
2.2 抵抗病原菌的黏附
2'-FL可在肠上皮细胞表面形成一层糖萼或作为肠上皮细胞表面的糖蛋白或糖脂的类似物,竞争性地与一些病原菌结合,从而阻断病原菌与肠上皮细胞表面的糖蛋白或糖脂结合,降低新生儿的感染风险[17]。空肠弯曲杆菌(Campylobacter jejuni,C.jejuni)是导致婴儿细菌性腹泻的主要原因之一。体外试验发现,2'-FL 可降低C. jejuni的对肠上皮细胞的侵染(80%),降低肠上皮细胞促炎信号的释放。动物实验发现2'-FL 也可以降低C. jejuni对小鼠肠道的侵染(80%),并降低肠道炎症反应[18]。墨西哥一项关于婴儿肠道健康调查报告显示,当母乳中2'-FL含量较高时,所喂养婴儿的腹泻发生率降低。且2'-FL与各种原因引起的腹泻均呈剂量依赖关系[19]。
2.3 免疫调节
2'-FL 可直接作用于肠道上皮细胞,调节其基因表达,改变细胞表面多糖及细胞应答,具有显著的免疫调节作用[20]。2'-FL 对坏死性小肠结肠炎(NEC)具有较好的预防效果。体外研究表明,2'-FL可以降低致病性E. coli对Caco-2 细胞的黏附(18%)[21]。动物实验进一步发现,2'-FL 通过增强NEC 模型鼠的肠系膜血管灌注来降低小肠的损伤程度[22]。研究还表明,2'-FL 可通过诱导白细胞介素10+(IL-10+)和稳定肥大细胞来缓解小鼠的过敏症状[23]。此外,补充2'-FL 可显著增加小鼠脾细胞中CD4+辅助性T 细胞、CD8+细胞毒性T 细胞和干扰素γ的产生,从而改善接种疫苗小鼠体液和细胞水平上的免疫应答[24]。
2.4 促进神经系统发育和修复
2'-FL 可缓解中风脑神经变性,通过抑制胞浆游离钙浓度([Ca++]i)、炎症反应和细胞凋亡起到神经保护的作用[25]。日常摄入2'-FL 还影响啮齿动物的认知领域并改善其学习和记忆能力[26]。
3 2'-FL的合成
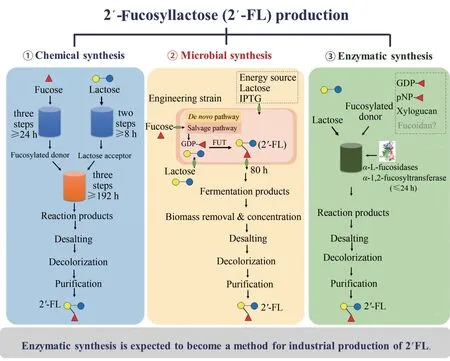
2'-FL的诸多功能活性使其成为婴幼儿配方奶粉的理想配料。将2'-FL作为食品配料的前提是2'-FL能稳定、大规模地生产,且达到食品级的安全要求。在早期科学研究中,HMOs是从母乳中分离出来的,由于人乳寡糖结构复杂,从中获得一定量单一结构的寡糖比较困难。目前,2'-FL的合成方法包括化学合成[27]、全细胞合成[28]和酶法合成[29],三种方法的工艺流程如图2所示。经过一系列的改进后,这些方法有望大规模、高效地合成2'-FL。
3.1 化学合成
近期,丹麦Glycom A/S公司报道了公斤级2'-FL的化学合成方法(图3)。2'-FL的化学合成过程主要包括三步,首先,以L-岩藻糖为起始底物经过3次反应合成岩藻糖基供体,得率为67%~72%;随后,以乳糖为起始原料经过两步反应合成乳糖受体,得率为52%;最后,岩藻糖基供体和乳糖受体经三步反应合成岩藻糖基乳糖。反应产物经过一步柱色谱分离,可获得纯度较高的2'-FL,得率为19.8%~27.3%[27]。化学方法存在大量有机试剂的使用、步骤繁杂、反应条件苛刻且产物得率低等问题,因此以L-岩藻糖为起始底物化学合成2'-FL 成本较高。2015 年9 月,由Glycom A/S 公司化学合成的2'-FL在美国获得美国食品药品监督管理局(FDA)审批。目前化学合成的2'-FL主要用于临床前和临床研究。
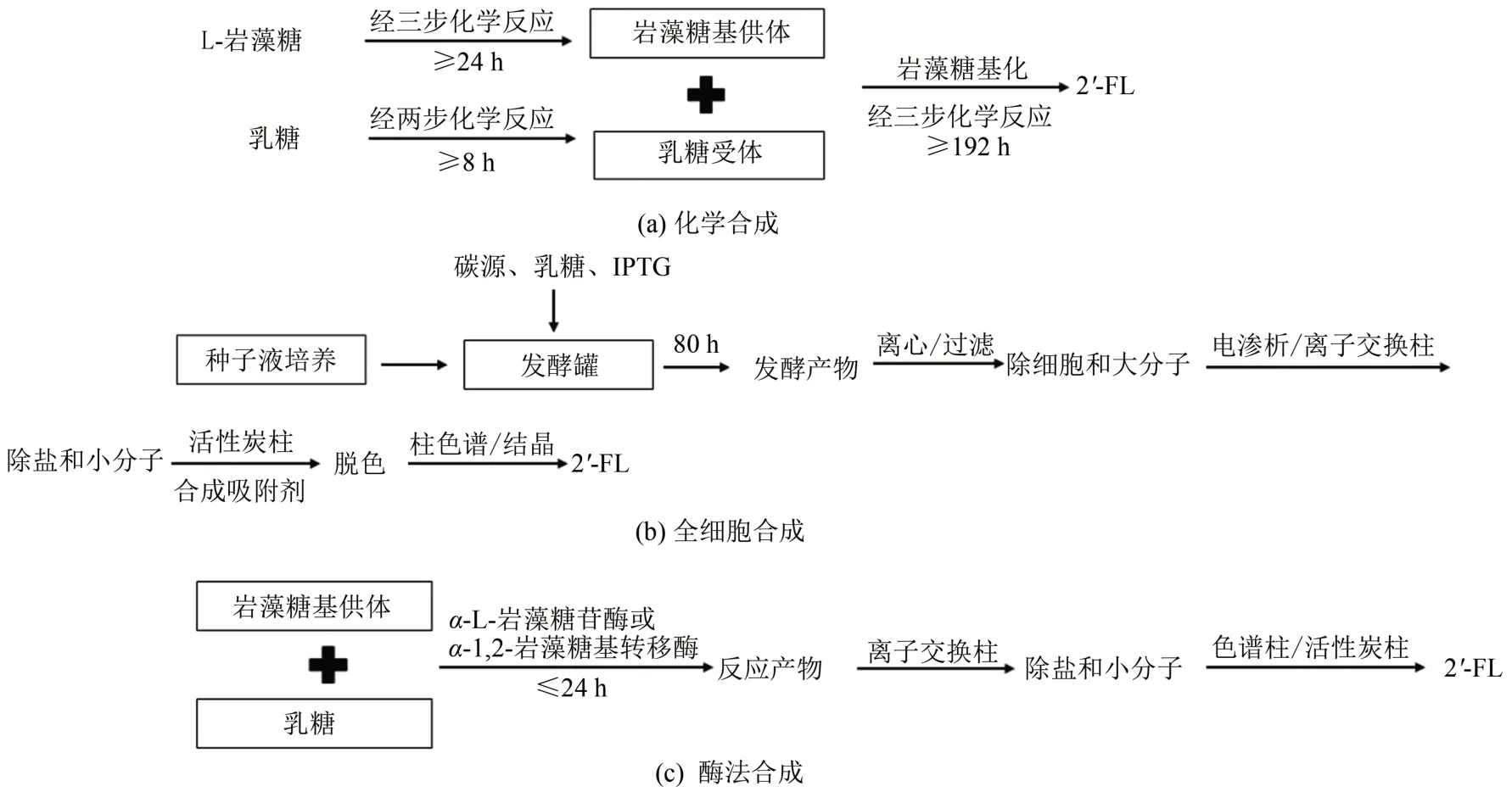
图2 2'-FL的生产工艺流程Fig.2 Process flow charts of 2'-FL production by chemical synthesis strategy(a)cell factory approach(b)and enzymatic synthesis method(c)
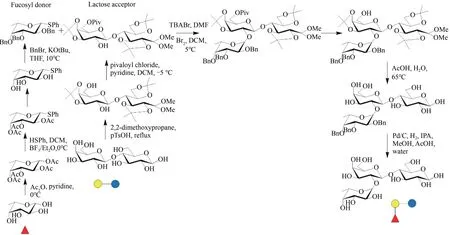
图3 2'-FL的化学合成[27]Fig.3 Chemical synthesis strategy for 2'-FL
3.2 全细胞合成
全细胞合成2'-FL 基于微生物自身(或模拟)的代谢机制合成GDP-岩藻糖和外源表达的α-1,2-岩藻糖基转移酶(图4),是目前工业上生产2'-FL的主要方法。α-1,2-岩藻糖基转移酶在细胞内的功能性表达、GDP-岩藻糖在胞内的积累、可转移到胞内并且可积累的乳糖(糖基受体)以及降低副产物对相关酶的抑制作用,都是全细胞合成2'-FL的关键因素[6,30]。
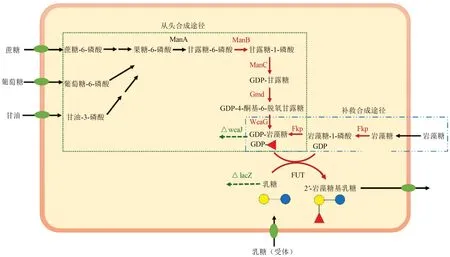
图4 2'-FL的两种生物合成途径Fig.4 Two biosynthetic approaches of 2'-FL
α-1,2-岩藻糖基转移酶是全细胞合成2'-FL 的关键酶。有研究对不同来源的α-1,2-岩藻糖基转移酶合成2'-FL 的能力进行筛选,包括幽门螺旋杆菌(Helicobacter pylori,H. pylori)、雪貂螺杆菌(Helicobacter mustelae,H. mustelae)、胆型螺旋杆菌(Helicobacter bilis,H. bilis)、E. coliO128:Bl2、E.coliO86、E.coliO127、C.jejuni、脆弱拟杆菌(Bacteroides fragilis,B. fragilis)和普通拟杆菌(Bacteroides vulgatus,B. vulgatus) ATCC 8482 来源的α-1,2-岩藻糖基转移酶,发现H.pylori α-1,2-岩藻糖基转移酶(futC)合成2'-FL 的得率最高[31]。目前,多数报道以及工业上生产2'-FL 使用的α-1,2-岩藻糖基转移酶均为futC。因此,挖掘稳定、易获得且活性较高的α-1,2-岩藻糖基转移酶是全细胞合成2'-FL要素之一。
全细胞合成2'-FL 的另一关键因素是提高胞内GDP-岩藻糖的浓度。GDP-岩藻糖的生物合成途径有两种:从头合成途径(de novopathway)和补救合成途径(salvage pathway)(图4)。提高从头合成途径中GDP-岩藻糖水平的方法有:过表达将甘露糖1-磷酸转化为果糖6-磷酸和GDP-岩藻糖的各种酶的相关基因(ManB、ManC、Gmd和WcaG),过表达rcsA(或rcsB)基因(E.coli中可乐酸操纵子的正向调控基因),敲除wcaJ基因(可乐酸合成相关基因)[32],以及上调与还原型辅酶Ⅱ(NADPH)和NADP+之间比例相关的基因表达[33]。提高补救合成途径中GDP-岩藻糖浓度的方法有:过表达E. coli中L-岩藻糖转运体基因(FucP)和B.fragilis岩藻糖激酶/岩藻糖-1-磷酸鸟苷酰转移酶基因[31],敲除岩藻糖-1-磷酸醛缩酶(FucA)[34]、岩藻糖异构酶(FucI)和岩藻糖激酶(FucK)等参与L-岩藻糖代谢的相关酶基因,以及过表达gsk、gpt、gmk和ndk等参与鸟苷三磷酸(GTP)生物合成的相关基因[33]。提高胞内乳糖(受体)浓度的方法有敲除胞内乳糖酶基因(lacZ-)以及对乳糖乙酰化酶基因(lacA)和lon基因进行突变。
目前补救合成途径是量产2'-FL 的最优途径,以L-岩藻糖为起始底物对菌体的代谢影响较低,但成本较高[35]。而从头合成途径中某些基因的过量表达会打破宿主的代谢平衡,影响菌体生长,限制GDP-岩 藻 糖 和2'-FL 产量的进一步提高[36]。Drouillard 等[37]在E. coliJM107(lacZ-、lacY+、wcaJ-)中过表达岩藻糖基转移酶基因(futC)和可乐酸操纵子正向调控基因(rcsA),以葡萄糖和乳糖为底物,分批补料发酵后2'-FL的产量达15 g/L(胞内3 g/L,胞外11 g/L)。Merighi 等[38]在E.coliW3110(lacZ-、lacY+、lacA-、wcaJ-、lon-、thyA)中过表达futC、rcsA和胸苷酸合成酶基因(thyA),以甘油和乳糖为底物,以色氨酸为诱导剂,2'-FL的产量可达25 g/L。Baumgärtner 等[34]在E. coliJM109(lacZ-、manB+、manC+、gmd+、wcaG+、futC+、fkp+、fucI-、fucK-)中过表达futC,以甘油、乳糖和岩藻糖为底物,通过分批补料发酵,2'-FL的产量可达20.3 g/L。Chin等[39]在E.coliBL21 star(DE3)(lacZ-、manB+、manC+、gmd+、wcaG+)中过表达futC,以甘油和乳糖为底物,通过分批补料发酵2'-FL 的产量可达6.4 g/L。该团队[33]在E.coliBL21 star(DE3)(lacZ-、fucI-、fucK-、lacY+、lacA+)中过表达futC和fkp,以甘油、岩藻糖和乳糖为底物,通过分批补料发酵,2'-FL 的产量可达23.1 g/L。在以上研究的基础上,该团队[28]进一步敲除阿拉伯糖异构酶基因(AraA)和鼠李糖异构酶基因(RhaA)来提高补救合成途径中GDP-岩藻糖的含量,2'-FL的产量可达47 g/L。近年来,在更为安全的宿主菌中构建2'-FL 的生物合成途径成为研究热点,如无抗生素E. coli,枯草芽孢杆菌(Bacillus subtilis,B. subtilis)、 酿酒酵母(Saccharomyces cerevisiae,S.cerevisiae)和耶氏解脂酵母(Yarrowia lipolytica,Y. lipolytica) 等。Deng 等[40]在B. subtilis(fucP+、yesZ-)中构建了GDP-岩藻糖的补救合成途径,进一步表达了futC来合成2'-FL,以乳糖和岩藻糖为底物,2'-FL 的产量可达5.01 g/L。Hollands等[41]分别在S.cerevisiae和Y.lipolytica中构建了GDP-岩藻糖的从头合成途径,进一步表达了futC,以葡萄糖和乳糖为底物,2'-FL的产量分别为15 g/L和24 g/L。全细胞合成2'-FL的最高产量是Jennewein Glycosyn公司报道的180 g/L[4]。
全细胞合成2'-FL 发酵周期一般为数天,发酵产物经一系列处理来纯化2'-FL,包括对发酵产物进行离心、过滤(微滤、超滤、纳滤)除去细胞和生物大分子,经电渗析和离子交换柱除盐和生物小分子,经活性炭柱和合成吸附剂脱色,再经柱色谱或结晶法纯化2'-FL(除单糖、二糖及其他非HMOs成分),最后对2'-FL进行喷雾干燥并对其成品进行分析[4]。目前,FDA 和欧盟批准了多家公司生物合成的2'-FL 可添加到婴幼儿奶粉、膳食补充剂以及医疗食品中。
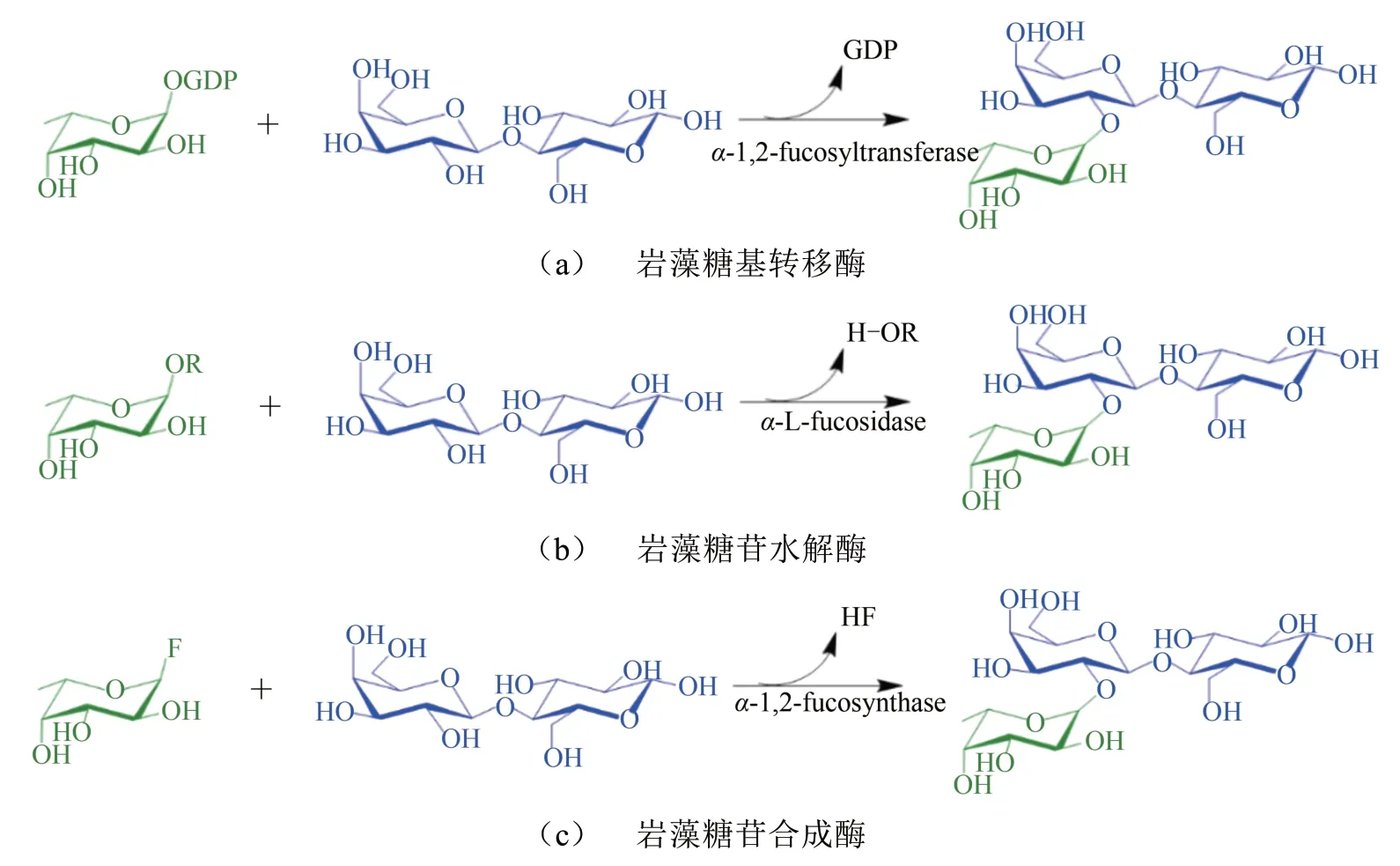
图5 2'-FL的酶法合成策略Fig.5 Enzymatic synthesis strategies for 2'-FL using α-1,2-fucosyltransferase(a)α-L-fucosidase(b)or α-1,2-fucosynthase(c)
3.3 酶法合成
酶法合成寡糖的优点是具有一定的立体选择性(stereo-selectivity) 和 区 域 选 择 性(regioselectivity)。寡糖合成中常用的两类酶包括糖基转移酶(Glycosyltransferases,EC 2.4)和糖苷水解酶(Glycosidases,EC 3.2.1)。糖基转移酶(GTs)将一个单糖分子从核苷酸糖基供体转移到受体上[42]。这类酶的主要缺点是稳定性低、不易获得,且需要使用昂贵的核苷酸糖基为供体。糖苷水解酶(GHs)一般用于催化糖苷键的水解反应,在特定条件下也可以催化活化糖基供体的转糖苷反应来合成糖苷键。由于合成的产物会被进一步水解,转糖苷反应产物的得率一般低于40%~50%[43]。
3.3.1α-1,2-岩藻糖基转移酶在2'-FL合成中的应用
不同的岩藻糖基转移酶(fucosyltransferases,FUT)可专一性合成α-1,2、α-1,3、α-1,4 和α-1,6等糖苷键。α-1,2-岩藻糖基转移酶可催化GDP-岩藻糖和乳糖发生基团置换,生成2'-FL 和鸟苷二磷酸(GDP)[图5(a)]。由于价格昂贵,以GDP-岩藻糖为原料生产2'-FL受到限制。有研究以成本较低的GDP-D-甘露糖为起始底物经三步酶法合成2'-FL。首先,利用Gmd酶(GDP-甘露糖4,6-脱水酶,Escherichia coliK-12)催化GDP-D-甘露糖合成GDP-4-酮-6-脱氧甘露糖;第二步,利用WcaG 酶(GDP-岩藻糖合成酶,Escherichia coliK-12)催化GDP-4-酮-6-脱氧甘露糖和NADPH 合成GDP-岩藻糖(得率为78%);第三步,α-1,2-岩藻糖基转移酶(FucT2,H.pylori)催化GDP-岩藻糖和乳糖合成2'-FL(得率为65%)[29]。提高岩藻糖基转移酶的可溶性表达、提高岩藻糖基转移酶以乳糖为受体时的催化活性,有助于提高FL的得率。有研究通过密码子优化和对C 端进行系统截短来提高H.pylori α-1,3-岩藻糖基转移酶的可溶性表达,进一步通过定向进化技术来提高H.pylori α-1,3-岩藻糖基转移酶对乳糖的催化活性,获得一个可高效合成3-FL的突变酶(提高15倍)[44]。Tan等[45]同样使用定向进化技术来提高H.pylori α-1,3-岩藻糖基转移酶对乳糖的催化效率,经过3轮筛选,获得一个可高效合成3-FL的突变酶(提高14倍)。这些对α-1,3-岩藻糖基转移酶的改造方法,都可以为提高α-1,2-岩藻糖基转移酶的可溶性表达和催化效率提供借鉴。另外,有研究筛选到一个新型Thermosynechococcus elongatusBP-1α-1,2-岩藻糖基转移酶,该酶在以含β-1,3-半乳糖苷的人类血型H抗原为受体时表现出较高的催化活性,产物得率≥94%[46]。因此,挖掘新型、可催化乳糖岩藻糖基化的α-1,2-岩藻糖基转移酶也是提高岩藻糖基转移酶活性的方法之一。
3.3.2α-L-岩藻糖苷酶在2'-FL合成中的应用
α-L-岩藻糖苷酶(EC 3.2.1.51)是一类外切糖苷水解酶,能特异性水解岩藻糖基寡糖或其他岩藻糖基化合物上连接的岩藻糖[47]。α-L-岩藻糖苷酶广泛存在于动物、植物和微生物中,其中报道最多的是微生物来源的α-L-岩藻糖苷酶,如来源于拟杆菌(Bacteroidessp.)、芽孢杆菌(Paenibacillussp.)、坦纳菌(Tannerellasp.)、黄单胞菌(Xanthomonassp.)、热袍菌(Thermotoga sp.)、双歧杆菌(Bifidobacteriumsp.)和乳酸菌(Lactobacillussp.)等的岩藻糖苷酶[47-48]。目前,岩藻糖苷酶主要分为4 个家族,分别是糖苷水解酶(GH)29、95、141和151 家族。根据反应机制,α-L-岩藻糖苷酶可分为保留型和反转型,仅保留型GH29和GH151家族的岩藻糖苷酶具有潜在的转糖苷活性[47]。当前,许多研究利用GH29 家族的α-L-岩藻糖苷酶的转糖苷活性来合成FL[图5(b)]。研究表明,产碱杆菌(Alcaligenessp.)α-L-岩藻糖苷酶可催化4-对硝基苯-α-L-岩藻糖苷(pNP-FUC)和乳糖合成3'-FL,得率为34%[7];海栖热袍菌(Thermotoga maritima,T.maritima)α-L-岩藻糖苷酶可催化pNP-FUC和乳糖合成FL,得率为32.5%[49];禾谷镰刀菌(Fusarium graminearum,F.graminearum)α-L-岩藻糖苷酶能以木葡聚糖(XyG)和乳糖为底物,合成2'-FL,得率为14%[50]。另外,土壤宏基因组来源的α-L-岩藻糖苷酶能以pNP-FUC 和乳糖为底物获得FL,得率为6%[51]。然而这些酶的转糖苷效率较低,无法应用于FL 的大规模合成。因此,发掘具有高转糖苷活性、有较好立体选择性及区域选择性的α-L-岩藻糖苷酶具有重要意义。
目前,随着酶工程技术的发展,一些没有转糖苷活性的酶可被改造成高效的转糖苷酶,如糖苷合成酶(glycosynthase)[52]。岩藻糖苷合成酶(fucosynthase)是对反转型岩藻糖苷酶进行突变后获得的缺失了催化亲核残基的突变酶,这类酶可将岩藻糖残基从一个有相反异头构型的活化供体上(如氟代岩藻糖,FucF)转移到受体上,由于合成产物不被水解,产物得率较高[图5(c)]。B. bifidum α-1,2-L-岩藻糖苷酶(AfcA)是一个GH95 家族的反转型岩藻糖苷酶,该酶可特异性水解α-1,2-L-岩藻糖苷键。Wada 等[53]对AfcA 的某些氨基酸进行突变后获得一个具有转糖苷活性的突变酶(D766G),该酶可催化FucF(10 mmol/L)和乳糖(30 mmol/L)合成2'-FL,得率为6%。该团队[54]继续对该酶进行组合突变,获得一个具有更高转糖苷活性的突变酶D766G,该酶可以催化FucF(10 mmol/L)和乳糖(30 mmol/L)合成2'-FL,得率为88%。
另一种提高转糖苷产物得率的方法是打破保留型糖苷水解酶转糖苷和水解反应之间的平衡(转糖苷/水解比例),使反应朝着产物累积的方向进行。该方法基于酶的定向进化或理性设计,目的是得到一个对产物的水解能力降低、但与受体结合能力增强的突变酶。有研究通过定向进化技术对T.maritima α-L-岩藻糖苷酶(TmRfuc)进行随机突变和筛选,获得一个转糖苷活性从7%提高至60%的突变酶[55]。该团队[56]进一步对B.longum α-1,3/4-L-岩藻糖苷酶(BiAfcB)进行半理性设计,得到转糖苷活性提高的突变酶,该酶能够以3-FL 为糖基供体,以LNT 为受体,合成LNFP Ⅱ,得率由12%升高到32%。
酶法合成2'-FL 反应条件温和可控,产物达到最高浓度时间短(≤24 h),反应体系中成分相对简单、易于纯化,如Albermann 等酶法合成2'-FL 的反应产物先经阴阳离子交换柱除盐,再经Sephadex G-10 凝胶柱一步纯化可得到纯度较高的2'-FL。由于缺乏成本较低、天然安全、可大量供应的糖基供体,目前酶法合成2'-FL 仅限于实验室规模(毫克级)[29]。使用α-1,2-岩藻糖基转移酶合成2'-FL 需要昂贵的核苷酸糖基为供体。使用α-L-岩藻糖苷酶合成2'-FL 多数采用pNP-FUC 作为糖基供体,该底物的缺点是反应产物中含有对硝基苯酚(pNP),不适用于食品领域,且成本也较高。因此,开发天然、经济的岩藻糖基供体是酶法用于2'-FL大规模合成的关键。目前潜在可用的天然岩藻糖基供体有两种,第一种是木葡聚糖(xyloglucan,XyG),另外一种是岩藻多糖。木葡聚糖广泛存在于双子叶植物的细胞壁中,一部分木葡聚糖的侧链上含有L-Fuc-α-1,2-Gal糖苷键[图6(a)],可作为一些α-L-岩藻糖苷酶的底物[57]。一些研究报道了可利用XyG 作为糖基供体来合成FL 的α-L-岩藻糖苷酶,如来源于F. graminearum、福赛斯坦纳菌(Tannerella forsythia,T. forsythia)和土壤宏基因组的α-L-岩藻糖苷酶,然而这些酶的转糖苷活性普遍较低。因此,继续挖掘能够以XyG 作为底物且转糖苷活性较高的α-L-岩藻糖苷酶是关键。另外,L-岩藻糖还大量存在于海藻和棘皮动物的岩藻多糖中,岩藻多糖主要由L-岩藻糖和硫酸酯基团组成,还含有少量半乳糖、葡萄糖醛酸、阿拉伯糖和蛋白质。海藻中水云目(Ectocarpales)和昆布目(Laminariales)产生的岩藻多糖主链由L-岩藻糖以α-1,3-糖苷键连接而成[图6(b)],而墨角藻目产生的岩藻多糖主链由L-岩藻糖以α-1,3-糖苷键和α-1,4-糖苷键交替连接而成[图6(b)][58]。Berteau 等[59]报道了来源于欧洲扇贝(Pecten maximus) 的α-L-岩藻糖苷酶可水解泡叶藻(Ascophyllum nodosum)岩藻多糖和2'-FL,后来又证实该岩藻糖苷酶具有转糖苷活性[60]。这类可同时水解岩藻多糖和2'-FL 的α-L-岩藻糖苷酶即为可利用岩藻多糖为底物合成2'-FL 的潜在酶。另外,将岩藻多糖作为合成2'-FL 或3-FL 的天然底物还要逐步解决以下问题:第一,所选岩藻多糖硫酸基团含量尽量低,或使用硫酸酯酶(Sulfatase)先将岩藻多糖侧链的硫酸基团水解;第二,使用岩藻聚糖硫酸酯酶(Fucoidanase)将岩藻多糖水解成低分子量的岩藻寡糖,以增加岩藻寡糖的溶解性和酶与岩藻寡糖的接触;第三,利用生物信息学分析工具根据目前报道的有类似性质的岩藻糖苷酶的基因序列,在基因库中筛选能够以岩藻寡糖为底物来合成2'-FL 的新型α-L-岩藻糖苷酶。
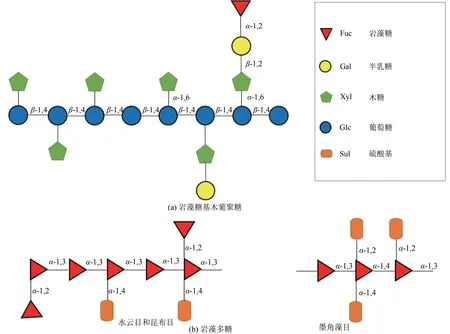
图6 岩藻糖基木葡聚糖和两种典型岩藻多糖的结构Fig.6 Structures of fucogalactoxyloglucan and two types of fucoidans
4 结语与展望
目前,2'-FL 可通过化学合成、全细胞合成和酶法合成来进行生产。化学法合成2'-FL 过程烦琐、耗时长、得率低且成本较高,在工业生产中受到限制。化学合成的2'-FL 在食品及医药领域中的应用也受到质疑。全细胞合成2'-FL 面临的问题也是成本相对较高。降低L-岩藻糖的成本、维持宿主胞内GDP-岩藻糖水平与菌体代谢之间的平衡以及发掘新型高活性α-1,2-岩藻糖基转移酶是关键。在更为安全的宿主中构建2'-FL 合成途径并提高产量是全细胞合成2'-FL 的发展方向。
酶法合成2'-FL 反应条件温和可控、反应时间短、产物易于纯化,具有较好的发展前景。降低GDP-岩藻糖的成本是将α-1,2-岩藻糖基转移酶应用于2'-FL 生产的关键。近年来,一部分具有转糖苷活性的α-L-岩藻糖苷酶成功应用于2'-FL 的合成。发掘新型、天然、经济的岩藻糖基底物(如木葡聚糖和岩藻多糖)以及高效转糖苷酶有助于α-L-岩藻糖苷酶在2'-FL 合成中的应用。在不久的将来,酶法合成有望成为工业上生产2'-FL 的方法。
符号说明



