合成生物学在探索生物图案形成基本原理中的应用与展望
周楠,夏婷颖,黄建东,
(1 中国科学院深圳先进技术研究院,中国科学院深圳合成生物学创新研究院定量工程生物学重点实验室,广东 深圳518055; 2 香港大学李嘉诚医学院,生物医学学院,香港 999077)
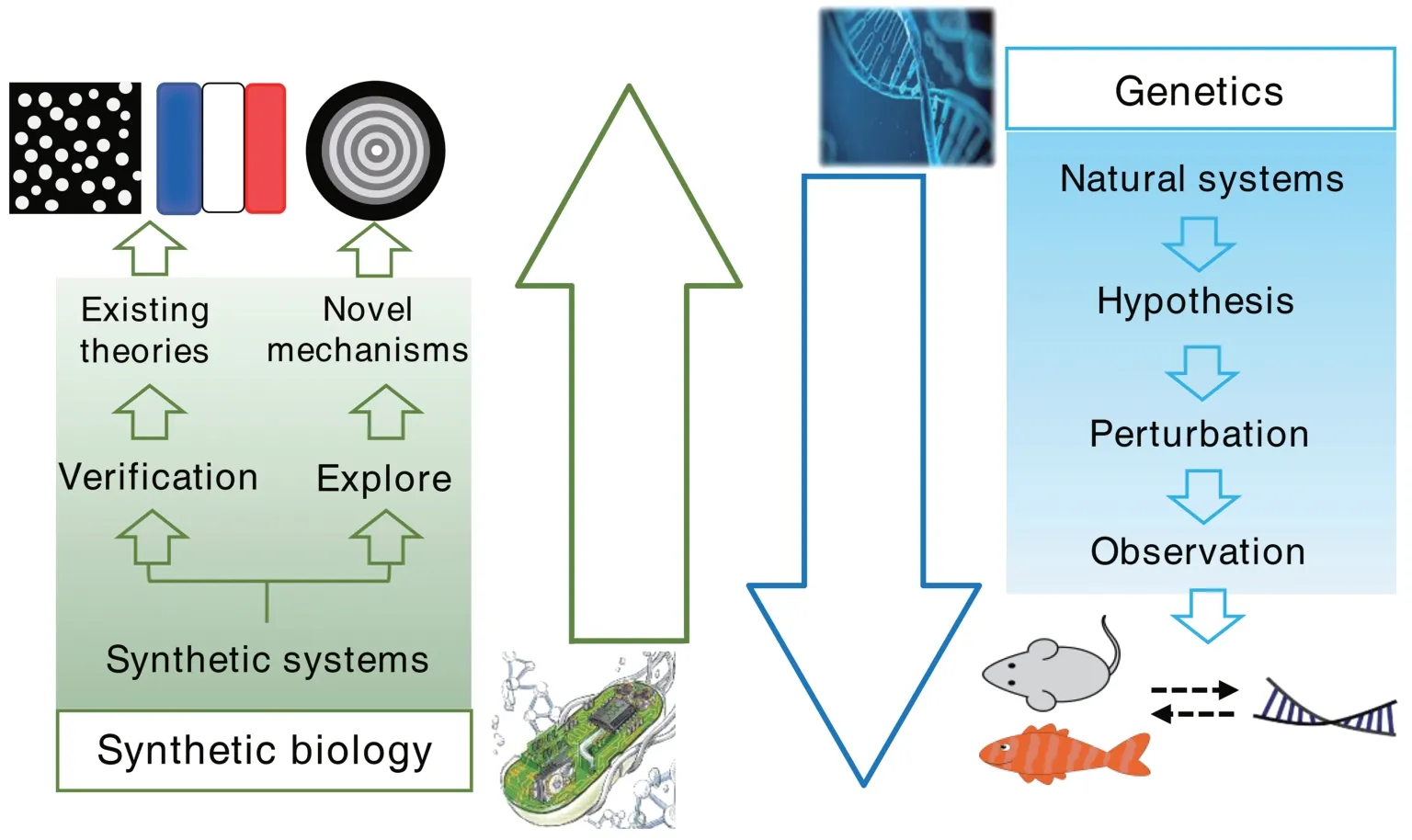
合成生物学作为一门重要的前沿交叉科学,旨在以标准化、去耦合和模块化的工程化设计理念构建新型生物系统[1]。近年来,这些系统在医药、能源、环境、农业和材料等领域都展现了潜在的应用价值[2]。此外,合成生物学可以从自然系统中提取关键的生物学元素,进而构建相应的简化体系。根据这一理念,研究者利用基本的转录调控元件或表达调控元件构建了在活细胞中执行数字和逻辑运算的合成基因回路,如扳键式基因开关[3],振荡器[4]和逻辑门[5]等,扩展了人们对生物系统设计与组织的认知。正如通过合成化学,而对非天然化合物的分析,最终帮助阐明了化学键的本质一样[6],通过研究这些明确的合成体系,可以为研究者解析复杂生物学过程背后的基本原理带来新的契机。
自然界中形形色色的生物图案处处可见,而形成这些生物图案的背后是否存在某些普遍规律,长久以来一直是生物学最基本的科学问题之一[7]。在分子和细胞水平,这一问题等同于均一化的细胞群体如何经历分化、生长和运动等过程,获得精确的时空分布,形成有规律的生物结构。在果蝇[8]、斑马鱼[9-11]、啮齿动物[12]等不同物种中,发育生物学家利用正向遗传学和反向遗传学的方法,揭示了大量影响生物图案形成的基因调控通路。然而,自然调控网络的错综复杂让进一步梳理和归纳这些实验结果变得十分困难。此外,部分研究者对问题进行了抽象分析,提出了不局限于个例的理论模型[7],可是在真实的生物系统中证实这些概念化模型往往缺乏有效的手段。
合成生物学的兴起则为解决上述困境提供了新的方法:①根据理论模型构建和研究简化、可控和定量的合成生物系统,可以验证已有的生物图案形成理论;②合成生物学家在自由探索过程中构建与研究新型的合成系统,可以揭示自然界中未知的潜在生物图案形成原理。
1 生物图案形成的理论模型
1.1 成形素(morphogen)浓度梯度模型
成形素浓度梯度模型,又被称为法国国旗模型(French flag model),描述了成形素浓度梯度介导的生物图案形成过程,最早于1969年由英国发育生物学家Wolpert 提出[13]。在该模型中,成形素通常被认为是一类长距离信号分子,连续分布的成形素浓度梯度将形成不同的浓度阈值,将组织划分为多个区域,不同区域内成形素的局部浓度进而决定了细胞的状态[图1(a)]。直到20世纪后期,成形素仍只是一个抽象的概念。分子生物学的发展使得一些体内的成形素得以被鉴定,例如控制果蝇胚胎前端结构生成的转录因子Bicoid[14-15],以及一些胞外配体,如TGF-β[16]、Hedgehog[17]和Wingless[18]等。
如何建立成形素浓度梯度以及建立的浓度梯度如何转化为对细胞状态的差异调控是研究该理论的焦点。实验观察表明“合成-扩散-清除”是成形素浓度梯度建立的主要模式[19]。成形素首先在局部产生,随后通过扩散到达远端区域。体内降解和细胞内吞作用进一步加速了浓度梯度的衰减。一般而言,成形素浓度梯度并不与细胞状态存在简单的线性对应关系。成形素浓度梯度的建立,将会启动级联的细胞间信号传导,进而产生多个非线性下游信号梯度。这通常通过成形素浓度梯度的动态改变[20]、成形素与组织细胞间的反馈调节[21]以及下游转录网络的相互作用来实现[22][图1(a)]。这些过程是如何通过精确协调来控制生物图案的形成仍是研究的难点[23]。
1.2 反应-扩散模型
生物图案形成的一个关键特征是其自组织性(self-organization),即生物系统通常不需要任何预先存在的位置信息指引,可以自发形成图案[24-25]。由于成形素浓度梯度模型需要预先设立成形素空间分布,因此不能很好地解释生物图案的自组织演化过程。
1952年,计算机科学之父Turing创造性地提出了反应-扩散模型用来解释自然界中自发产生的生物图案[26]。该模型引入了两种成形素,分别称之为激活剂(activator)和抑制剂(inhibitor),并彼此间发生相互作用:激活剂可以激活自身和抑制剂的合成,而抑制剂反过来抑制激活剂的合成。当这两种成形素在空间中以不同速率自由扩散时,会引起扩散诱导的不稳定性,放大均匀稳定状态下微小的扰动。对反应-扩散模型进行数值模拟,结果显示这样的反应体系可以自发产生类似于自然界中的斑点、条纹等图案,这类图案被后人称为图灵斑图[图1(b)]。
反应-扩散模型的提出为生物图案形成带来了一些重要的启示。首先,扩散通常被认为是稳定系统的因素,实际上可能会引起系统局部的不稳定。其次,通过引入成形素的相互作用,可以使成形素浓度在空间中产生具有特定波长的震荡,从而为自然界中周期性生物图案的产生提供了一种可能的机制。
尽管能够模拟自然界中各种生物图案,但反应-扩散模型并未应用于任何真正的生物学问题上。后续的研究扩展了理论模型的适用范围,例如,Meinhardt和Gierer提出短程的正反馈结合长程的负反馈亦符合图灵斑图产生的条件[27-28]。同时,研究者也进一步拓宽了模型中参数的定义范围,例如,相互作用的成形素可以是细胞或个体生物等离散的实体,而不局限于分子。因此,有研究指出趋化细胞迁移[29]、神经元的相互作用[30]、斑马鱼条纹[31]以及小鼠胚胎口腔上腭脊纹[32]等系统也符合反应-扩散模型。
2 利用合成生物学验证已有的生物图案形成理论
2.1 成形素浓度梯度模型的合成生物学论证
为了验证成形素浓度梯度模型,合成生物学家已经设计了多种合成系统以展示如何通过基因回路将信号分子浓度梯度转化为差异基因表达及生物图案的形成。Basu 等[33]设计了一个基于大肠杆菌的信号“发送-接收”合成系统,在该系统中,充当信号“发送者”的细菌可以表达群体感应催化酶LuxI,催化小分子N-酰基高丝氨酸内酯(N-acyl-homoserine lactones, AHL)的合成。AHL 可以在培养基中自由扩散,围绕“发送者”菌落建立信号浓度梯度。而在信号“接收者”中,同时存在两条响应AHL 的基因线路调控荧光报告基因GFP 的表达。一方面,AHL 可以与受体蛋白LuxR 结合,激活CI 的表达,而CI蛋白可以阻遏下游LacI 的表达,进而解除LacI 对GFP 表达的抑制;另一方面,AHL-LuxR 复合体还可以激活具有较低阻遏效率的LacI 变体,即LacIM 的表达,反过来抑制报告基因。这两条基因线路构成了不一致前馈回路(incoherent feedforward loop),使得“接收者”细菌仅在一定的AHL 浓度区间内表达GFP:当“接收者”处在AHL 浓度较高的区域时,LacIM 高表达,阻遏GFP 的转录;当“接收者”处于AHL 浓度较低的区域,LuxR 无法启动CI 的表达,因而LacI表达不受抑制,亦会阻遏GFP 转录;只有在一定的AHL 浓度范围内,具有一定活性的LuxR 激活CI 表达,抑制LacI 的产生,同 时产生的弱阻遏子LacIM 不足以抑制GFP 的转录,最终导致GFP的表达。研究者进一步利用不同的LuxR 突变蛋白,构建了几种响应不同AHL 浓度区间的“接收者”,将“发送者”细菌点种于含有表达不同荧光报告基因的多种“接收者”的琼脂平板时,在“发送者”菌落周围继而有序形成了多荧光的靶心图案[图2(a)][33]。
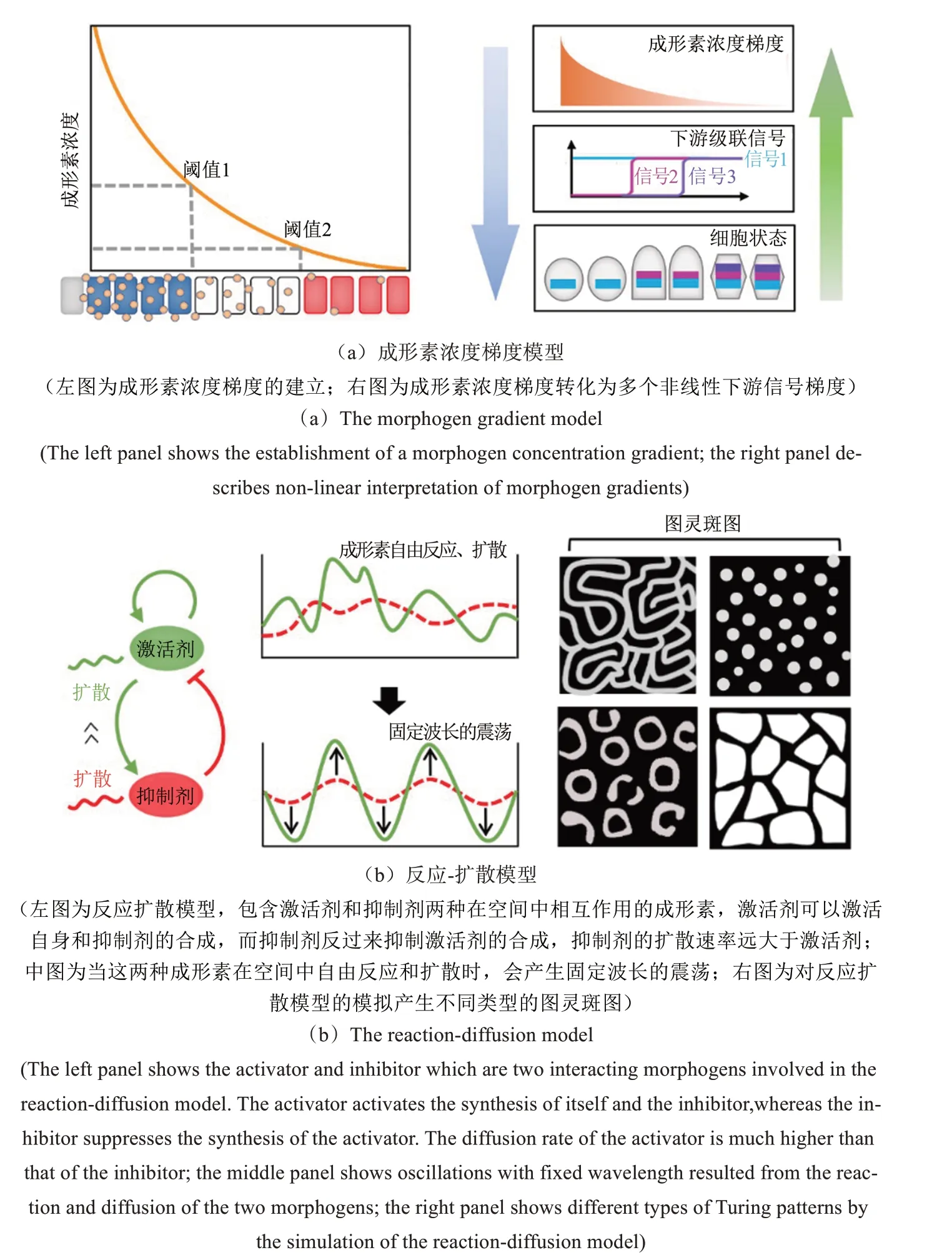
图1 生物图案形成的理论模型[23]Fig.1 Theoretical models for biological pattern formation[23]
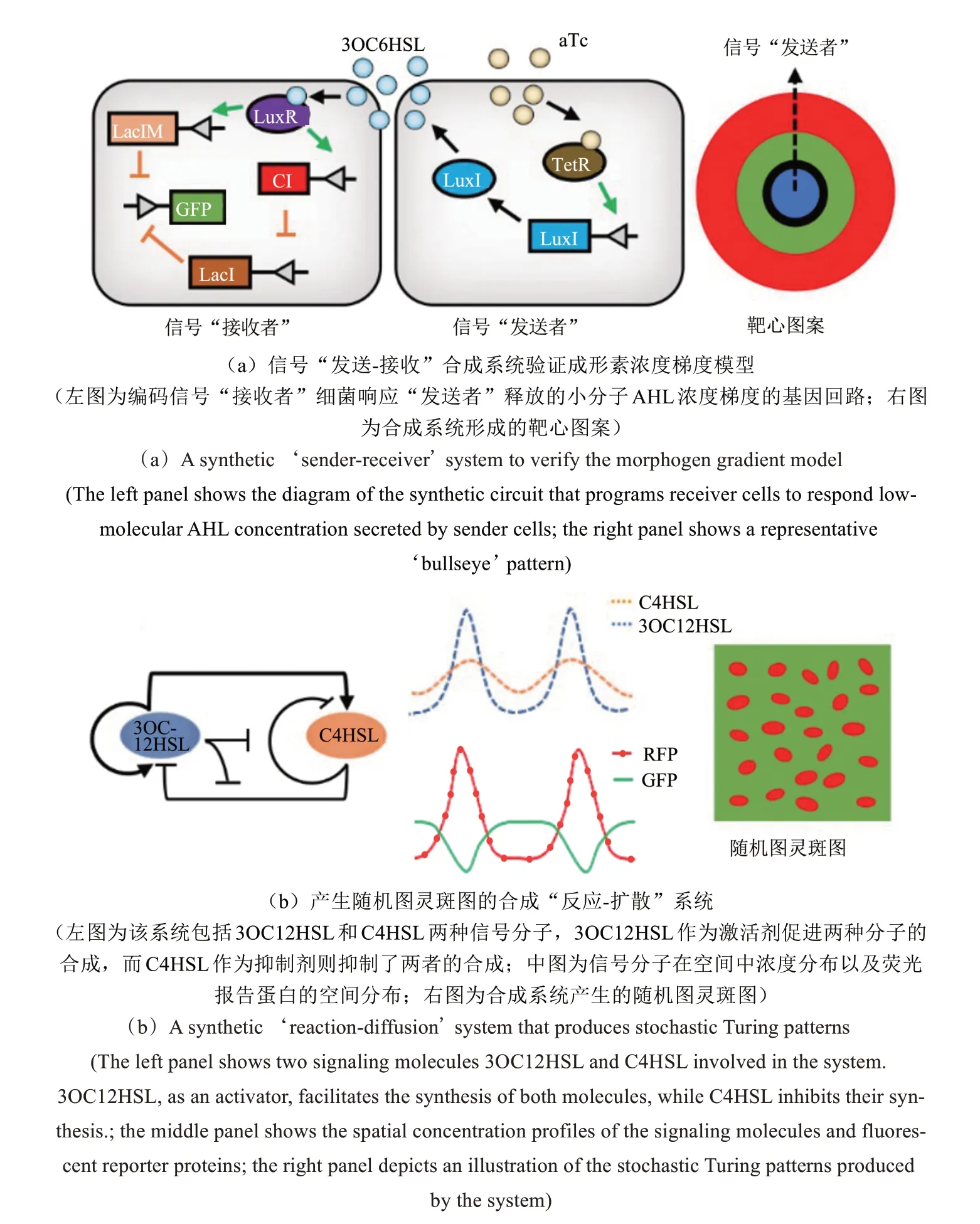
图2 利用合成生物学验证现有生物图案形成理论的经典案例[33,39]Fig.2 Representative studies in the application of synthetic biology to verify existing theories for pattern formation[33,39]
除了上述响应AHL 浓度梯度的系统外,研究者们还相继构建了响应其他物质浓度梯度的合成体系。Sohka 等[34]编码了一株响应氨苄浓度梯度的大肠杆菌,其只能在一定的氨苄浓度范围内生长。通过额外引入IPTG 诱导产生降解氨苄的β-内酰胺酶,可以调控氨苄的浓度梯度,产生不同的细菌生长图案。乳酸链球菌素(Nisin)是一种天然生物活性抗菌肽。Nisin 在高浓度下具有抗菌活性,同时能作为信号分子激活基因表达。基于Nisin 的双重功能,Kong 等[35]在乳酸乳球菌中设计了一种简单、可控和鲁棒的基因线路,用于响应Nisin浓度梯度表达荧光报告基因,制造了环状、条纹和点状等不同的基因表达图案。
为了进一步探索成形素浓度梯度模型中基因调控网络的一般规律,而不局限于构建能够响应某类分子梯度浓度而产生条纹的特定基因回路,Schaerli等[36]利用计算机模拟穷举了所有可能在成形素浓度梯度下产生条纹的3节点基因网络。大规模筛选获得了4类不同的调控网络,且这些网络均符合不一致前馈回路的拓扑结构。随后他们利用模块化的基因元件构建了相应的基因回路,验证了理论预测的结果。从理论和实验出发,研究者进一步推测并验证了同时包含对条纹生成基因(研究中为GFP 基因)激活和抑制调控通路的2 节点基因线路亦可以产生条纹图案。
2.2 反应-扩散模型的合成生物学论证
尽管对反应-扩散模型的研究拓展了该理论模型可能适用的生物系统,但是从发现一些可能遵循图灵机制的系统行为,到鉴定起激活和抑制作用的特定分子、分子间的相互作用及其涉及的生物学过程并非易事。直到近两年,合成生物学家从自然发育过程中获得灵感,设计了符合反应-扩散模型的合成系统。Sekine等[37]利用斑马鱼胚胎发育中两个重要的受体蛋白Nodal和Lefty,构建了首个哺乳动物细胞中的“反应-扩散”基因回路。前期的研究发现Nodal是一个短程的激活剂,而Lefty是一个长距的抑制剂[38],因此Nodal-Lefty 信号通路通常被认为符合图灵斑图产生的条件,但缺乏实验证明。合成生物学重构的Nodal-Lefty基因回路可以让细胞自发产生斑块状荧光素表达的图灵斑图,则为此提供了直接的实验证据。同时,在合成体系中,研究者发现激活剂Nodal的短程分布依赖于蛋白的finger 1结构域。将该结构域与Lefty 融合表达会缩小其空间分布,并破坏图灵斑图的产生。
反应-扩散模型及其衍生形式都对模型参数有严苛的定义,例如在空间中抑制剂的扩散速率需要远远大于激活剂。这为寻找更多合适的基因元件,进而构建理想的合成系统对模型进行验证带来了极大的挑战。然而,Karig等[39]的近期研究表明,当理论模型将基因表达噪声等生物系统的随机性考虑进去后,在一个较为宽松的参数条件下亦可产生图灵斑图。这项研究利用两种可扩散的AHL 小分子3OC12HSL 和C4HSL 构建了符合“经典”反应-扩散模型的基因回路,其中3OC12HSL作为扩散速率较慢的激活剂可以激活自身以及抑制剂C4HSL 的产生,而C4HSL 则抑制了自身和3OC12HSL 的产生。当利用dsRed荧光基因报告激活剂表达时,携带上述基因回路的细菌菌苔呈现出不规则的点状荧光图灵斑图[图2(b)][39]。研究者分别建立了确定性模型和随机性模型对实验进行模拟,发现只有引入系统随机性的理论模型才能准确预测实验结果。考虑到生物过程通常具有内在的随机性,上述研究为拓展反应-扩散模型用于解释自然界中更多的生物图案提供了新的思路。
3 利用合成生物学探索新的生物图案形成机制
3.1 成形素作为时间信号调控生物图案形成
尽管现有的理论和实验研究提出了不同的生物图案形成机制,但这些机制都存在一个共同点,即需要在空间中建立成形素浓度的差异作为生物图案形成的位置信号。Payne等[40]通过新型基因回路的构建和研究,却揭示了一种截然不同的时间机制,可以让细菌群落自发产生“芯-环”状的基因表达图案。该基因回路采用了类似反应-扩散模型的结构设计,其中作为激活剂的T7 RNA聚合酶可以激活自身表达以及小分子AHL的产生,而AHL作为抑制剂,通过群体感应机制诱导T7溶菌酶表达,T7溶菌酶能够抑制T7 RNA聚合酶的活性。当利用mCherry荧光蛋白报告T7溶菌酶表达的动态变化时,携带基因回路的细菌微菌落在菌落扩张过程中(约35 h)可以稳定产生尺度约为500 μm的“芯-环”荧光图案[图3(a)][40]。有趣的是,该图形尺寸远远小于成形素AHL的扩散尺度,因此图案空间范围内AHL浓度几乎一致,表明这种生物图案的形成不依赖于AHL浓度梯度的建立。数学模型分析表明,在该系统中成形素AHL实际充当了一种时间信号而非位置信号,AHL在小范围内的浓度积累速率与微菌落大小成反比,因此AHL浓度随时间的动态变化与菌落尺寸关联,提示菌落扩张到特定时刻启动环形图案的形成。
利用相同的基因回路,研究者还进一步对生物图案的尺寸调控进行了研究,发现了一种可以解释发育过程中尺度恒定现象(scale invariance)的潜在新机制[41]。在发育生物学中,尺度恒定通常表现为器官大小与身体大小维持恒定的比例。通过对不同大小微菌落中“芯-环”图案的分析,他们发现在一定的菌落大小范围内,环的宽度始终与菌落半径保持恒定的比例[图3(a)][41]。结合理论与实验分析,研究者提出了一种“联合的空间感应机制”。与现有解释尺度恒定的理论不同,该机制不依赖于成形素浓度梯度的建立,而需要积分反馈循环和不一致前馈回路的有序调控,这些调控精确设定了环形成的时机、成熟速率和持续时间。“联合的空间感应机制”强调了成形素作为时间信号在生物图案尺寸调控中的作用,为审视自然界中尺度恒定现象带来了全新的视角。
3.2 合成生物学构建周期性生物图案
周期性是生物图案的重要特征之一,周期性生物图案通常由有序间隔的重复单元组成,如孔雀羽毛和斑马条纹等。目前,科学家们已经提出了多种理论用于解释周期性生物图案的形成[42]。Liu等[43]通过基因回路的构建,将细菌密度与运动联系起来,使大肠杆菌菌落能够自发产生周期性的密度条纹图案,并揭示了受密度制约的细胞运动是此类图案形成的一种潜在机制。
研究中关联细菌密度和运动的基因回路主要由密度感应和运动控制两个模块组成。密度感应模块可以组成型表达群体感应元件LuxR和LuxI,LuxI催化产生小分子AHL,AHL的局部浓度与细菌密度正相关。在运动控制模块中,Pλ(R-O12)启动子外源驱动大肠杆菌运动基因cheZ的表达,以维持cheZ敲除宿主菌株的运动能力,而Pλ(R-O12)阻遏蛋白CI的表达受到群体感应启动子PluxI的控制。在细菌处于低密度时,少量产生的AHL不足以结合LuxR以激活CI的表达,因此未受阻遏的Pλ(R-O12)可以表达CheZ,促进细菌运动。而当细菌处于高密度时,高浓度AHL激活LuxR,进而驱动阻遏物CI的表达,阻遏cheZ转录,从而抑制细菌的运动。将引入了基因回路的大肠杆菌点种于半固体琼脂平板培养后,细菌可以循序地产生细胞高低密度相间的条纹图案[图3(b)][43]。理论建模显示受密度制约的细胞运动使得细菌在菌落扩张的边缘反复聚集,而低密度区域的细菌不断进入该区域进一步放大了细胞密度的空间差异,最终导致周期性密度条纹的产生。此外,研究者通过改变cheZ的基础表达水平以改变细菌的最大运动速率,可以控制条纹图案的数量。因此,上述研究对于解释自然界中周期性生物图案或结构的形成具有一定的借鉴意义。
3.3 多细胞结构的产生
生物在生长发育过程中会自发形成对正常功能必不可少的多细胞结构,例如早期胚胎和细菌的生物膜等。这些结构并非通过已经存在的组织拼接而成,而通常由一系列有序的细胞分化和不同类型细胞的空间再组织决定。
3.3.1 合成Notch 信号通路介导的细胞分化和差异性黏附
多细胞结构的形成涉及大量控制细胞间信号传导的基因[13,44],同时有证据显示细胞间接触介导的细胞迁移抑制[45]、细胞间排斥[46]和细胞差异性黏附[47]也有助于不同细胞类型在空间中的分离和聚集。Cachat 等[48]发现两种表达不同钙黏蛋白(Cadherin)的哺乳动物细胞混合时,表达相同钙黏蛋白的细胞间更强的亲和力会导致两类细胞的分离。Toda等[49]进一步利用合成Notch信号通路在哺乳细胞内构建了一系列通过细胞间接触控制细胞分化(表达不同的荧光报告基因)和差异性黏附的基因回路。这些基因回路首先通过细胞间接触诱导的细胞黏附产生分层结构,细胞黏附则进一步在接触区域传递信号产生新的结构层次,而具有高亲和力的同型钙黏蛋白表达会导致多细胞结构对称性的破坏。最终,该合成体系可以编码细胞产生多种从简单到复杂、从对称到不对称的多层次球状结构[图3(c)][49]。这项经典合成生物学工作能够帮助人们理解自然界中多细胞结构的形成原理。
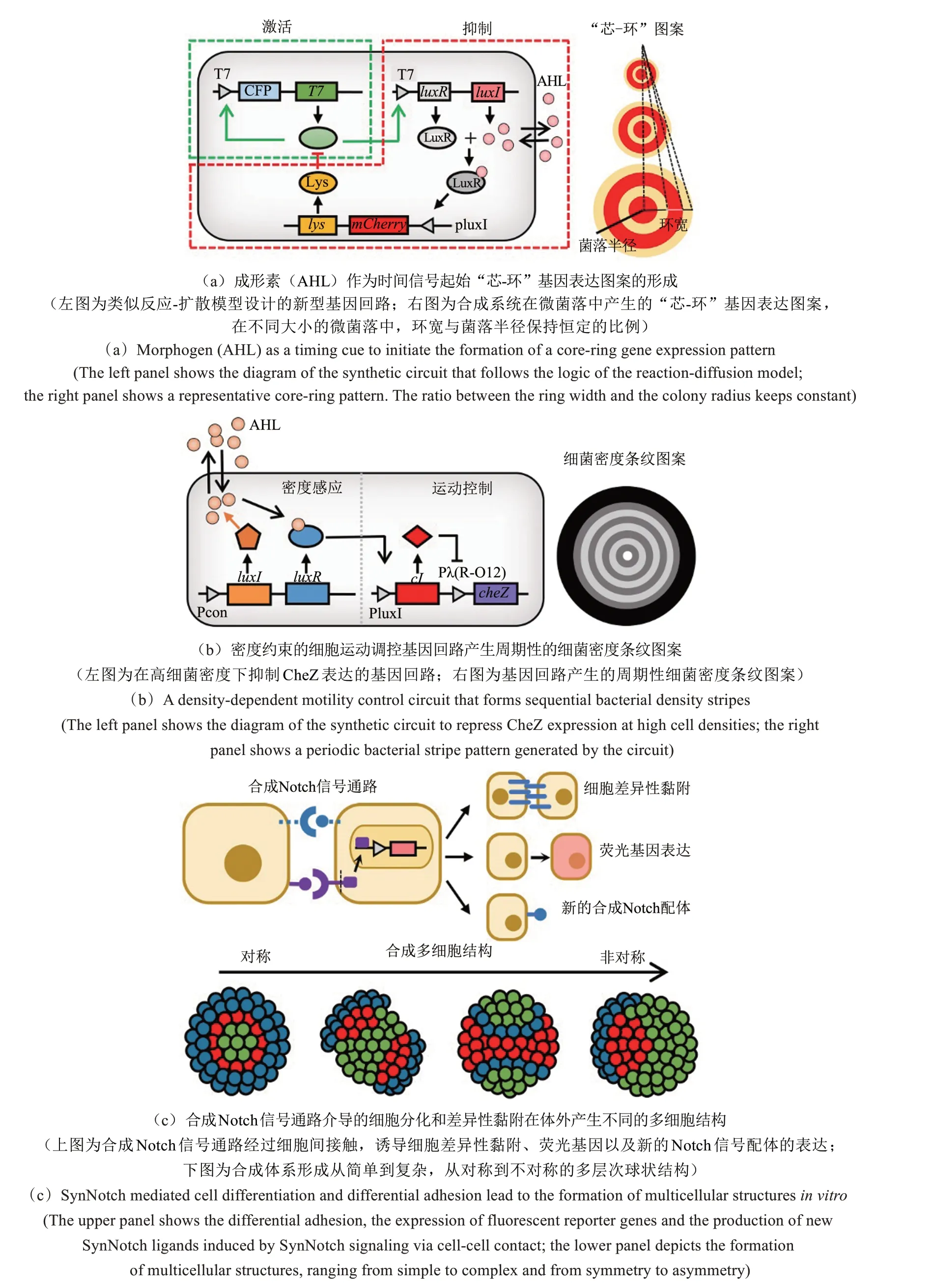
图3 利用合成生物学探索生物图案形成新机制的经典案例[40-41,43,49]Fig.3 Representative studies in the application of synthetic biology to explore novel mechanisms for biological pattern formation[40-41,43,49]
3.3.2 不同类型细胞间对细胞运动的双向调控协同产生多细胞生物图案
不同类型细胞间的协同行为对多细胞系统自发形成复杂的生物结构具有重要意义[50-52]。作者团队近期报道了一种不同类型细胞可自发分离或共定位(co-localized),并产生不同条纹图案的新机制[53]。此机制依赖于不同细胞群体间对细胞运动的双向调控。首先通过合成生物学方法构建了包含两种大肠杆菌菌株的合成多细胞体系,在这一体系中一种大肠杆菌的运动状态通过群体感应受到另一种大肠杆菌局部细菌密度的调控。当两株菌的运动能力均受到对方的促进时,在半固体琼脂平板上点种的合成体系可以形成周期性的细菌条纹,且两种菌在条纹上的生长呈现反相(out of phase)的震荡。而当两株菌的运动能力均受到对方的抑制时,合成体系亦可形成周期性细菌条纹,然而此时两种菌在条纹上的生长呈现同相(in phase)的震荡。因此,通过简单改变两种细胞群体间的相互作用方式即可实现多细胞体系空间再组织行为的转换。随后结合理论模型证实了对细胞运动的双向调控是一种鲁棒的多细胞体系自组织机制,并验证了符合机制的三细胞类型合成体系可以产生与理论预测一致的预图案(pre-patterns),证明这种机制应用于多细胞体系的普遍性。
4 展 望
建物致知、建物致用,是合成生物学研究的两大愿景,体现了合成生物学的科学和工程内涵[54-55]。建物致知,是在人工设计的指导下创造人造生命体系,提升对生命本质的认识。在合成生物学研究生物图案形成这一崭新的领域,研究者们已经可以从现有的理论出发,构建定量可控的合成体系,真正地在生物体系中验证这些重要理论的正确性。同时,通过“自下而上”地构建新型合成系统,合成生物学还可以帮助人们探索新的生物图案形成机制。例如,研究人员[42,56]巧妙地将细胞密度与细胞运动状态关联起来,并证实了受密度约束的细胞运动是周期性条纹图案形成的潜在机理,这一机制区别于现有的多种时钟模型,可以启发发育生物学家重新审视生长、运动等最基本的细胞行为在生物图案形成过程中扮演的角色。除了为基础研究提供新手段和思路,合成生物学也力求通过建物致用,实现人工合成体系在产业中的转化和应用。这一理念已经在医药、能源等领域取得了丰硕的成果,而近期也开始出现关于合成生物图案用于生物材料制造如压力感应生物装置的报道[57]。相信在不久的未来,合成生物学创造的人工生物图案或结构将在再生医学、组织工程等更多领域得到应用。

