动态调控策略在代谢工程中的应用研究进展
于政,申晓林,孙新晓,王佳,袁其朋
(北京化工大学化工资源有效利用国家重点实验室,北京100029)

代谢工程是通过定向修改或重构细胞代谢途径,赋予细胞新的特性和生产能力,从而生产特定化合物的学科,作为一种新兴技术常被用于生产能源、化学品、药物和天然产物,如异丁醇、焦性没食子酸、青蒿酸和熊果苷等[1-4]。代谢工程的目的是使细胞工厂利用最少量的碳源和能量,最大化地生产目标产物[5]。因此,为了使细胞工厂的产量、产率和生产能力达到最大,需要对底盘细胞进行大规模改造。目前常用的改造手段包括敲除副产物或敲除竞争途径及过表达目标途径相关基因,和以试错为主的模块优化等[6-8]。尽管这些方法有效提高了目标产物的产量,但是带来了细胞生长阻滞、细胞氧化还原失衡、中间代谢物积累和碳源浪费等问题[6]。在自然界中,微生物通过监测外界环境信号的变化,对自身基因表达进行精密调控,从而完成从迟缓期到衰亡期的完整生命活动。受这种天然动态调控机制的启发,早在2000年,Farmer和Liao[9]利用乙酰磷酸响应的转录因子及其结合的启动子(转录因子-启动子)构建了感知细胞代谢状态并调节番茄红素通路表达的动态控制器,成功将番茄红素的产率提高了50%。该研究证实了利用代谢物传感器对代谢流进行动态控制可以提高异源途径的产量和生产能力。近年来,随着动态调控机制研究的深入以及核糖开关、生物传感器和蛋白降解标签等一系列调控元件的出现,对细胞生长和产品合成代谢流进行精确分配的代谢物响应、群体感应响应、环境响应和蛋白水平调控的动态调控策略已经成功应用于生物合成途径的优化。动态调控策略缓解了静态调控所造成的生长阻滞和代谢流失衡,为提高目标产品产量提供了一种新的有效手段[7,10-11]。基于此,本文作者将总结近年来动态调控在代谢工程领域的发展及应用情况,讨论动态调控的优点及存在的问题,展望该技术面临的挑战和未来的发展方向。
1 依赖于特定中间代谢物或产物的动态调控
以途径中间代谢物、副产物或产物浓度变化作为输入信号而设计的调控系统常用于调节特定代谢通路的基因表达。这类调控系统通过感应模块接收输入信号并传递至调控模块,随后调控模块动态控制基因表达水平,实现代谢流的动态分配。当前,响应特定中间代谢物和产物的动态调控元件和线路的构建主要依赖于两种方式:一种是利用代谢物响应的转录因子-启动子作为响应元件;另一种是利用代谢物响应的核糖开关作为响应元件。
1.1 代谢物响应转录因子-启动子在动态调控中的应用
目前研究最多的是利用自然界中已发现的代谢物响应转录因子-启动子来构建调控系统。转录因子具有与启动子DNA 序列结合及与胞内特定代谢物结合的两个结合区域。转录因子通过与启动子区域特定的DNA 序列结合,来激活或抑制下游基因的表达,而胞内代谢物与转录因子的结合会影响其与启动子DNA 结合的活性,从而影响对下游基因的表达调控[12-13]。利用天然存在的转录因子构建的调控系统对代谢物具有较高的特异性,通过中间代谢物或目标产品与转录因子结合后的别构调节,在转录水平上实现基因表达的动态调控,进而引发有利于目标化合物合成的代谢流分配,但调控发生到信号输出的变化需要经历较长的时间且引入外源转录因子会增加细胞的代谢负担[14]。
丙二酰辅酶A 是细胞生长中脂肪酸合成的重要前体,同时是生产3-羟基丙酸、4-羟基香豆素和柚皮素等多种化合物的前体物质[15-17],因此常被用作信号分子调控细胞生长和产物生产。例如,Xu 等[18]利用丙二酰辅酶A 响应的转录因子-启动子构建了一个双向动态调控系统来提高脂肪酸产量。在这一调控系统中,低浓度丙二酰辅酶A 可激活乙酰辅酶A 羧化酶的表达同时降低脂肪酸合成酶的活性,在加强丙二酰辅酶A生产的同时降低了丙二酰辅酶A 的消耗,由此实现了丙二酰辅酶A 在生长和生产中的平衡调控。与没有调控的菌株相比,该策略成功使脂肪酸的产量提高了2.1 倍。类似地,Liu 等[19]设计了一个基于丙二酰辅酶A 的负反馈调控系统。当丙二酰辅酶A 积累时,转录因子FapR 与启动子PFR1的结合被抑制,因此激活启动子PFR1控制的基因lacI表达,大量表达的LacI 蛋白抑制了启动子T7,从而抑制该启动子开启表达乙酰辅酶A 羧化酶;相反,当丙二酰辅酶A 浓度下降时,则会激活乙酰辅酶A 羧化酶表达系统来适当补充丙二酰辅酶A。通过这种调控机制,该系统可以根据细胞自身需求调节丙二酰辅酶A 的合成,减少细胞能量浪费、平衡其碳流量分配,最终使脂肪酸产量提高了34%。此外,以产物作为调控因子也可有效提高细胞工厂的产量和产率,还可以耦合信号输出系统构建高通量筛选平台,Hanko 等[20]利用产物衣康酸敏感的ItcR/PccI对顺乌头酸脱羧酶的表达进行微调并构建了产物的高通量筛选平台,优化了大肠杆菌中衣康酸的合成并筛选得到了衣康酸高产工程菌,衣康酸最高产量达到0.78 mmol/L。
由于天然转录因子-启动子的调控阈值和响应底物谱有限,需要对转录因子、RBS 和结合位点进行修饰来提高调控系统的选择性、表达强度和响应范围,以满足实际应用的需求[21]。例如,Liang 等[22]通过定点饱和突变对天然尿酸响应蛋白HucR 进行改造,得到一个低响应底物阿魏酸同时高响应产物香草醛的HucR 突变体,并将其用于调控阿魏酸合成香草醛途径中关键基因的表达。在发酵初期,HucR 突变体与高浓度的阿魏酸结合,合成途径处于低水平表达,减小了抗菌化合物香草醛对生物量积累的影响;随着底物的消耗和产物的合成,HucR 突变体主要与香草醛结合,激活合成途径的高效快速表达,从而实现足够生物量积累之后的香草醛高效合成。该研究还通过改造启动子-10 区,调整了启动子的启动强度,进一步提高了香草醛的产量,在提供13.3 mmol/L 阿魏酸的条件下,产生了11 mmol/L 的香草醛。Dabirian等[23]以fapO/FapR 系统为例,证明了改变转录因子结合位点在启动子核心区域中的插入位置,可以提高动态调控范围但同时伴随着启动子基础表达水平的损失。为了在不影响启动子基础表达水平的条件下进行调控,该课题组将转录因子结合位点定位到上游启动子区域并将酵母天然阻遏蛋白与转录因子FapR 偶联,在启动子基础表达水平几乎不变的条件下使得抑制强度提高了5 倍。此外,以不同启动子序列的结合能为基础建立的热力学模型[24],以转录因子产生率、结合亲和力等参数为基础建立的现象学理论[25]也被用于调节代谢物传感器动态范围的研究中。
为进一步扩大已有代谢物响应元件的应用范围、改善其调控效果,将天然转录因子-启动子与其他调控元件偶联也受到了广泛关注,这些偶联有效地实现了合成途径以及竞争途径的动态调控。例如,以葡萄糖为底物合成关节炎治疗药物N-乙酰葡糖胺的过程会与糖酵解途径(EMP)、戊糖磷酸途径(HMP)和肽聚糖合成途径(PSP)等细胞生长必需途径竞争代谢流[图1(a)]。为了解决敲除竞争途径对细胞生长的影响,提高N-乙酰葡糖胺的产量,研究人员将葡糖胺-6-磷酸响应的GamR/PgamA与CRISPRi调控系统[26-27]偶联,用于N-乙酰葡糖胺合成的动态调控[图1(b)]。当胞内葡糖胺-6-磷酸处于低浓度状态时,GamR会与DNA结合覆盖RNA聚合酶结合位点,从而抑制编码葡糖胺-6-磷酸乙酰基转移酶的GNA1基因和dCas9基因的转录,使代谢流进入HMP、EMP和PSP途径用于积累生物量。当胞内葡糖胺-6-磷酸处于高浓度状态时,GamR的DNA 结合活性被葡糖胺-6-磷酸的变构调节作用消除,使RNA聚合酶与启动子结合从而激活GNA1和dCas9的转录,随后表达产生的葡糖胺-6-磷酸乙酰基转移酶催化N-乙酰葡糖胺合成,而dCas9与组成性表达产生的sgRNAs 结合后下调了竞争途径的表达水平。通过该基因线路对N-乙酰葡糖胺合成途径和竞争途径的动态调控,最终N-乙酰葡糖胺在15L发酵反应器中的产量达到131.6 g/L[28]。另外,Yang等设计了黏糠酸传感器与反义RNA耦合的双功能动态调控元件,以黏糠酸为信号,可在增强下游黏糠酸生产途径表达的同时开启抑制EMP 途径的反义RNA系统,从而降低细胞生长的碳源消耗,将碳流引入生产途径。与静态诱导相比,双功能动态调控元件的应用使黏糠酸产量增加了16.3倍[29]。

图1 枯草芽孢杆菌中N-乙酰葡糖胺的合成调控Fig.1 Regulation of N-acetylglucosamine synthesis in Bacillus subtilis
1.2 代谢物响应核糖开关在动态调控中的应用
代谢物响应的核糖开关因其反应时间快、对细胞造成负担小及可以灵活地与下游基因组合等特点逐渐成为另一种有发展潜力的特定代谢途径调控方法[30],同样不可忽视的是有限的化学多样性限制了其感知代谢物的能力以及存在延迟输出的问题[31]。核糖开关是一种主要存在于细菌信使RNA 5'端非翻译区的顺式作用元件,由适配体与表达结构域组成[32]。适配体与代谢物配体结合,引起表达结构域构象改变,进而通过转录终止、翻译起始和内含子剪接等机制对基因表达水平进行调控[33-34]。
目前,核糖开关已经成功应用于动态调控与细胞生长相关的竞争途径,使细胞在满足生长的条件下增加产品合成所需的代谢通量。通过终止子结构和抗终止结构的形成,核糖开关以控制转录起始的方式调控基因表达。例如,Wachsmuth等[35]设计了一个茶碱响应的核糖开关,在茶碱存在的条件下抑制终止子结构的形成,使基因表达水平提高了3倍。通过调控内含子正常和错误剪接,核糖开关以控制mRNA加工的方式调控基因表达。例如,研究人员研究了通过错误剪接内含子来下调基因表达水平的硫胺素焦磷酸响应核糖开关,并将其改造成与硫胺素焦磷酸结合后可以正常剪接的激活型核糖开关,使得配体结合后的基因表达水平提高了4.7 倍[36]。通过RBS序列的暴露和掩盖,核糖开关以控制翻译起始的方式调控基因表达。例如,研究人员利用来自大肠杆菌的天然赖氨酸核糖开关在谷氨酸棒状杆菌中构建了赖氨酸合成途径的调控系统,通过赖氨酸响应的方式调控竞争途径TCA循环中柠檬酸合成酶的表达水平,使赖氨酸产量提高了63%[37]。通过改造巴氏梭菌中的甘氨酸激活核糖开关,Zhou等开发了一种甘氨酸抑制核糖开关,并将其应用于5-氨基酮戊酸合成途径的动态调控。5-氨基酮戊酸不仅是目标产物,也是细胞生长相关的血红素合成途径的前体,因此对血红素合成途径表达水平进行调控可有效提高5-氨基酮戊酸产量[图2(a)]。不同于敲除5-氨基酮戊酸脱氢酶基因(hemB)的静态调控策略,研究人员利用甘氨酸响应的抑制性核糖开关对hemB表达进行了动态调控。当甘氨酸积累到一定浓度时,抑制性核糖开关通过适配体与甘氨酸结合,引发表达结构域的构象改变,阻止核糖体与mRNA结合,从而抑制hemB的翻译起始,实现了5-氨基酮戊酸合成的动态调控[图2(b)]。在摇瓶发酵中,甘氨酸抑制核糖开关的应用使大肠杆菌中5-氨基酮戊酸的产量达到242 mg/L,相较于对照组提高了11%[38]。为了进一步提高核糖开关的阈值或扩大其调控范围,Pang 等[39]对唾液酸核糖开关的结合环进行碱基突变,并以一种生长偶联的双向筛选方法进行筛选,得到了具有高阈值、更广调控范围的核糖开关,将唾液酸产量提高了42%。同时,利用SELEX与高通量筛选相结合进行人工构建核糖开关也获得了广泛的关注[31]。
综上所述,现有的代谢物响应调控元件已经成功应用于提高微生物细胞工厂的产量、产率和生产能力。为了进一步提高对调控元件的调控效果,一方面诱变和计算机辅助蛋白质设计等方法被用于改造现有元件,提高响应开关的特异性、拓宽其响应底物谱、扩大其调控范围;另一方面转录微阵列、高通量筛选代谢物响应启动子[40-41]等方向的研究也有助于更多调控元件的发现和应用。

图2 大肠杆菌中5-氨基酮戊酸的合成调控Fig.2 Regulation of 5-aminoketovaleric acid synthesis in Escherichia coli
2 依赖于群体感应系统的动态调控
以途径中间代谢物或产物作为输入信号实现特定通路动态调控的策略,在一定程度上可以有效提高特定目标化合物的产量。但是代谢通路特异性的特点限制了其在不同代谢途径中的应用。因此,获得一种普遍适用的动态调控工具成为了研究热点。群体感应是一种依赖于细胞密度的天然动态调控体系,细菌可通过信号分子的产生、释放、监测,实现对周围环境的感知,进而根据细胞密度的变化在整个种群范围内同步特定的行为[42-43]。随着对群体感应作用机制的研究深入,这一生物学特性可用于开发一种细胞密度依赖的自诱导动态调控工具,另外不可忽视的是额外信号物质的合成增加了细胞代谢负担。目前研究最多、应用最广的群体感应系统主要是来自于费氏弧菌的luxI/luxR系统和来自于玉米细菌性枯萎病菌中的esaI/esaR系统,这两种系统由于响应机制不同而被用于构建不同的基因线路,调节和分配细胞生长与产物生产之间的碳流及能量流。
2.1 luxI/luxR 群体感应系统在动态调控中的应用
最早发现于费氏弧菌中的luxI/luxR群体感应系统,因其调控机制简单明确而被广泛研究与应用。在luxI/luxR群体感应系统中,信号分子AHLs(Acyl homoserine lactones)合成酶LuxI 由luxI基因编码,合成的AHLs 以自由扩散的方式进入到周围环境中,当信号分子浓度达到阈值之后,AHLs 会进入细胞内与luxR组成性表达产生的转录因子LuxR 结合形成AHLs-LuxR 复合物,该复合物可与转录调控区结合激活下游基因的表达[44],实现基因线路的开启或增强。基于这种群体感应系统,Kim 等[45]设计了一条基因线路来平衡细胞生长与产物生产之间的碳流分配,带有该基因线路的工程菌生产了1.1 g/L 红没药烯,与前人研究相比,产量提高了44%。以此为基础,Bao 等[46]将转录后水平抑制基因表达的负调控元件sRNA(small RNA)与luxI/luxR型群体感应系统偶联,开发了一种高细胞密度时动态抑制目标基因表达的工具(图3)。当AHLs 达到阈值之后,AHLs-LuxR 复合物激活启动子Plux控制的sRNA 和分子伴侣Hfq 的表达,产生的sRNA-Hfq与目标mRNA 结合后可抑制目标基因的翻译,且抑制程度可在6%~76%调节。值得注意的是,在构建该调控系统的过程中,研究人员利用群体感应启动子Plux启动luxI表达,解决了目标基因过早被抑制的问题,同时通过luxI表达的正反馈调控提高了抑制强度,得到了一种可在高细胞密度时动态自主抑制基因表达的工具[46]。虽然luxI/luxR群体感应系统研究广泛且已被成熟应用于构建很多基因调控线路,但是该类系统只能正向响应AHLs 浓度;虽然通过与负调控元件耦合可以对代谢网络进行双向调节,但是会造成基因线路复杂、调控灵敏度降低等问题。因此,具有双向调节功能的esaI/esaR群体感应器成为新的研究热点。

图3 luxI/luxR群体感应系统与sRNA偶联动态调控基因线路Fig.3 luxI/luxR quorum sensing system coupled with sRNA for dynamic regulation of gene circuits
2.2 esaI/esaR 群体感应系统在动态调控中的应用
存在于玉米细菌性枯萎病菌中的esaI/esaR是一种luxI/luxR同源的群体感应系统[47]。与luxI/luxR不同的是,其信号分子受体EsaR 可以产生激活与抑制的双重作用。在低细胞密度时,EsaR 可与启动子PesaR的转录调控区结合来抑制其下游基因表达,也可与启动子PesaS的转录调控区结合来激活其下游基因表达;而在高细胞密度和AHLs 浓度达到阈值之后,AHLs 与转录因子EsaR 作用使其无法再结合到转录调控区,由此启动PesaR下游基因的表达和抑制PesaS下游基因的表达[48]。利用esaI/esaR型群体感应的这一特性,在对4-羟基苯乙酸合成途径中ARO10基因编码的苯丙酮酸脱羧酶及feaB基因编码的苯乙醛脱氢酶改造的基础上,Shen 等[49]引入EsaR/PesaR调控组件来动态调控这两个基因的表达,从而在提高4-羟基苯乙酸产量的同时避免了大规模发酵过程中高成本的诱导剂添加。最终,4-羟基苯乙酸的产量被进一步提高至17.39 g/L,与静态调控的菌株相比提高了46.4%。Gu 等[50]以EsaR/PesaR-C和EsaR/PesaS调控组件为基础,设计了一个可以在高细胞密度条件下同时上调和下调基因表达水平的双向开关。这一双向开关被成功应用于大肠杆菌中聚-β-羟丁酸合成的动态调控(图4)。在大肠杆菌中,聚-β-羟丁酸的合成是以乙酰辅酶A 为前体,而乙酰辅酶A 同时是细胞生长必需的重要中间代谢物,因而造成了细胞生长与产物合成间的冲突。该基因线路通过启动子PesaR-C控制乙酰辅酶A 合成聚-β-羟丁酸的phbCAB基因、以启动子PesaS控制乙酰辅酶A 进入TCA 循环的gltA基因,利用esaI/esaR系统的双向调节功能实现了低细胞密度时乙酰辅酶A 进入TCA 循环、高细胞密度时乙酰辅酶A 进入聚-β-羟丁酸合成途径的动态自主切换,最终生产了6.73 g/L 的聚-β-羟丁酸,产量相较于无双功能开关的对照组提高了6 倍[50]。同样是基于esaI/esaR群体感应系统,Prather 课题组[51]设计了精细调控的基因线路来微调EsaI 的表达水平从而控制1-磷酸果糖激酶和莽草酸激酶的表达,成功实现了中心代谢途径与目标产物合成途径的碳流平衡,该策略的应用显著提高了肌醇、葡萄糖二酸和莽草酸的产量。在此基础上,该课题组通过构建新的分层动态调节元件进一步优化了该调节系统,提高了调节效果。一方面,使用群体感应系统降低糖酵解途径中的基因表达水平;另一方面,结合肌醇敏感的代谢物类型传感器上调葡萄糖二酸的生物合成途径,通过这种“推拉”结合的策略,使葡萄糖二酸的产量提高到2 g/L[52]。Dinh 等[53]设计了另外一种复合调控元件也实现了同时上调和下调基因表达的双向调控,他们将lux型和esa型群体感应器与CRISPRi 结合开发出了一种在细胞生长后期自诱导的双功能动态调控系统,并在水杨酸和柚皮素的生物合成途径中验证了调控效果,与静态菌株相比,水杨酸和柚皮素的产率分别提高了1.8 倍和6 倍。这些研究为我们提供了新的应用方向,不仅可以构建双功能调控元件,还可以将不同类型的动态调控方式组合,构建更有效的基因线路,实现对菌体代谢网络基因表达水平的精确调控。
为了进一步扩大群体感应策略的应用范围,一方面,表征新的天然群体感应系统有利于开发更多的群体感应调控工具;另一方面,通过启动子改造对信号分子产生率及信号分子-转录因子复合物与转录调控区的结合效率进行修饰,可以调节开关切换时间和作用强度[54]。例如,Daer等[55]在大肠杆菌中表征了天然信号分子合成酶库的信号分子产生能力,这为群体感应调控回路的构建提供了更多可选择的元件。通过采用不同强度启动子以及RBS序列来调节AHLs合成率,研究人员得到了可在不同菌体浓度下响应的群体感应调控系统[53]。另外,正交群体感应系统的表征为实现多个基因间互不干扰的调控提供了理论基础。Tekel等[56]通过表征5个不同的转录因子(LuxR,LasR,TraR,BjaR,AubR)对一组AHLs合成酶的反应,筛选出了两组正交且互不干扰的AHLs 合成酶与转录因子组合(BjaI/BjaR+EsaI/TraR和LasI/LasR+EsaI/TraR)。Scott等[57]发现了既没有信号串扰,也没有启动子串扰的Tra和Rpa群体感应系统。这些研究为利用群体感应开发正交的、精确的动态调控工具奠定了理论和应用基础。

图4 esaI/esaR群体感应系统用于聚-β-羟丁酸合成的动态调控Fig.4 esaI/esaR quorum sensing system for dynamic regulation of poly-β-hydroxybutyrate synthesis
3 基于发酵过程条件控制的动态调控策略
虽然对群体感应和代谢物调控系统核心元件的改造可在一定程度内调控元件的响应阈值和响应范围,但是在目前的研究中,这两种动态调控都受到启动子响应阈值和响应物谱的限制。而温度、溶氧、pH、光照、培养基成分等发酵条件作为输入信号,具有可逆性、普适性、振荡性和可控性等优点,还可以通过人工干预进行合理的调节,因此,响应发酵环境信号的动态调控系统可在更广阔的范围内实现基因表达的适时调控。
3.1 温度、溶氧及pH 响应开关在动态调控中的应用
作为发酵过程中的重要影响因素,温度调控具有操作简单、调控均一等优点,在代谢工程中已经取得了广泛的应用。温度敏感型蛋白的发现与改造,为以温度作为输入信号的代谢途径调控提供了基础元件。温度改变可以调节参与基因表达过程的温敏性蛋白与启动子的结合能力,从而实现对代谢过程的动态调控。通过改变温度条件,Harder等[58]将温度敏感的CI857阻遏蛋白用于动态调控大肠杆菌中衣康酸的生物合成。在37 ℃时,CI857不与调控序列结合,此时PR启动的异柠檬酸脱氢酶基因正常表达,代谢流被用于TCA循环实现生物量积累;而在28 ℃时,CI857 与调控序列结合,抑制PR启动的异柠檬酸脱氢酶基因的表达从而抑制TCA 循环,将代谢流引入衣康酸合成途径(图5)。这种以温度作为输入信号的调控系统实现了37 ℃时生物量积累到28 ℃时衣康酸合成的动态切换,与直接敲除竞争途径TCA循环相比,在1 L反应器中将衣康酸产量从32 g/L提高至47 g/L[58]。此外,研究人员利用定向进化改造的温度敏感型蛋白Gal4M9调控酿酒酵母中番茄红素的合成。通过发酵温度切换,引发Gal4M9蛋白介导的基因表达水平改变,实现了细胞生长和番茄红素生产的解耦联。这种调控策略在生长阶段为番茄红素生产提供了足够的生物量积累,最终在5 L发酵反应器中将番茄红素的产量提高至1.12 g/L[59]。与温度调控类似,溶解氧响应的启动子Pnar,也可以实现细胞生长与产物合成的分段进行。通过将发酵过程分为高氧诱导生长阶段和低氧诱导生产阶段,启动子Pnar已经成功应用于大肠杆菌中D-乳酸、2,3-丁二醇和1,3-丙二醇合成的动态调控,产量分别为113.12 g/L、48.0 g/L、15.8 g/L[60]。类似地,培养基pH值也可作为输入信号应用于代谢途径动态调控。研究人员将低pH条件下高效启动下游基因表达的启动子Pgas用于黑曲霉中衣康酸合成途径的动态调控,通过低pH条件下激活cad编码的顺乌头酸脱羧酶表达,将衣康酸产量提高至4.92 g/L[61]。另外,响应胞外pH扰动的跨膜单组分调节器CadCΔ被应用于解决D-木糖氧化途径中D-木糖酸瞬时积累所造成的培养基酸化问题。D-木糖酸的积累造成了胞外pH降低,随后激活了CadCΔ介导的D-木糖到D-木糖酸合成途径的动态抑制,此时积累的D-木糖酸进入下游途径进行消耗,由此最大程度地减少了过多D-木糖酸积累对细胞生长的影响。与不含调节器的对照组相比,乙二醇产量提高了170%[62]。

图5 Cl857/PR温度调控回路的作用机制Fig.5 Mechanism of Cl857/PR temperature control circuit
3.2 光响应开关在动态调控中的应用
相较于温度、溶氧和pH控制的动态响应开关,光诱导开关具有高分辨率、传送快速、可逆性好、强度可控、对系统干扰少等优点[63]。通过改变光强以及曝光时间,可以调控光控开关的输出水平,由此实现代谢途径中酶表达水平和表达时间的精确调控[64]。以蓝细菌中光诱导的UirS/UirR系统为例,该双组分系统由膜结合传感器UirS、胞质反应调节器UirR和输出启动子组成。在绿光条件下,UirS处于稳定的基态,不启动UirR对基因表达的调控;而在紫外光条件下,UirS发生自磷酸化激活,随后磷酸化集团转移至UirR完成反应调节器的激活,从而启动UirR对基因表达的调控(图6),因此,通过紫外光与绿光的切换,UirS/UirR双组分系统可以实现对基因表达水平的可逆动态调控[65]。原理更简单的光诱导单组分系统也被应用于代谢途径的动态调控。例如,由粗糙脉孢菌光感受器VVD改造而来的Magnets是一种蓝光诱导的单组分系统。在Magnets中,nMag和pMag两个单体被设计成基于静电相互作用识别彼此以消除同质二聚并增强光诱导的异质二聚。通过光诱导的两个单体分离或二聚化来形成蛋白质分裂或激活状态的切换,Magnets以直接控制蛋白质活性的方式实现代谢过程的动态调控。研究人员将nMag 和pMag分别与T7 RNA聚合酶分裂的两部分相连,实现了蓝光诱导下单体光聚化引发的T7 RNA聚合酶激活和黑暗状态下单体分离引发的T7 RNA 聚合酶分裂,进而动态调控了下游基因的表达水平[66]。基于这一原理,Zhao 等[67]在酵母中构建了一个名为OptoEXP的光控制开关。在该调控体系中,启动子Pc120由融合蛋白(VP16-EL222)调控,黑暗状态下VP16-EL222失活,启动子Pc120无法开启转录;蓝光照射下VP16-EL222激活并与启动子Pc120结合,启动下游基因的表达。由此实现了蓝光诱导的生长模式和黑暗诱导的生产模式之间的细胞代谢状态切换,该工程菌株在摇瓶中生产了3.37 g/L的异丁醇,与没有光动态控制的菌株相比,产量提高了4倍。光诱导开关的切换具有瞬时性,而且光的产生以及光的强度具有可编程性,这些特点为光诱导调控开关与计算机智能化控制和反馈的结合提供了理论依据和实验基础[68],但是想要应用于大规模发酵反应,还需要解决受光不均匀所造成的细胞低效率诱导问题,另外还需要设计透光性好、搅拌均匀的生物反应器来解决高密度培养过程中的光透性问题。

图6 光诱导的双组分系统Fig.6 A two-component system induced by light
3.3 培养基成分响应开关在动态调控中的应用
除了利用人为控制的发酵条件调控细胞生长状态,培养基的营养成分也可作为动态调控的开关对细胞工厂进行调控。应用营养成分响应的调控元件,通过调控发酵营养成分的浓度变化来调控基因表达水平,这种调控使得细胞可依据环境的营养状况自主调节生产与生长模式的切换。例如,Bothfeld等[69]构建了基于葡萄糖浓度的响应开关,可在葡萄糖浓度降低时激活聚羟基丁酸酯合成途径中的基因表达。该系统在重新引入葡萄糖的情况下依然可以稳定表达,与静态诱导相比,其生长状况良好且产量相当。在此基础上,David等[70]将响应葡萄糖浓度的PHXT1启动子与响应3-羟基丙酸合成途径前体丙二酰辅酶A 的FapR/PTEF1巧妙结合,构建了一个串联基因线路,实现了3-羟基丙酸合成过程中生长阶段与生产阶段的解耦联。在发酵初期,高浓度葡萄糖诱导启动子PHXT1控制的脂肪酸合成酶表达,将丙二酰辅酶A转化成脂肪酸;同时阻遏蛋白FapR抑制启动子PTEF1控制的丙二酰辅酶A还原酶表达,此时细胞处于生长阶段。随着葡萄糖浓度降低,PHXT1控制的脂肪酸合成酶表达水平受限,实现丙二酰辅酶A的积累,从而激活启动子PTEF1控制的丙二酰辅酶A还原酶表达使细胞进入3-羟基丙酸合成阶段。这种调控策略通过对生长阶段和生产阶段进行动态调控,使3-羟基丙酸的生产能力提高了10倍[70]。
不同于完全自主的群体感应调控系统,基于发酵过程条件控制的动态调控需要人工操作来改变信号输入,因此减少了信号阈值和响应物种类的限制,为更加精细化的动态调控线路构建与应用提供了可操作的空间。通过计算机程序化调控信号的输入,可以赋予发酵条件控制系统智能化、自主调控的特性。另外,满足发酵条件调控要求的大型发酵设备的开发也是不可忽视的,这同样是发酵条件调控应用于实际生产的关键因素。
4 蛋白水平动态调控策略的研究与应用
微生物中广泛存在的别构调节可用于开发蛋白水平的调控策略。别构调节是指别构蛋白将效应物与别构结合位点的结合效应传递到活性位点,从而对蛋白质的活性进行调控的过程[71]。通过结合效应物后的构象改变,可以直接调节蛋白质活性来动态调控代谢通量而不引入过多的代谢负担[72],具有较大的应用潜力。例如,在自然界中,细胞通过终产物对分支途径中的酶进行别构调控来防止通路的溢流。在赖氨酸生物合成过程中,苏氨酸的生产途径会与其竞争代谢流。为了调控两条途径之间的代谢流分配、提高赖氨酸的产量,研究人员改造了苏氨酸合成途径中的高丝氨酸脱氢酶,使其受赖氨酸的别构抑制调节而不再受苏氨酸的调节。通过这种人工设计的别构调节,可以根据细胞内赖氨酸的浓度动态调控进入苏氨酸途径中的通量,降低竞争途径的碳流,达到提高赖氨酸产量的目的。但是,改造后的高丝氨酸脱氢酶与野生型相比活性相对较低[73]。这种蛋白水平的别构调控具有较快的反应时间,大量官能团和蛋白折叠赋予了蛋白调控元件更广阔的设计和改造空间,但抗代谢物和拮抗剂的存在容易干扰其对代谢物的特异性,这是该调控方法目前亟待解决的问题[14]。此外,一些蛋白水平的调控工具也可以实现代谢通路普遍适用的动态调控。例如,Gao等[74]利用三种病毒蛋白酶和蛋白降解标签构建了可以调控蛋白表达水平的振荡器,用于振荡表达D-木糖酸合成途径中的木糖内酯酶,以解决D-木糖酸积累造成细胞质酸化进而影响细胞生长和产物合成的问题。蛋白水平振荡器的应用,实现了前6 h 内木糖内酯酶的有效振荡表达,维持了胞内pH 稳定,在5L 的发酵设备中生产了199.44 g/L 的D-木糖酸。Brockman等[75]将SsrA降解标签用于肌醇合成途径中1-磷酸果糖激酶降解速度的动态调控,从而对葡萄糖-6-磷酸进入糖酵解途径和肌醇合成途径的通量进行调控,通过生长阶段与生产阶段切换的方式将肌醇的积累量提高了2倍。
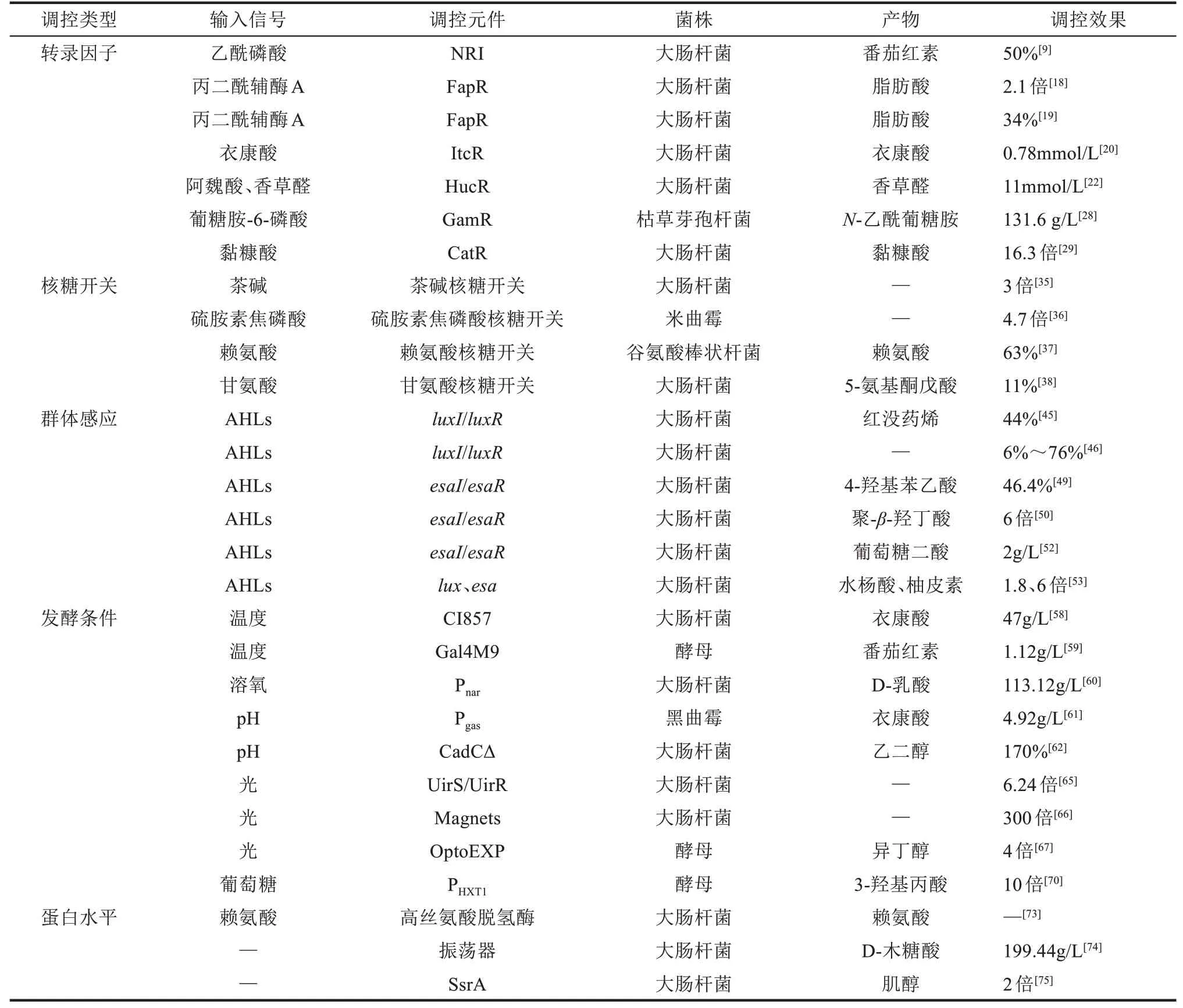
表1 动态调控元件在代谢工程中的应用Tab.1 Applications of dynamic regulation elements in metabolic engineering
5 展 望
动态调控策略实现了物质流与能量流在代谢网络中的动态分配,减小了外源途径引入对细胞生长和代谢流平衡的影响,进一步提高了目标产品的产量、产率和生产能力,以更有效的方式调控了多种高附加值产品的高效生物合成。在表1中,我们对本文引用的动态调控元件进行了总结。但是,动态调节传感器种类少、响应阈值窄、调控范围有限和调节时间不定等问题仍然制约着这些策略在代谢工程中的高效应用。我们认为以下策略的研究和发展有助于解决上述问题,首先,基于高通量筛选和底物相似性的筛选策略可拓宽启动子或转录因子响应的底物谱和阈值,进一步拓宽传感器的种类;基于计算模拟和理性设计的蛋白质工程方法开发可在不同浓度和强度范围内自由响应的感应器,有利于探索更多精确调节的时间和节点,调节感应器响应阈值的范围,为动态调控提供新的研究思路和调控工具。其次,引入调控回路和代谢途径动态分析的数学模型(例如非参数高斯过程回归GPR[76]、动态酶消耗通量分析deFBA[77])分析调节时间和对应的代谢流节点,结合不同时间响应的感应器文库,可为精确分配代谢流和选择动态调控元件提供科学准确的指导。此外,利用工程设计思想将不同的动态调控元件与基因控制元件耦合,开发出多层次多功能的调控元件,有望逐级放大式调控胞内反应,实现点-线-面的辐射式调控,扩大代谢通路响应速度和程度。最后,基于“与非门”和“逻辑门”等合成生物学思想设计的精细基因线路与动态调控元件耦合可拓宽动态调控工具的应用范围,有望实现同时对多个基因进行不同表达时间和不同表达程度的精确调控,为构建动态调控系统提供科学有效的指导。这些策略都有助于动态调控体系在代谢工程领域进一步发展和应用。除此之外,设计具有更快响应时间的调控工具来弥补实际生产中信号输出与表型改变之间的差距将有利于实现更有效的动态调控;同时维持发酵过程中调控系统的稳定性,消除代谢异质性对实际生产的影响等问题也有待于深入研究以进一步优化动态调控的响应稳定性和实时性。相信随着合成生物学、计算机模拟技术和蛋白质工程等学科的进一步发展,一定会推动动态调控策略在代谢工程领域的应用。

