植物合成生物学的现在与未来
邵洁,刘海利,王勇
(1 中国科学院上海植物生理生态研究所,中国科学院分子植物科学卓越创新中心,合成生物学重点实验室,上海200032; 2 中国科学院大学,北京 100049)
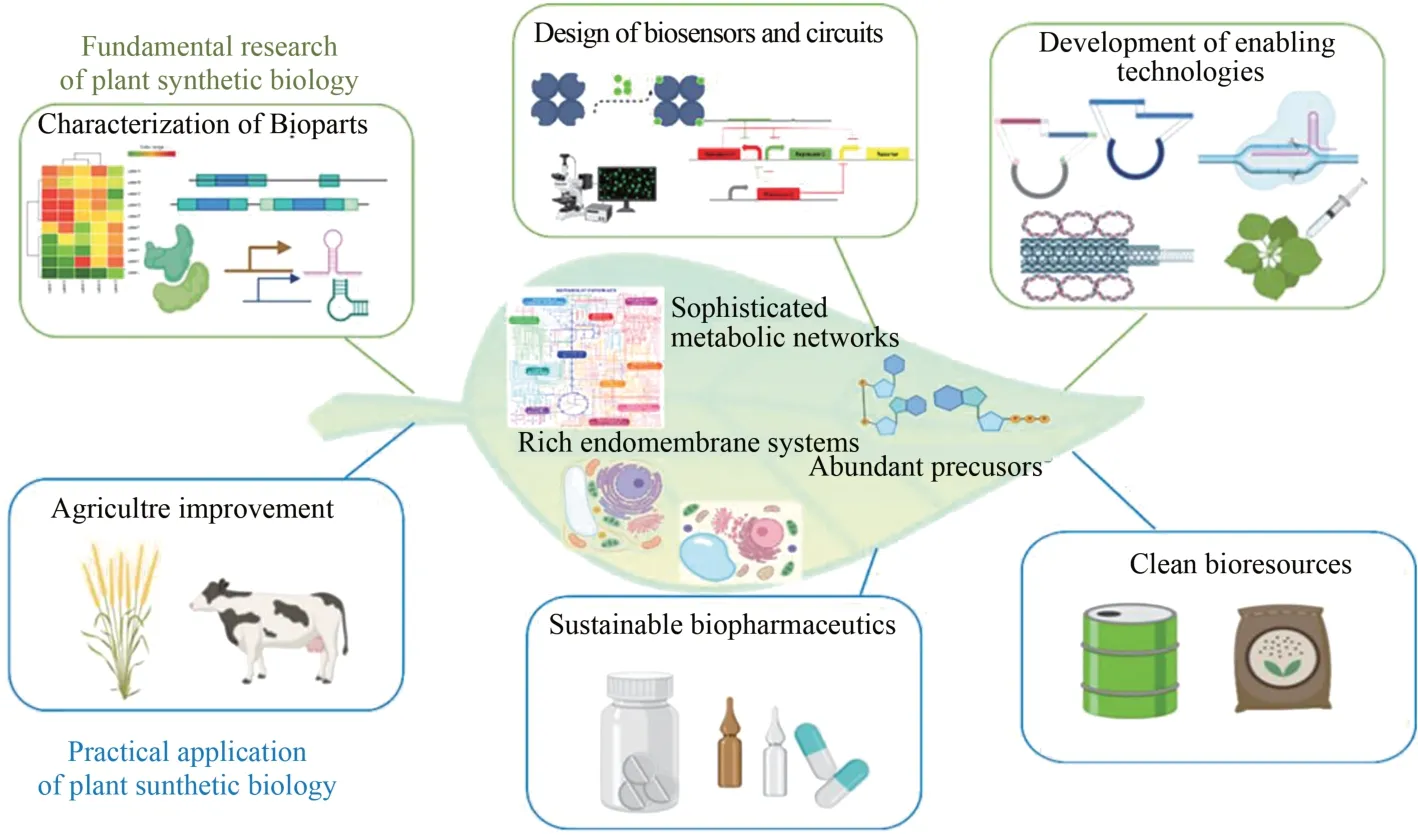
随着世界人口快速增长与资源日益减少,人类必须开发新型高效生物系统,以满足对食品、药品、能源不断增长的需求。合成生物学作为一门新兴的交叉学科,在工程学思想的指导下,结合不同生物学领域的知识技术,能以各种理想的方式设计改造生物系统。该领域过去十多年的发展,从设计生物装置、建立代谢通路到合成基因组,大多是在微生物底盘中进行的[1],但随着研究的深入,简单的单细胞体系已无法满足发展需求,需要向多细胞的复杂体系过渡,因此植物合成生物学日益兴起。
由于调控网络的集成性、信号组分的冗余性,植物的基因型和表型之间的联系并不明显,复杂的相互作用影响了研究人员在系统水平上对植物基因功能与作用机制的研究,进而阻碍育种策略的改善[2]。植物合成生物学以一种自下而上的方法将生命系统细分为不同的功能模块,例如代谢途径模块、调控通路模块等,随后将其组合成新型系统,有助于更好地理解复杂的生物学过程。本文作者将回顾植物合成生物学近年来在基础研究方面的重要进展(图1)[3-18],阐述其在农业生产、生物医药、能源资源可持续发展方面发挥的作用,展望该领域未来发展方向。
1 植物元件与装置开发设计
元件作为植物合成生物学基本要素,深入挖掘和功能鉴定是该领域内的重要工作。英国约翰英纳斯中心(John Innes Centre)为首的研究团队[19]近期系统评估了大量调控元件对基因表达的影响,发现pBdEF1α、p35S、pAtUBI10、pOsUBI3、pZmUBI、pBdUBI10 和pOsPGD1 7 个 启 动 子 和t35S、tNOS、tH4、tAdh 和tOCS 5 个终止子在单、双子叶植物的叶片和根中都有较高的强度,可用来驱动目的基因表达或用于构建多基因复合性状载体。绝缘子位于启动子与调控元件之间,具有隔绝其他元件对基因进行调控的功能,因此这一类顺式作用元件可在植物合成生物学中起到稳定外源基因表达、降低位置效应作用。为了挖掘有价值的绝缘子序列,Perez-Gonzalez 等[20]对来自烟草、鸡溶菌酶、拟南芥的基质结合区(matrix attachment regions,MAR)和矮牵牛的转化促进序列(transformation boost sequence,TBS)进行测试,发现上述4种绝缘子序列均能够增强外源基因表达,并且拟南芥MAR 序列还能够减小基因表达的变动幅度。
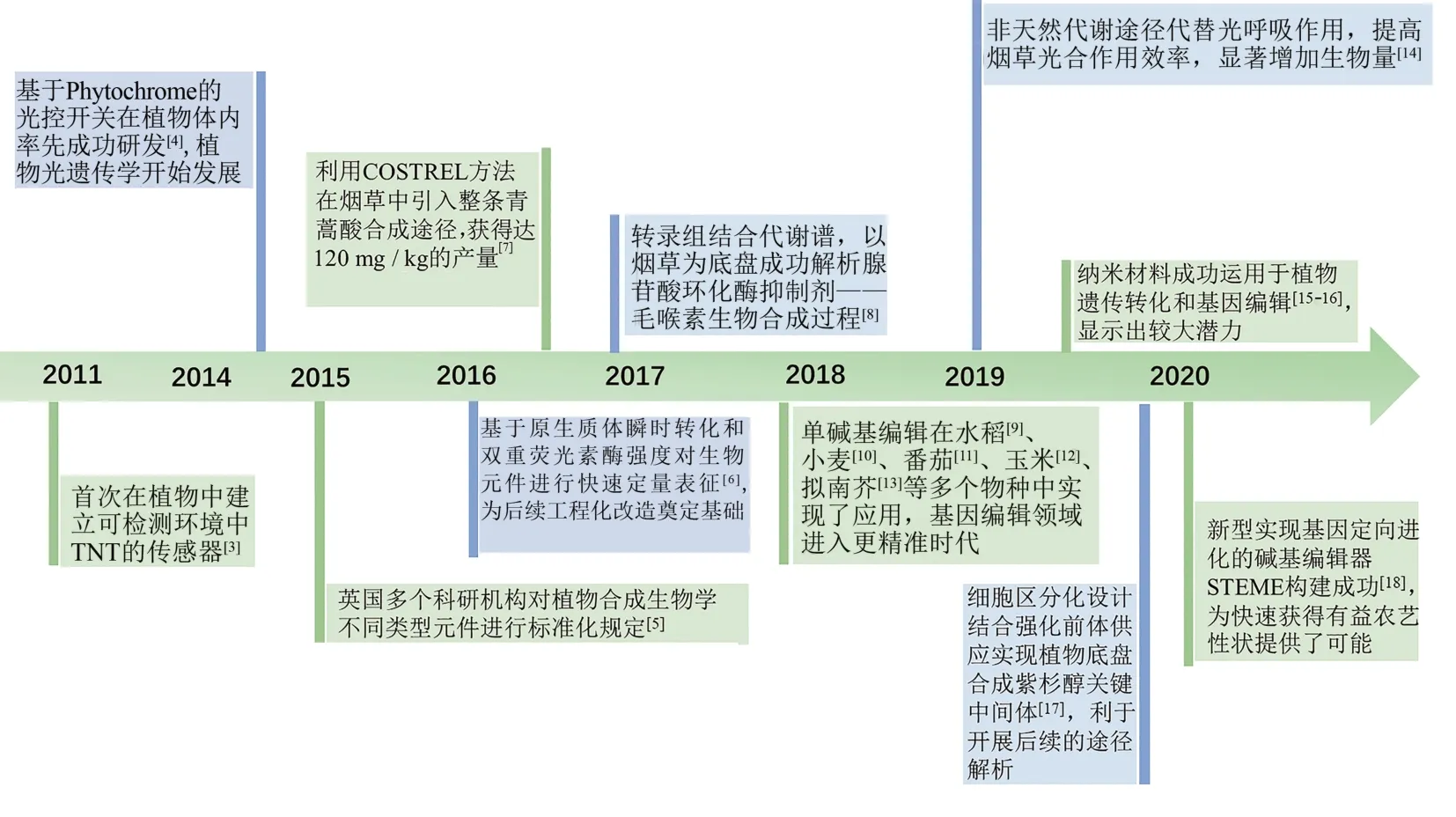
图1 植物合成生物学近年的发展Fig.1 Recent advances in plant synthetic biology
尽管越来越多生物元件被鉴定测试,但自然界固有的元件有时无法满足植物合成生物学的需求。例如进行植物基因编辑时使用的野生型水稻U3/U6 启动子长度较大,不仅构建sgRNA 表达盒时连接效率低,而且串联连接sgRNA-linker重复单元时转录能力有限。为解决这一问题,Hao 等[21]对该类启动子进行保守元件保留、5′端上游序列(upstream sequence element,USE)去除、创建单子叶植物特异启动子(monocot-specific promoter element,MSP)等改造,获得了转录活性更高的精短型的小核RNA 启动子,为植物多基因编辑提供了强有力的工具。细胞色素P-450 氧化酶作为广泛存在于生物体内的催化元件,在天然产物合成和外源物质代谢中具有关键作用,但这类催化元件参与的生化反应存在催化效率低、底物专一性差等特点,限制了其应用。近年来,Arnold 教授课题组以P-450 氧化酶为研究对象,利用定向进化先后实现了其高效催化烯烃的反马氏氧化[22]、双环丁烷的构建[23]及卡宾的碳氢插入反应[24],展示了催化元件可以通过改造打破自然进化的限制。
植物合成生物学的核心思想是基于标准化的生物元件进行工程化改造以获得新型生物功能,因此对于元件的定量和标准化是现阶段亟需解决的问题。Schaumberg 等[6]已开发出一种利用原生质体瞬时转化和双重荧光素酶输出强度对遗传元件进行快速定量表征的方法,通过观察瞬时表达测定法中的实验变异性,开发对应的数学模型以及统计归一化方法,从而提取定量参数。尽管国际基因工程机器大赛自2010 年开始收录植物来源标准生物元件,但是由于这些元件由不同参赛者提供,未经系统校准,在后期组装时可能存在兼容性问题,无法高效地完成新系统的构建。因此,2015 年英国生物技术和生物科学研究理事会(The Biotechnology and Biological Sciences Research Council,BBSRC)和工程与自然科学研究理事会(The Engineering and Physical Sciences Research Council,EPSRC)等机构对植物标准元件做出如下规定[5]:①元件内部应无BsaI 识别序列,同时为了与Golden Gate 模块化克隆(modular cloning,MoClo)和GoldenBraid2.0(GB2.0)兼容,应避免BpiI、BsmBI 识别位点;②不同类型元件须对应不同融合位点;③标准元件两侧应引入BsaI 识别序列和定义的融合位点。
利用不同元件合理规划可以设计遗传装置,植物合成生物学现阶段最具有代表性的遗传装置为各类传感器和遗传开关。植物传感器主要组成部分通常包括输入元件和输出元件,前者可识别如Ca2+、pH、激素、初级代谢物、活性氧、营养元素等反映植物生理状态的内源信号[25],后者能将其转化为不同的信号,如荧光、代谢通路的关闭等信号。2011 年Fernandez-Fuentes 等[3]建立了第一个可以监测环境中TNT 小分子的植物传感器。接着Luo 等[26]利用pH 传感器pHusion[27]与高尔基体/初级内体(trans-Golgi network/early endosome,TGN/EE)标签SYP61 融合,通过检测TGN/EE 膜内外酸碱变化揭示了酸化对于植物系统分泌和循环的重要性。植物遗传开关装置可根据特定化合物、光等外源信号,对基因表达进行转录和翻译水平上的调控。常见的化学诱导开关有受IPTG 诱导的乳糖操纵子系统[28]、四环素诱导的TetR/tetO 系统[29]、乙醇诱导的AlcR/AlcA 系统[30]、地塞米松诱导的pOP/LhGR 系统[31]、β-雌二醇诱导的XVE/OlexA 系统[32]等。由于化学诱导物的丰度、扩散速度和细胞毒性在植物体内的限制,这类开关只能在有限的时空发挥作用。近年来,光遗传学技术因其无损、可逆、非入侵等特点,正成为一种动态调控基因表达新策略。目前光控开关主要来源于细菌和植物的光受体,如UV-B RESISTANCE8、phototropin1/EL222/CRYP-TOCHROME2、CarH、PHYTOCHROME B/A[33]。其中基于PHYTOCHROME[4]和CarH[34]的光控开关在植物体内率先试验成功。最近,Bernabe-Orts 等[35]利用噬菌体ΦC31 位点特异性整合酶设计出针对植物的记忆开关,通外部操控ΦC31 整合酶及其重组方向因子(recombination directionality factor,RDF)来控制目标基因的转录状态。
由于植物合成生物学设计该过程中涉及大量元件选择、参数改进、网络层系结构优化,因此需要强大的计算机辅助设计(computer aided design,CAD),目前已有用于设计和优化植物元件的Gene Designer[36]、Geno CAD[37],可改进用于设计植物拓扑结构和网络的OptCircuit[38]、SynBioSS[39]、e-Cell[40]及模拟分析植物形态发生过程中细胞间相互作用的CellModeller[41],但考虑到植物系统输出的多样性和目前可用资源的有限性,未来这些工具的开发应跟上发展的需求。
2 应用于植物合成生物学的使能技术
植物合成生物学的迅速发展离不开各类使能技术的开发,从多片段大尺度的DNA 组装,到精确便捷的基因编辑工具,再到高效稳定的转化方法,逐步实现了对植物整体的设计重构。
2.1 DNA组装
目前植物合成生物学常用的体外组装技术主要依赖于重叠序列或IIS 型限制性内切酶,前者典型代表为Gibson 等温一步法[42],后者常见为Golden Gate[43],并衍生出GoldenBraid[44]、GreenGate[45]和MoClo[46]等方法。由于Golden Gate 构建的片段符合合成生物学的标准化与模块化思想,Pollak等[47]在此基础上开发出基于递归的Loop assembly,通过在两个载体间循环,可以将标准的0级元件组装成包含1个、4个、16个或更多基因的转录单元,组装尺度达38 kb,效率大于80%。尽管目前可用的高效率组装方法不少,但无痕拼接和模块化组装似乎总是矛盾的。为了解决这个问题,Hochrein 等[48]引入了AssemblX 的组装流程:允许从单基因水平进行多个元件无痕、不依赖序列的标准化、模块化从头组装,实现多达25 个功能单元的构建。除上述这些胞外组装方法,Shih 等[49]利用酵母体内同源重组开发了jStack技术,不仅能组装紫色杆菌素的整个合成途径,还可实现20.50 kb大小的基因簇构建。近年来,高通量的自动液体处理机器人(automated liquid-handling robots)技术[50]的应用也推动了DNA 自动化组装的发展,Storch等[51]对开发的DNA-BOT平台进行测试,同时进行含10 种遗传元件的88 种类型组装和转化,实验证明整个构建测试仅需1.5 h,高效高精度构建平均成本可控制在1.50~5.50美元。
2.2 基因组编辑
基因组编辑技术能够精准靶向及特异性修饰植物基因组,进行基因功能研究,为物种定向改造奠定基础。目前研究人员使用最多的植物编辑技术为CRISPR/Cas9 和CRISPR/Cas12a 系统,能够实现基因敲除、插入(替换)和单碱基编辑[52]。刘耀光团队[53]利用植物密码子优化的Cas9 基因,将靶向不同基因的多个sgRNA表达盒组装转化后可同时敲除水稻中7 个基因,效率达85.40%。2019 年Decaestecker等[54]引入细胞特异性的启动子,开发出的 CRISPR-TSKO (CRISPR-based tissue-specific knockout system)技术能够针对特定的细胞类型、组织、器官进行高效敲除。自Komor 等[55]开发单碱基编辑技术以来,基因编辑领域进入一个更为精准的时代。目前常见的胞嘧啶碱基编辑器(cytidine base editors,CBE)、腺嘌呤碱基编辑器(adenine base editors,ABE)已在水稻[9]、小麦[10]、番茄[11]、玉米[12]、拟南芥[13]等多个物种中实现了应用。由于单碱基编辑器的编辑能力有限,且可能存在严重的脱靶效应[56],因此Lin等[57]建立起适用于植物任意碱基编辑的技术——植物引导编辑技术(plant prime editing,PPE),在水稻和小麦的原生质体中实现12 种类型、16 个位点的精确编辑。2020年初,新型的饱和靶向内源基因突变碱基编辑器[18](saturated targeted endogenous mutagenesis editors,STEME)构建成功,实现了水稻乙酰辅酶A羧化酶基因(acetyl-coenzyme A carboxylase,ACC)定向进化,获得除草剂抗性突变,为快速获得有益农艺性状提供了可能。除上述RNA 介导的基因编辑,为了避免外源片段整合到基因组中的潜在风险,研究人员尝试将Cas 蛋白和gRNA 在体外组装成核糖核蛋白复合体(ribonucleoprotein,RNP)进行DNA-free 的编辑,并已在14 种植物中成功测试[58]。这种方法对于回交耗时的葡萄、苹果[59]或依靠营养繁殖的土豆[60]等植物特别适用。
利用核酸酶失活的dCas(dead Cas)与转录激活因子或抑制因子融合,CRISPR/dCas9 系统还可调控靶基因表达。目前增强植物体系转录激活的策略主要有3类:①各种转录激活因子如VP64[61]、EDLL[62]直接与dCas9 融合;②通过对gRNA 结构改造招募转录激活因子,如在sgRNA 的茎环上加入核酸适配体aptamer,使sgRNA 能够与融合转录激活域的MS2 噬菌体外壳蛋白结合[63];③使用多重转录激活系统同步激活多个基因,如mTALEAct 系统、CRISPR-Act 2.0 系统[64]。同样的原理,将Cas蛋白与表观遗传相关的去甲基化酶或乙酰化酶融合,还能对靶序列进行相应的表观遗传修饰,目前研究人员已通过CRISPR/Cas9 SunTag 系统,实现了拟南芥体内DNA 的去甲基化[65]和甲基化[66]。
2.3 遗传转化技术
植物的遗传转化和细胞再生技术开发对于整个植物合成生物学的发展至关重要。传统的外源生物大分子进入植物细胞有农杆菌转化法和基因枪法,然而前者可应用的宿主范围有限,后者的高速轰击可致组织损伤产生不良反应。为了解决这一问题,Landry团队[67]在2018年提出将纳米技术用于植物遗传转化,修饰过的纳米材料结合RNA、DNA 和蛋白质等生物大分子可形成纳米颗粒,经胞吞或直接穿透进入细胞,为所有植物进行遗传转化提供了可能。2019 年,该团队[15]发现高纵横比的碳纳米管(carbon nanotubes,CNTs)能被动穿过细胞膜和叶绿体,同时生物大分子与CNT 结合后可免于被代谢降解。在此基础上实现了质粒DNA 在烟草、芝麻菜、小麦和陆地棉中的转化。接下来他们[68]设计了可透过细胞壁的新型的纳米材料,直接将siRNA(small interfering RNA)传递到成熟的植物组织,有效沉默了基因在烟草叶片中的表达。同年Doyle 等[69]通过叶面喷洒Cas9 和gRNA 质粒-纳米复合体,也顺利实现了对小麦减数分裂特异蛋白基因(meiosis-specific protein,SPO11)的编辑。以上实验证实了利用纳米材料为载体进行遗传转化和基因编辑在一定程度上是可行的。然而如何将转化或编辑稳定遗传到下一代仍然是需要解决的问题。Maher等[70]利用植物体细胞的全能性,通过在植物中同时表达编辑系统和发育调控因子(developmental regulators,DR)如WUS(WUSCHEL)、STM(SHOOT MERISTEMLESS)、MP(MONOPTEROS),无需组织培养能够产生稳定遗传的基因编辑植物。与上述核基因组转化相比,叶绿体转化具有定点整合无位置效应、高效表达外源基因、不存在基因沉默或表观修饰、稳定遗传等优点[71]。但这项技术适用的物种范围极为有限,在过去25 年中只在极少植物如番茄[72]、土豆[73]、生菜[74]和杨树[75]中实现,转化效率低、缺乏有效的筛选标记以及再生植株不育等问题阻碍了叶绿体转化技术的大规模应用。德国马普分子植物生理研究所Bock 实验室[76]以拟南芥根系愈伤组织为材料,利用CRISPR/Cas9 技术敲除拟南芥自身的有关抗性基因,提高了转化效率,并解决了叶绿体遗传转化再生植株不育的问题。但该工作依然存在操作烦琐、适用面窄的问题,Kwak 等[16]通过设计能与DNA 结合的壳聚糖复合单壁碳纳米管(single-walled carbon nanotubes,SWNTs),利用脂质交换膜渗透(lipid exchange envelope penetration,LEEP)机制将纳米颗粒成功送入多种植物叶绿体,完成基因递送和瞬时表达,进一步证明纳米材料在植物遗传转化领域的巨大潜力。
3 植物合成生物学的实际应用
面对日益增长的人口对各类资源的需求,还要考虑如何在全球气候变化的背景下可持续发展是全球面临的巨大挑战。近年来,植物合成生物学颠覆性的概念和技术与“绿色革命”的理念十分契合,可以在应对这些复杂挑战过程中发挥重要作用。
3.1 农业生产与性状改良
为了满足2050 年的全球人口需求,粮食产量需要增加70%[77]。植物合成生物学将工程原理贯彻到生物系统中,有望突破传统农业瓶颈,带来产量、抗逆和品质改良方面的突破性进展。目前植物合成生物学可在下述4个方面助力农业发展。
3.1.1 增加农作物生物量
提高光合作用羧化效率、控制光呼吸作用、提高水分利用效率和光能利用效率是改善植物生长和农业产量的主要策略。光合作用固定CO2的核糖-1,5-二 磷 酸 羧 化 酶/加 氧 酶(ribulose-1,5-bisphosphate carboxylase/oxygenase,RuBisCo)是决定光合效率的关键酶。当氧气浓度过高时,RuBisCo会氧化底物,降低光合效率,前期尝试增加酶活和底物特异性以减弱加氧酶活性的尝试并未成功[78]。考虑到蓝细菌羧酶体(carboxysomes)能够更高效地富集CO2,Long等[79]用蓝细菌Form-1A RuBisCo大、小亚基基因以及两个关键α-羧酶体结构蛋白的基因成功取代了烟草内源性RuBisCo大亚基基因,有望提高植物羧化效率。为了提高呼吸过程中CO2的利用率,Schwander等[80]构建出由17种蛋白组成的CETCH 循环[the crotonyl-coenzyme A(CoA)/ethylmalonyl-CoA/hydroxybutyryl-CoA cycle]进行体外CO2同化,测试结果证明该循环固碳速率[5 nmol/(min·mg)]与传统的卡尔文循环相当[1~3 nmol/(min·mg)]。为使植物更有效回收RuBisCo氧化产物,South 等[14]引入了3 条非天然代谢途径代替光呼吸作用,其中在烟草叶绿体内表达衣藻来源乙醇酸脱氢酶(glycolate dehydrogenase)和南瓜来源的苹果酸合酶(malate synthase),可将乙醇酸直接转化为苹果酸进入卡尔文循环,同时在RNA干扰(RNA interference,RNAi)抑制质体乙醇酸/甘油酸转运蛋白1(plastidic glycolate-glycerate transporter 1,PLGG1)阻止乙醇酸离开叶绿体的情况下,植物生物量可增加40%。Trudeau等[81]提出二磷酸乙醇酸(2-phosphoglycolate)转化为羟乙酰辅酶A(glycolyl-CoA)并重新同化进入卡尔文循环的想法,利用计算机辅助设计和定向进化策略,先对乙酰辅酶A 合成酶进行设计(acetyl-CoA synthetase)以提高其稳定性和催化效率,再改造丙酰辅酶A 还原酶(propionyl-CoA reductase)提高底物选择性和NADPH 的利用,建立起不释放CO2的碳中性光呼吸旁路。除了上述在植物中对代谢途径进行重构,利用气孔动力学[82]和人工改造向光素[83]也是当前改善光合作用的新策略。
3.1.2 减少农业化肥施用
发达国家维持农业生产力每公顷(1公顷=104m2)耕地需使用约140 kg化肥,在发展中国家低施肥率导致单产降低[77]。面对农作物的氮利用效率低、地下水污染、磷资源有限等问题,采取大量施肥方法是不可持续的。因此利用合成生物学的方法研究植物氮磷吸收机制,提高养分利用率大有可为。
前期提高植物氮磷利用效率的尝试主要集中在涉及养分吸收、分配、代谢或转录调节的单个组分修饰上,因此收效甚微。利用植物合成生物学减少肥料使用的主要策略包括在农作物中引入功能性固氮酶、共生固氮系统、微生物组提高养分利用率。固氮过程中涉及的基因数量众多、对氧敏感、有金属辅因子(如铁、钼)依赖性[84],功能性固氮酶亚基的组装具有不小的挑战性。由于线粒体基质中耗氧蛋白的存在可使对氧敏感的固氮酶保持活性,同时线粒体还是植物金属酶合成的主要场所,有利于固氮酶亚基的生物合成装配,因此线粒体被认为是进行固氮酶组装的适宜区域。Allen等[85]已在本氏烟草线粒体基质中完成16 种固氮酶的瞬时表达,为下一步建立固氮体系奠定良好基础。Rogers 等[86]也提出可在农作物中建立根瘤菌-豆类共生体系,通过结节因子感知信号,生成次根结节器官,利用细菌感染在结节内部建立固氮酶活性。与前面这些方法相比,在植物中自下而上地构建微生物群是同时提高植物中氮和磷利用率的合适策略。近年来植物根际微生物组方面的工作体现出较大的应用潜力,通过建立信号通路实现植物与微生物间的互作。如Rhizopines 是根瘤菌-豆科植物共生过程分泌一种特殊化合物[87],将合成Rhizopines 信号通路转入农作物,改造后的植物可与根系周围菌群交流并进行控制,为后期辅助固氮提供可能。激素独角金内酯[88]在丛枝菌根真菌和固氮菌共生中起着至关重要的作用,有针对性地调节独角金内酯的分泌也可能吸引有用的微生物为植物提供养料。
3.1.3 增强作物的抗逆性
农作物通常在生命周期中会受到多种因素的胁迫,全球变暖更是加重了非生物胁迫,干旱造成的农业损失可能达500亿美元,其与高温双重胁迫可能导致整个农业生产2000 亿美元的经济损失[89]。 Glowacka 等[90]推 测 光 系 统Ⅱ亚 基S(photosystem Ⅱsubunit S,PsBs)的表达会影响与叶绿体相关的信号,利用该信号对光有响应并控制着气孔的开放,可提高植物对水的利用率。他们构建了一系列PsBs 表达量不同的转基因烟草,发现在光照条件下,PsBs 表达增加的植物有较少的气孔开放,田间条件下CO2同化的水分损失平均减少25%。景天科植物特有的景天酸循环(crassulacean acid metabolism,CAM)能在夜间吸收CO2,其水利用率比C3 植物高6 倍、比C4 植物高3 倍[91],使植物能够生活在缺水的环境中。Yang 等[92]认为对水分的高利用率以及强大的抗旱性能使得景天酸循环代谢作用可以作为作物改良途径的有效途径。近期Vaidya 等[93]发现了一种新型的ABA 受体激动剂OP(opabactin),其在小麦和番茄体内抑制水分蒸腾的作用比ABA更加持久,可显著提高植物抗旱性,为农业生产中的节水抗旱提供了新思路。
除了非生物胁迫,虫害、真菌感染等生物胁迫也会降低植物的生存能力和生产力,大约5万种农作物病害与生物胁迫有关[94]。由于小RNA 在植物受胁迫期间能提高抗性、降低敏感性,因此相应技术也成为植物分子育种的常用方法。最初,Vankammen 等[95]提出病毒诱导的基因沉默(virus induced gene silencing,VIGS)方法,通过转录后沉默使植物对RNA 病毒产生防御。但这种方法存在脱靶效应、表型丢失等限制,随后通过序列互补的小RNA 靶向敲除入侵转录本的方法相继被开发[96-98],正义/反义RNA(sense/antisense RNA),双链RNA(double-strand RNA)和人工microRNA(artificial RNA miRNA,amiRNA)是目前开发抗逆生物的新主题。Kis 等[99]根据大麦miRNA 前体设计了靶向小麦矮小病毒的不同保守序列的amiRNA,同时选择潜在的amiRNA 序列最大程度地减少脱靶效应。根据瞬时传感系统测试数据,他们发现同时表达3 个amiRNA 的多顺反子转化至大麦只表现出轻微的病毒感染症状,病毒RNA 表达低于Northern Blot 分析的检测极限。近年来CRISPR-Cas 系统也已被用于生产抗病毒植物,如Zhang 等[100]将FnCas9 与 靶 向 黄 瓜 花 叶 病 毒(cucumber mosaic virus,CMV)或烟草花叶病毒(tobacco mosaic virus,TMV)的sgRNA 在烟草和拟南芥中共表达后,植株感染症状明显减弱,病毒RNA 积累显著降低,证明该技术能够赋予植物对RNA病毒的分子免疫力。
3.1.4 改善农产品质量
除提高农业产量确保充足的粮食供应外,农产品的营养价值也应改善以解决营养缺乏问题。在以大米为主食且饮食多样性有限的情况下,人们容易缺乏维生素A,引起严重的健康问题。通过向水稻中引入八氢番茄红素合酶(phytoene synthase)和胡萝卜素去饱和酶(carotene desaturase)两种类胡萝卜素生物合成基因,合成积累β-胡萝卜素的黄金大米可解决这一问题[101]。超长链多不饱和脂肪酸(very-long-chain polyunsaturated fatty acids,VLC-PUFA),例如花生四烯酸、EPA 和DHA,与大脑发育有关,有利于降低心血管疾病的患病率。虽然开花植物中VLC-PUFA 的含量较低,但已知一些苔藓物种能以较高水平积累[102],VLC-PUFA生物合成途径的引入已成功地改善了模式植物苜蓿中VLC-PUFA 的含量[103]。De Lepeleire等[104]将叶酸生物合成所需的GTP 环化水解酶I(GTP cyclohydrolase I,GTPCHI)、氨基去氧胆酸合酶(aminodeoxychorismate synthase,ADCS)和下游线粒体中合成叶酸的HMDHP 焦磷酸激酶/二氢蝶呤合酶(HMDHP pyrophosphokinase/dihydropteroate synthase,HPPK/DHPS)基因导入土豆中,使其叶酸含量增加12 倍并能稳定储存。玉米作为重要的作物存在含硫氨基酸缺失的问题,Planta等[105]分别利用叶肉和维管束组织特异性启动子PepC 和RbcS,驱动大肠杆菌和铜绿假单胞菌来源参与硫同化代谢的腺苷5′-磷酰硫酸还原酶(adenosine 5′-phosphosulfate reductase,APR)在玉米中表达,在不影响作物正常生长的前提下获得了高含量蛋氨酸的玉米籽粒。Xing等[106]借助碱基编辑器A3A-PBE,对草莓bZIPs1.1高度保守的上游开放阅读框(upstream open reading frame,uORF)进行工程化改造,获得7个新颖的等位基因,产生的突变株整体糖含量比野生型高33.9%~83.6%。
改善农作物营养价值还包括消除不需要的次级代谢产物。在撒哈拉以南国家,作为主食的木薯中存在有毒的氰苷化合物,Jorgensen等[107]利用RNAi抑制氰苷生成过程中参与中间体亚麻苦苷(linamarin)和百脉根苷(lotaustralin)合成的细胞色素P-450 单加氧酶CYP79D1、CYP79D2 的表达,减小了木薯的毒性。镉和砷是易被水稻吸收的重金属,被污染的稻米可对人体健康产生极大危害,Deng 等[108]将两个液泡砷隔离基因——酵母来源YCF1(yeast cadmium factor1)和水稻来源ABCC1(ATP-binding cassette transporter)在根皮层和节间韧皮部细胞内特异性表达,有助于控制砷的转运,同时表达谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-ECS)以增加谷胱甘肽和植物螯合肽的含量,获得了砷的累积量降低70%的水稻。
3.2 天然产物与生物医药
天然产物作为生物活性物质和药物发现的重要源泉,拥有巨大的应用潜力和广阔的市场前景。利用植物底盘进行天然产物合成生物学研究方兴未艾。与微生物相比,植物复杂的空间特性,为不同代谢物的合成提供了所需的最适环境。根据研究目的不同,天然产物合成生物学研究可大致分为两大领域:提高天然产物已知活性成分含量和挖掘天然产物未知合成途径。
植物体内高效异源合成活性天然产物主要障碍包括:活性欠佳的催化元件、物质与能量间的不平衡和复杂的反应步骤导致的代谢负担过重[109]。为了克服这些障碍,植物合成生物学已逐步开发了一些新颖的工具和策略。首先,对于关键的生物合成基因可利用定向进化结合理性蛋白质设计以改善活性。Xu 等[110]根据前人对留兰香薄荷柠檬烯合酶(S-limonene synthase)丙氨酸扫描结果,在其关键位点引入若干突变后,生成主产物柠檬烯(limonene)的同时还可产生蒎烯(pinene)和芹菜烯(phellandrene)。LYU 等[111]在黄花蒿中抑制青蒿素生物合成竞争支路基因的表达,分配控制物质流,显著提高了青蒿素(artemisinin)含量。将参与天然产物合成的酶定位于不同的细胞器,除充分利用空间,还可降低中间体对细胞的毒害作用,Li[17]采用分区工程策略,将紫杉二烯5α羟化酶(taxadiene-5α-hydroxylase,T5αH)和氧化还原酶(cytochrome P-450 reductase,CPR)重新定位到叶绿体,并强化参与萜类前体合成的1-脱氧木酮糖-5-磷酸合酶(1-deoxy-Dxylulose 5-phosphate synthase,DXS)和香叶基香叶基焦磷酸合酶(geranylgeranyl diphosphate synthase,GGPPS)的表达,使得烟草中紫杉二烯(taxadiene)产量提高了10倍,达到56 μg/g 鲜重水平,为开展后续的途径解析提供了可能。调控基因表达的转录因子在天然产物合成过程也起到重要作用,研究人员利用正调控青蒿素生物合成的转录因子AaMYC2[112]、AaNAC1[113]和AaHD1[114],培育出的新一代黄花蒿不仅青蒿素含量达到1.50%~2.00%,还可在废弃的盐碱地生长,具有抗除草剂性能。Tohge 等[115]在番茄中引入金鱼草来源的转录因子Delila和Rosea1后,检测到花青素(anthocyanins) 和苯丙类黄酮衍生物(phenylacylated flavonol derivatives)的含量都有所增加,继续在番茄中引入拟南芥来源的黄酮特异性调控因子AtMYB12[116],黄酮类化合物(flavonols)和对羟基肉桂酸乙酯(hydroxycinnamates)的含量则可达果实干重的10%。
近年来高通量测序技术、高分辨质谱技术的迅速发展使得综合利用植物组学数据,挖掘鉴定参与天然产物合成的候选基因,阐明其完整生物合成路径成为可能。利用植物不同组织、不同发育阶段、诱激剂处理前后的物质的代谢物分析结合转录组数据进行基因表达差异分析,研究人员先后在植物体系完成参与依托泊苷糖苷(etoposide aglycone)[117]、毛 喉 素(forskolin)[8]、棉 酚(gossypol)[118]、红景天苷(salidroside)[119]、海螺碱(littorine)[120]等重要天然产物合成关键基因的鉴定。Caputi 等[121]运用基因表达网络分析结合本氏烟草功能验证体系,在长春花基因组中发现了参与长春花碱(vinblastine)生物合成的最后两个未知基因,揭示了其完整合成过程。最近Jeon等[122]利用非靶向代谢组和RNA 测序相结合的方法,在番茄中发现了法卡林二醇(falcarindiol)生物合成的基因簇,结合CRISPR 技术构建突变株证明该基因簇编码的产物能够抵御真菌和细菌病原体的入侵,加深了目前对于高度修饰的脂肪酸类化合物生物合成的理解。前期研究已发现编码某些天然产物途径的基因在基因组上成簇存在,如燕麦根皂苷(avenacin)[123]、水稻稻壳酮(momilactones)[124]、高粱蜀黍氰苷(dhurrin)[125]、罂粟诺斯卡品(noscapine)[126]等,这些发现预示了直接从基因组序列预测生物合成候选基因的可能性。2017 年魏茨曼科学研究所、瓦赫宁根大学等团队分别推出在线挖掘植物基因簇的平台PhytoClust[127]和plantiSMASH[128],使用这些工具结合越来越多已完成测序的植物基因组信息[128-153](表1),可以充分利用组学数据预测基因,加快后续鉴定过程,为植物次级代谢物合成途径的解析及其合成生物学设计提供便利。近日,Srinivasan 等[154]根据密歇根大学药用植物基因组资源数据库中的颠茄转录组数据结合托品烷类生物碱(tropane alkaloids,TAs)生物合成相关基因共表达分析策略,不仅成功解析出催化天仙子胺醛(hyoscyamine aldehyde)生成莨菪碱(hyoscyamine)的关键脱氢酶,还运用蛋白质工程区室化表达酰基转移酶和异源转运蛋白,实现了莨菪碱和东莨菪碱(scopolamine)的从头合成,充分展现出合成生物学在药用植物关键成分的合成途径解析及高效合成方面发挥的重要作用。
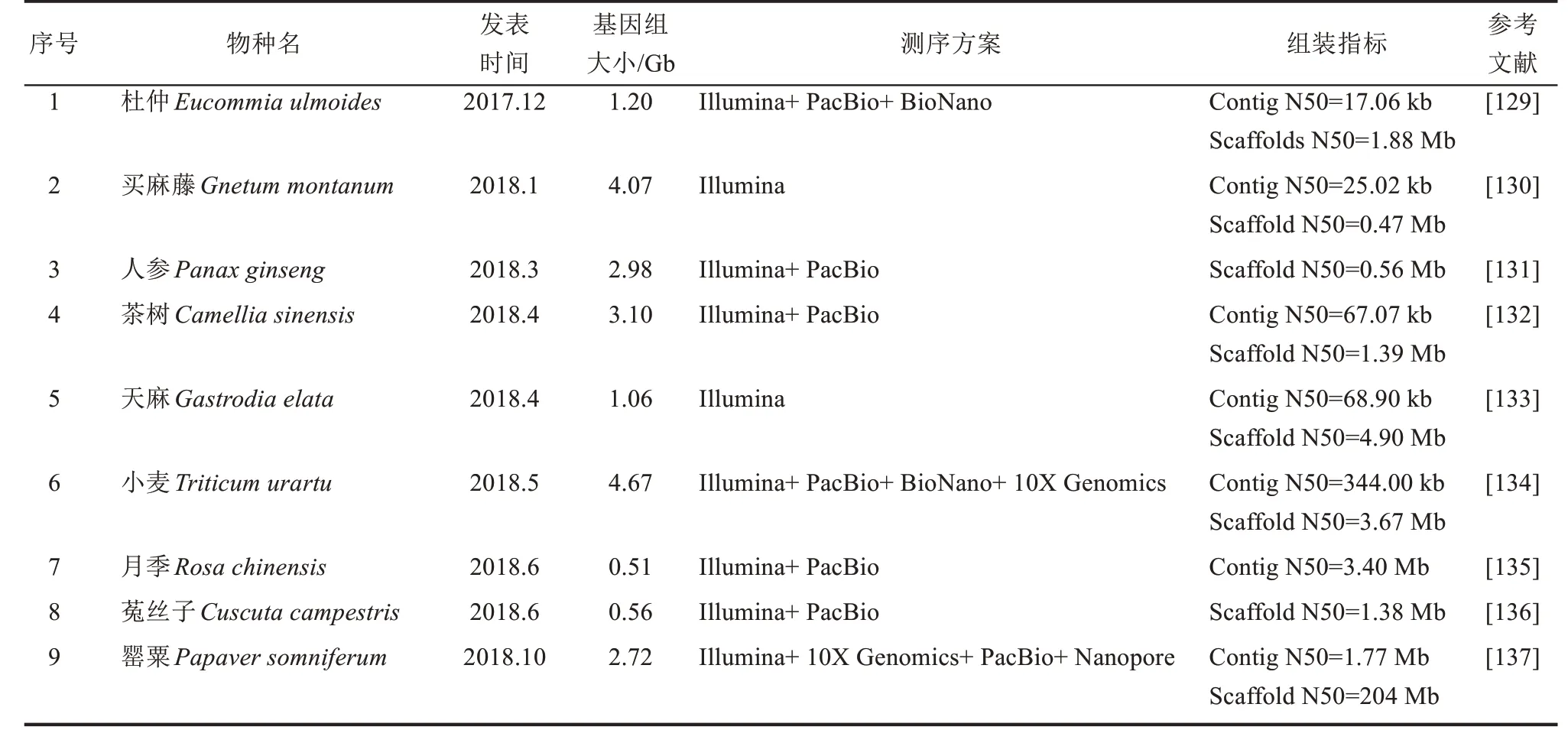
表1 近年已发表高质量植物基因组测序信息Tab.1 High-quality plant genome sequencing information published in recent years
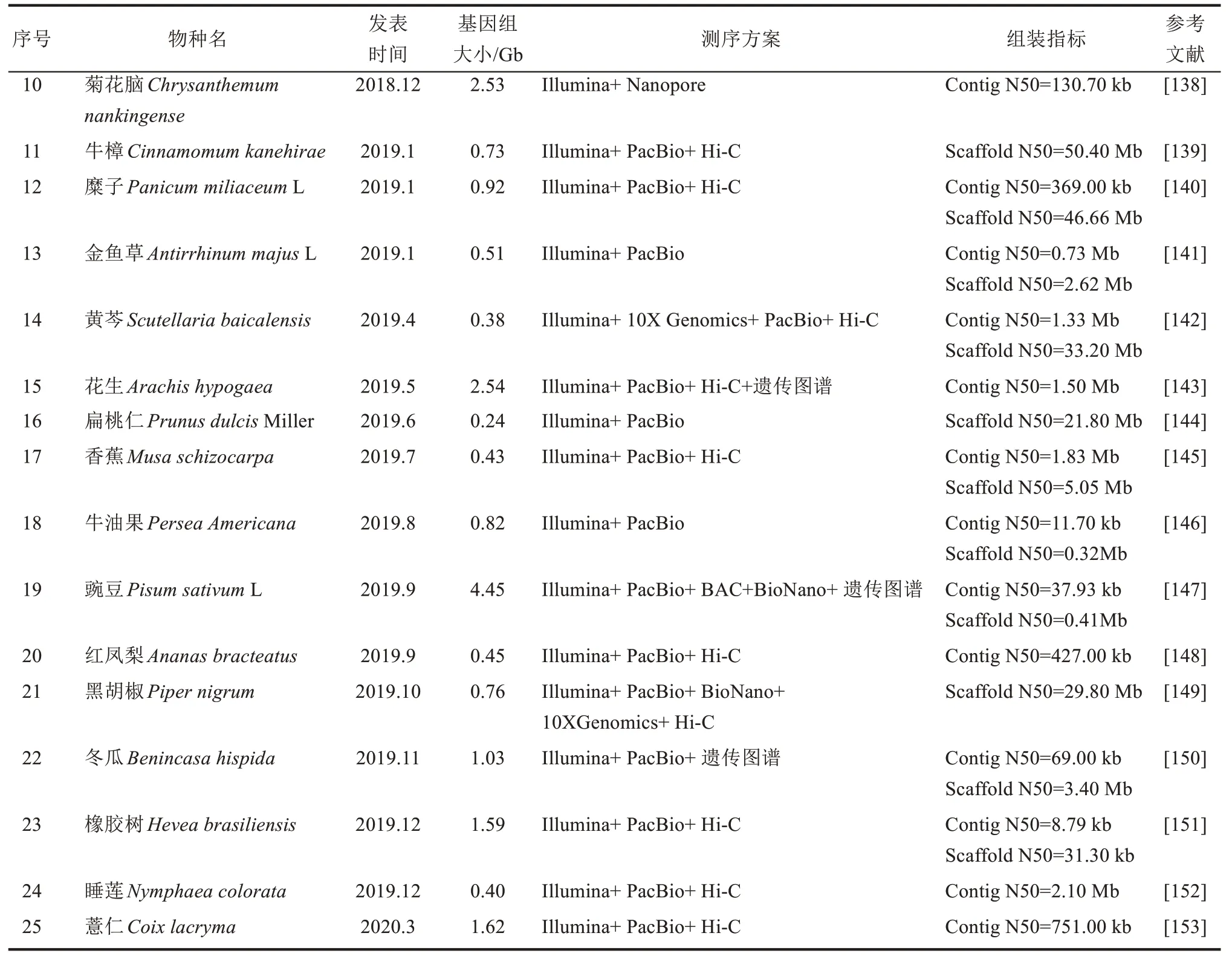
续表
由于制造成本低廉、易于大规模生产、避免制冷供应链等问题,Hiatt等[155]在30年前就提出了以植物为基础的药品生产概念,期望在农作物中生产疫苗。选择植物,而不是其他工业生产系统(如细菌、酵母、昆虫或哺乳动物细胞)生产药物,是综合考虑成本、安全性和正确翻译后修饰系统的结果。植物来源的治疗性单克隆抗体最著名的例子是ZMappTM[156],这种靶向病毒粒子表面糖蛋白的人鼠嵌合单抗,是在能降低木糖基转移酶(β1,2-xylosyltransferase,XylT)和岩藻糖基转移酶(α1,3-fucosyltransferase,FucT)活性的本氏烟草ΔXF 中产生的[157]。针对不同类型病毒的植物来源疫苗,如大米胚乳、烟草、拟南芥来源的人类免疫缺陷病毒疫苗[158-159];菠菜来源的狂犬病毒疫苗[160];浮萍、拟南芥、烟草来源的流感病毒疫苗[161-162];玉米、番茄、人参、大豆来源肝炎病毒疫苗[163-165];烟草来源的炭疽病毒疫苗[166]等,部分已处于临床试验的不同阶段[167]。此外,植物也可作为生产抗生素和天然生物活性肽的生物反应器,如水稻油粒体生产的Cecropin A[168]、胡萝卜细胞培养物合成的他利苷酶-α(taliglucerase alfa)[169]。抗疟药青蒿素在黄花蒿中含量相对较低,然而随着对该药物需求的增加,依靠原植物提取生产该药物变得越来越具有挑战性。目前青蒿素前体青蒿酸在工程化酵母中产量可超过25 g/L[170],但大规模酵母发酵的成本使其难以商业化生产。2016 年Fuentes 等[7]利用COSTREL(combinatorial supertransformation of transplastomic recipient lines)方法向烟草中引入整条青蒿酸合成途径,产量达到120 mg/kg的生物量,作者预计200平方千米的烟草田足以满足目前全球青蒿素的需求量(约100 t),有望实现商业化生产药物前体。
3.3 生物能源
现代强大的交通运输系统大多是依赖石油衍生的碳氢化合物驱动的,然而化石燃料不仅不可再生,也会导致气候变化。利用植物以可持续方式生产燃料及化学品可以逐步摆脱对石油的过度依赖,实现节能环保目的。
木质纤维生物质是自然界中最为丰富的生物质资源,能量来自于太阳,由植物通过光合作用固定贮存于植物细胞壁,主要有机成分为纤维素(38%~50%)、半纤维素(23%~32%)和木质素(12%~25%)[171]。当前纤维素和半纤维素的转化利用技术相对成熟,而木质素则主要被当作废弃物排放或者用作燃料,因此木质素是否能被高效转化,决定了生物质整体利用的经济性和可持续性[172]。Wilkerson 等在杨树中表达当归来源阿魏酰辅酶A单木香酚转移酶(ferulate feruloyl-CoA monolignol transferase,FMT)[173],引入更多对碱敏感的酯键参与木质素的生产,使得杨树在温和的碱性预处理条件下提高细胞壁消化率[174]。为了减少细胞中非必需木质素含量,Eudes 等[175]利用植物肉桂酸-4-羟基化酶(cinnamate 4-hydroxylase,C4H)启动子,靶向质体表达细菌来源莽草酸脱氢酶(3-dehydroshikimate dehydratase,QsuB),QsuB 将3-脱氢莽草酸(3-dehydroshikimate)转化为原儿茶酸(protocatechuate),降低莽草酸途径中可利用的中间体,减少木质素单体的生产,继而控制总木质素的合成。
植物合成生物学不仅能够帮助较难转化的植物生物质分解,还有可能替代化石燃料生产平台化学品。顺,顺-黏糠酸(cis,cis-muconic acid,MA)就是典型的例子,它是己内酰胺(caprolactam)、己二酸(adipic acid)、对苯二甲酸(terephthalic acid)等大宗化学品的前体,而后者又是诸如尼龙(nylon)和聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)之类塑料的前体。目前大肠杆菌、假单胞菌属和鞘氨醇单胞菌等多种微生物已能够生产MA[176],然而大规模的微生物生产需要使用廉价的碳源,减弱了生产的竞争力。而在生物质作物中生产的黏糠酸可作为附加值产品,Eudes等[177]先在拟南芥中靶向质体表达细菌来源水杨酸羟化酶(salicylate hydroxylase ,NahG)和儿茶酚1,2-双加氧酶(catechol 1,2-dioxygenase,CatA),将内源水杨酸(salicylic acid,SA)通过儿茶酚(catechol)转化为MA。接着引入细菌的水杨酸合酶(salicylate synthase,Irp9)和阻止反馈抑制的3-脱氧-D-阿拉伯-庚二酸合酶(3-deoxy-D-arabinoheptulosonate synthase,AroG)增加SA 供应,使MA效价提高50倍,展示了植物作为重要化工原料生产新平台的潜力。
4 结论与展望
受限于定量标准化的元件的缺乏、装置与系统的不兼容,目前植物合成生物学的发展仍然缓慢。尽管多种合成传感器已用于植物的内源信号通路研究,但是复杂的基因线路逻辑尚未在植物中实现。因此未来植物合成生物学的发展很大程度上决定于基础研究的突破:挖掘设计获得高性能元件、开发元件功能及强度预测方法、建立统一的标准元件库和设计平台、研发响应多种信号的生物装置,在植物中实行更复杂、更精细的合成基因线路。使能技术方面,高通量自动化的DNA 合成组装,更易操作、更精准的植物编辑方法和高效稳定的遗传转化也将加快合成生物学“设计-构建-测试-学习”的循环。
今后植物合成生物学还可为农业与食品、保健与药物、能源与废物处理等多方面提供解决方案:通过改善作物根际微生物群增强植物固氮能力,减少化肥施用;改造藻类代谢途径,高效生产生物燃料、医药制品及食品添加剂;利用植物细胞工厂生产合成蛋白、牛奶及肉类;改造作物代谢通路,去除致敏蛋白,生产低敏食物;改造植物叶片纤毛,过滤空气中粉尘,减少PM2.5颗粒,改善环境质量等。以上不难看出目前是发展植物合成生物学的一个重要契机,我国应尽快调整相关专业的设置,重视人才的培养,鼓励专业人才积极投身于科研、管理、生产等不同领域的建设。在大力发展合成生物学的同时,政府和科学家也应发挥积极的作用,一方面重视科普宣传工作,借助主题讲座、实地参观等多种形式加深大众对此的理解;另一方面考虑涉及其中的伦理道德、法律法规问题,完善对应制度以保证学科的顺利发展。

