探析高考试题中Kc、Kp、Kx的计算方法
陕西 葛秋萍 李歆瑞
《普通高等学校招生全国统一考试大纲的说明》中对化学平衡常数的考查提出了明确的要求:“了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算”。近年来的高考化学试题对这一要求的落实率为100%,Kc、Kp、Kx三类平衡常数的计算已然成为年年出现的高频考点,虽然教师和学生都知道这一点,也都把平衡常数的计算当做重点来复习,但学生对此考点的答题情况并不乐观。针对这种答题现状,笔者试图通过例题分类来阐述Kc、Kp、Kx三类平衡常数的计算方法,帮助学生形成解决此类试题的一种清晰的、可重复操作的思维模型,有效击破这三类平衡常数的计算。
一、认识平衡常数
1.Kc、Kp、Kx三种平衡常数的含义
人教版普通高中课程标准实验教科书“化学反应原理”中关于化学平衡常数的定义为“在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,简称平衡常数”。由于平衡常数是用平衡时各物质的物质的量浓度来计算的,因此又称为浓度平衡常数,用符号Kc或K表示。
研究还发现:若将上述定义中各物质的平衡浓度用平衡时各物质的分压(分压=总压×物质的量分数)来代替进行计算,也可得到一个常数,该常数称为反应的分压平衡常数,用符号Kp表示。同理,若用平衡时各物质的物质的量分数(物质的量分数=某组分的物质的量÷总物质的量)来代替上述定义中各物质的平衡浓度,得到平衡常数的一种新的表达形式,本文中我们暂且称之为反应的物质的量分数平衡常数,用Kx表示。
2.Kc、Kp、Kx三者之间的关系
我们以中学阶段常考的两种反应类型来说明三者之间的关系。

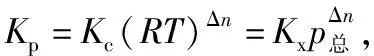

二、典型试题分析
1.浓度平衡常数(Kc)的计算


【分析】解决本题可分为以下三个步骤:
第一步:确定c(HCl)∶c(O2)=1∶1时的对应曲线。相同条件下进料浓度比c(HCl)∶c(O2)越大,HCl的转化率越低;进料浓度比c(HCl)∶c(O2)越小,HCl的转化率越高。由此可知,三条曲线中,最上面一条是c(HCl)∶c(O2)=1∶1的变化曲线。
第二步:确定HCl的平衡转化率。由图像可知:400℃,c(HCl)∶c(O2)=1∶1时,HCl的平衡转化率为84%,即0.84。
第三步:计算平衡常数。本题涉及的相关量,可用三段式法来计算。
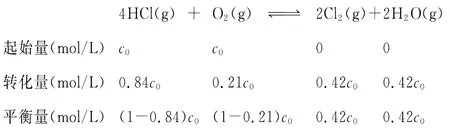
【模型建构】解决此类问题的思维模型:
第一步:确定反应条件与曲线的对应关系。根据反应特点、反应条件、物理量的变化确定反应条件与曲线的对应关系。
第二步:确定反应条件与曲线上点的对应关系。
第三步:利用三段式法求解平衡常数。依据题意,找出三段式中各物质的对应物理量,并列式进行求解。

2.分压平衡常数(Kp)的计算

【分析】本题仍用三段式法来解决,但有两种解法。
方法一:设起始加入反应物的物质的量均为1 mol,到达平衡时,I2(g)的转化量为xmol。

起始量(mol) 1 1 0 0
转化量(mol)xxx2x
平衡量(mol) 1-x1-xx2x

方法二:由阿伏加德罗定律可知:恒温恒容时,气体的压强之比=气体的物质的量之比,所以在三段式法中可以直接用气体的分压来进行相关计算。因为起始时总压为105Pa,且碘和环戊烯的物质的量相等,所以I2(g)和环戊烯的起始分压均为5×106Pa。

起始量(Pa) 5×1065×1060 0
转化量(Pa)xxx2x
平衡量(Pa) 5×106-x5×106-xx2x
解得:x=2×106
【拓展】由前面的分析可知:Kp=Kc(RT)Δn,本题能否先计算出Kc,再由此公式推导出Kp呢?
对于反应前后气体分子数变化的反应,Kc只能由各物质的平衡浓度来计算的。本题并未给出刚性容器的体积及起始时各反应物的物质的量,无法计算平衡时各物质的物质的量浓度,因此,由现有已知条件不能计算出Kc,也就无法由公式Kp=Kc(RT)Δn推导出Kp。相反,如果本题中给出刚性容器的体积及起始时各反应物的物质的量,则可先用三段式法求出Kc,再利用Kp=Kc(RT)Δn求出Kp,其中R=8.314 kPa·mol-1·K-1,这里不再赘述。
【模型建构】解决此类问题的思维模型有三种:
模型一:先用三段式法计算出平衡时各物质的物质的量,再根据分压=总压×物质的量分数,计算出各组分物质的平衡分压,最后将各物质的平衡分压代入平衡常数表达式中进行计算。
模型二:直接用分压来表示三段式中各物质的起始量、变化量和平衡量,再将各物质的平衡分压代入平衡常数表达式中进行计算。
模型三:若能用三段式法求出Kc,则可利用Kp=Kc(RT)Δn求出Kp。
3.物质的量分数平衡常数(Kx)的计算


【分析】解决本题可分为以下三个步骤:
第一步:确定348 K时的对应曲线。其他条件不变时,温度越高,反应速率越快,达到平衡的时间越短,因此图像中曲线变化的标志为先出现拐点,即“先拐,先平,数值大”。由此可知,三条曲线中,①是348 K时的变化曲线。
第二步:确定乙酸甲酯的平衡转化率。由图像可知:348 K时,乙酸甲酯的平衡转化率为64%,即0.64。
第三步:利用三段式法求解平衡常数。依据题意,找出三段式中各物质的对应物理量,并列式进行求解。
348 K时,设起始投入反应物的物质的量均为1 mol,则有:
起始量(mol) 1 1 0 0
转化量(mol) 0.64 0.64 0.64 0.64
平衡量(mol) 1-0.64 1-0.64 0.64 0.64
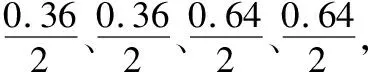
【模型构建】解决此类问题的思维模型:
第一步,确定反应条件与曲线的对应关系。根据反应特点、反应条件、物理量的变化确定反应条件与曲线的对应关系。
第二步,确定反应条件与曲线上点的对应关系。
第三步,用三段式法计算出平衡时各物质的物质的量,再根据物质的量分数=某组分的物质的量÷总物质的量,计算出平衡时各物质的物质的量分数,并将其代入平衡常数表达式中进行计算。


