“一题复习法”突破电解质溶液离子浓度比较类问题
广东 周曼文 谢正平
近年来,高考化学选择题难题多以图形图表形式呈现,如2019年全国卷Ⅰ中的11题,2017年全国卷Ⅰ中的13题,2017年全国卷Ⅱ中的12题考查知识点均是“酸碱中和滴定曲线”。该类题数形结合,情景陌生,立意独特,既是全卷的一大亮点,又是历年高考高频考查的难点。考生得分率普遍较低的原因是在传统的高三复习备考中,认知仅停留在对知识点的梳理和罗列,依赖重复而机械的习题训练提升解题能力。题海战术虽能提升学生解题的熟练程度,但这种基于知识记忆的浅层复习会造成知识的碎片化、理解的肤浅化、思路的单一化。基于此背景,从学生自身出发,笔者从酸碱滴定曲线出发,让学生在绘制曲线的过程中自觉将弱电解质的电离、混合溶液中离子浓度大小的比较、酸碱中和滴定及盐类水解等知识进行整合,串联形成知识结构网。帮助学生形成认知模型,提升学生的高阶思维,培养学生的深度学习能力。教学设计如下,仅供参考:
一、教学设计及过程
活动一——真题重现
【2019·全国卷Ⅰ·11】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
( )
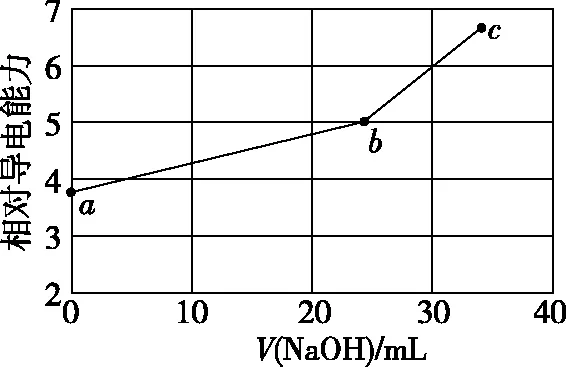
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
【答案】C
【分析】设计意图:构建电解质溶液离子浓度大小比较的认知属性及层级关系:
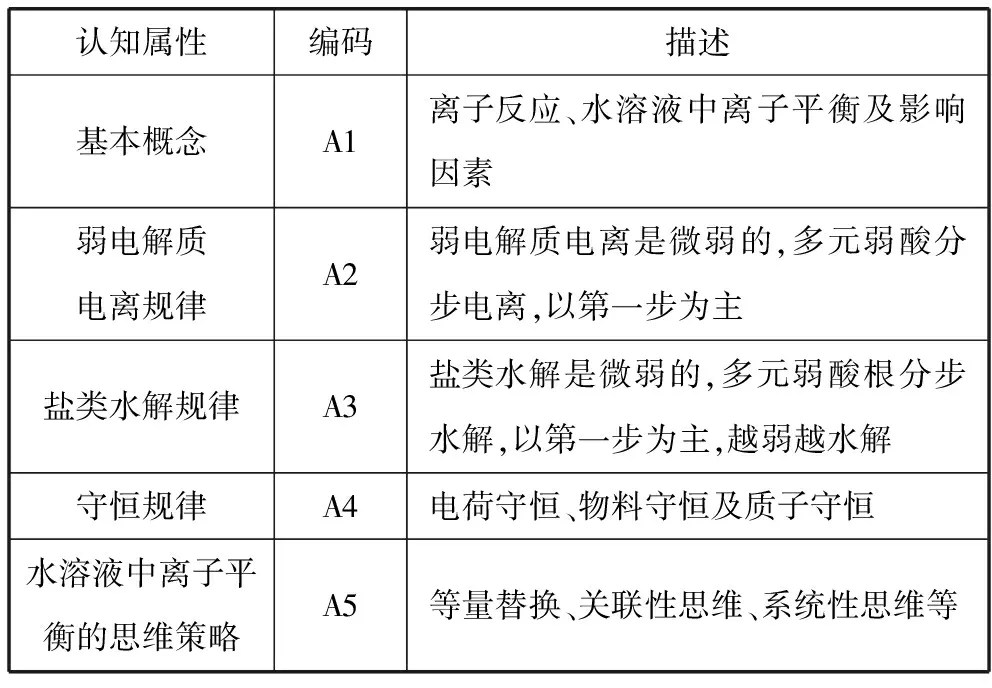
表1 电解质溶液离子浓度大小比较的认知属性
搭建学生解题的思维模型:


a点b点c点溶液中的微粒K+、HA-K+、Na+、A2-K+、Na+、A2-、OH-溶液中微粒的微观行为a点→b点过程发生:HA-+OH- A2-+H2O; HA-、A2-微弱水解,水解能力HA-
活动二:夯实基础——滴定曲线
A.0.1 mol·L-1CH3COOH溶液(pH约为3)中,离子浓度大小顺序________________。
B.同浓度CH3COOH和CH3COONa混合溶液(pH约为5)中,离子浓度大小顺序________________。
C.0.05 mol·L-1CH3COONa(pH约为9)溶液中,离子浓度大小顺序________________。
参考上述3种溶液pH(分别标记:A.B.C),绘制常温下0.1 mol·L-1NaOH溶液滴定10 mL 0.1 mol·L-1CH3COOH溶液滴定曲线。
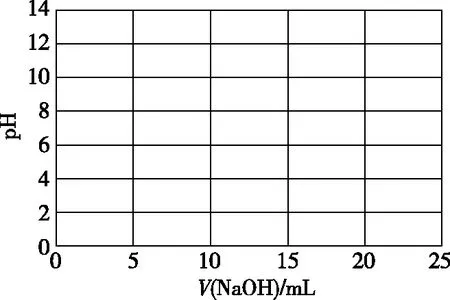
完成下列任务
1.将A.B.C点的离子浓度顺序填在该点的附近
2.在曲线上标出以下离子浓度顺序可能出现的位置(分别标记:D.E.F)
D.c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
E.c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
F.c(Na+)>c(CH3COO-)=c(OH-)>c(H+)
【设计意图】从已有的、熟悉的知识经验出发,体验酸碱中和滴定的过程,建立了数据与曲线的动态结合,进一步提炼、深化水溶液中离子浓度变化规律后,为后续的曲线变化埋下伏笔。
活动三:拓展一——分布曲线
25℃时,若Ka(CH3COOH)=10-5,在含CH3COOH和CH3COO-的溶液中,二者各自所占的物质的量分数:
绘制:0.1 mol·L-1NaOH溶液滴定10 mL 0.1 mol·L-1CH3COOH溶液过程中,随溶液pH变化的δ(CH3COOH)、δ(CH3COO-)曲线图

完成下列任务:
(1)在δ-pH曲线图中标出pH=5的点,在pH-V(NaOH)图中,找到pH=5和pH≈5的点,分析它们的位置关系。
(2)判断正误:在pH<3的溶液中,是否存在δ(CH3COOH)=1.0,δ(CH3COO-)=0。
(3)pH从3升至9的过程中,发生的化学反应是____________________________________________。
(4)在pH>9的溶液中,c(CH3COO-)+c(CH3COOH)=c(Na+)仍然成立?
【设计意图】借助中和滴定曲线的绘制与分布分数曲线的对比,学生在“制作”→讨论→再“制作”→再讨论的过程中,加深了对知识的理解和运用。变现成图像分析为自己“制作”图像,改变了问题呈现的方式,要求学生将陌生的情境转化成熟悉的问题,锻炼了学生分析问题,解决问题的能力。课堂上讨论的问题都是直接由课堂生成的,具有极高的真实性和针对性,学生的课堂积极性和参与性都得到提高。
活动四:拓展二——对数曲线


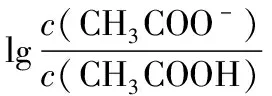

完成下列任务:
讨论为什么pH=9时才叫完全反应?
【设计意图】激发热情,再次体验,强化认知,增加信心,收获成功的喜悦。
活动五:拓展三——导电能力图
绘制:假设溶液的导电能力与离子浓度成正比(忽略其他因素的影响),绘制0.1 mol·L-1NaOH溶液滴定10 mL 0.1 mol·L-1CH3COOH溶液过程中,导电能力随溶液pH变化的图。
完成下列任务:
(1)对比2019·全国卷Ⅰ·11导电能力-V(NaOH)图,能说溶液的导电能力只与离子浓度有关吗?说说高考题图中c点导电能力趋势上翘的可能原因?
(2)模拟2019·全国卷Ⅰ·11C、D选项,你能说出哪些点的pH和离子浓度顺序?模拟2019·全国卷Ⅰ·11,即兴命制一道“离子浓度大小比较”选择题?
【设计意图】对接高考,揭露高考真题命制的神秘面纱,无形中让学生经历了从“做题”到“命题”全过程,学生收获信心的同时成就感爆棚。
二、课后体验及巩固
【练习1】室温下,向100 mL某浓度的二元弱酸H2A溶液中加入0.1 mol·L-1NaOH溶液,溶液的pH随V(NaOH)的变化曲线如图所示。下列有关说法错误的是
( )
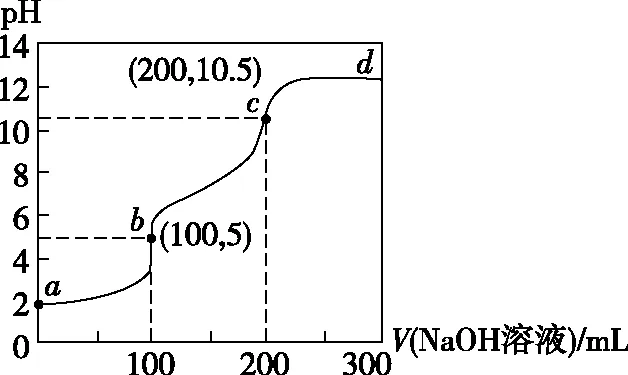
A.起始时c(H2A)=0.1 mol·L-1
B.b点时:c(H2A)>c(A2-)

D.c→d段,溶液中A2-的水解程度逐渐减弱
【答案】B
【解析】

a点b点c点溶液中的主要微粒H2ANa+、HA-Na+、A2-溶液中微粒的微观行为a点→b点过程发生:H2A+OH- HA-+H2O;b点→c点过程发生:HA-+OH- A2-+H2O;b点HA-既微弱水解,也微弱电离,电离大于水解;c点以后:OH-能抑制A2-水解。C、D选项正确结合规律判断微粒的数量关系b点H2A溶液与氢氧化钠溶液恰好完全反应生成NaHA,根据n(H2A)=n(NaOH);推知c(H2A)=0.1mol·L-1。故A选项错误b点H2A溶液与氢氧化钠溶液恰好完全反应生成NaHA,溶液pH=5,呈酸性,说明HA-既微弱水解,也微弱电离,电离大于水解;c(A2-)>c(H2A)。故B选项错误
( )
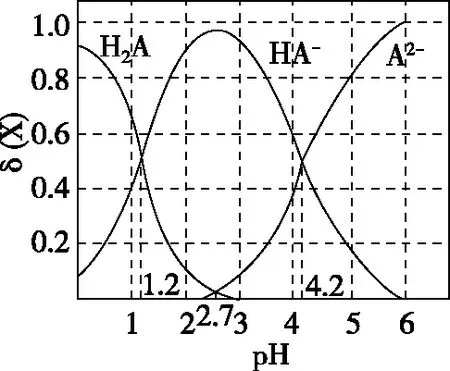
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[Ka2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
【答案】D

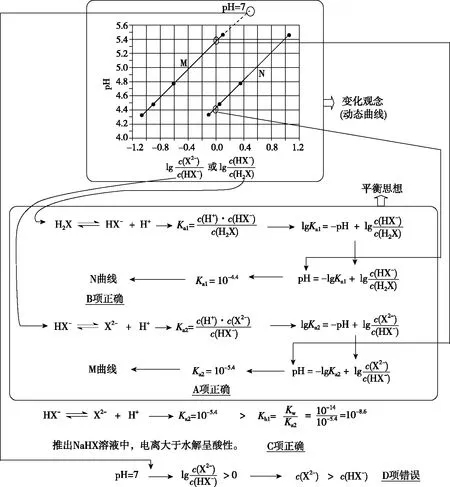
【练习3】(2017·全国卷Ⅰ·13)常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
( )
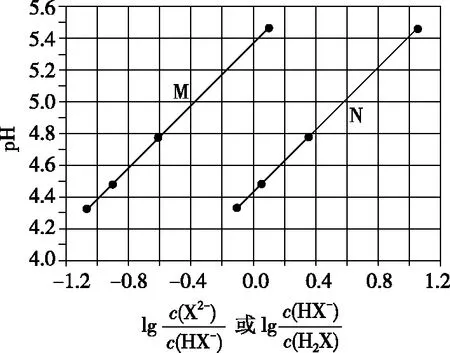
A.Ka2(H2X)的数量级为10-6
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
【答案】D
【解析】思维导图呈现考生答题思维过程
高三一轮复习课的目的是夯实学生基础,培养思维能力,形成分析和解决问题的能力,最后形成学科核心素养。这节课通过新情境的创设,改变问题的呈现方式,激发了学生的学习热情,让学生全身心投入课堂,展示自己的“制作”成果,获得了强烈的成就感和自信心。这种从学生自身出发的教学设计,不仅解决了教学中重点难点内容,达到事半功倍的效果,而且由此所带来的学习热情和思维的深广度也得到了加强,提升了学科核心素养。
如何使高三一轮复习的课堂鲜活、灵动、富有个性,实现“知识、生活和生命的深刻共鸣”,既让学生碎片知识结构化,又丰富学生的认知视角,还学会用知识解释自然现象和解决遇到的问题,使得学有所长,学有所用,达到融会贯通的复习效果,是一轮复习课非常值得研究的问题。笔者建议立足于具体的学情、考情,合理整合教材或历年高考题,选择一些切入点小、角度新、针对性强的“微型考点”为复习专题(可以是一种物质、一个化学反应、一幅工业流程图或是一道错题等),再“以真实情境为素材,以实际问题来驱动课堂”的原则来构建一轮复习课堂。如复习“水解反应”,以Fe(OH)3胶体制备实验为中心(如图)能包涵或承载多种知识与能力,在发散中提炼、升华化学知识规律的本质,能实现学生能力与素养的提升。
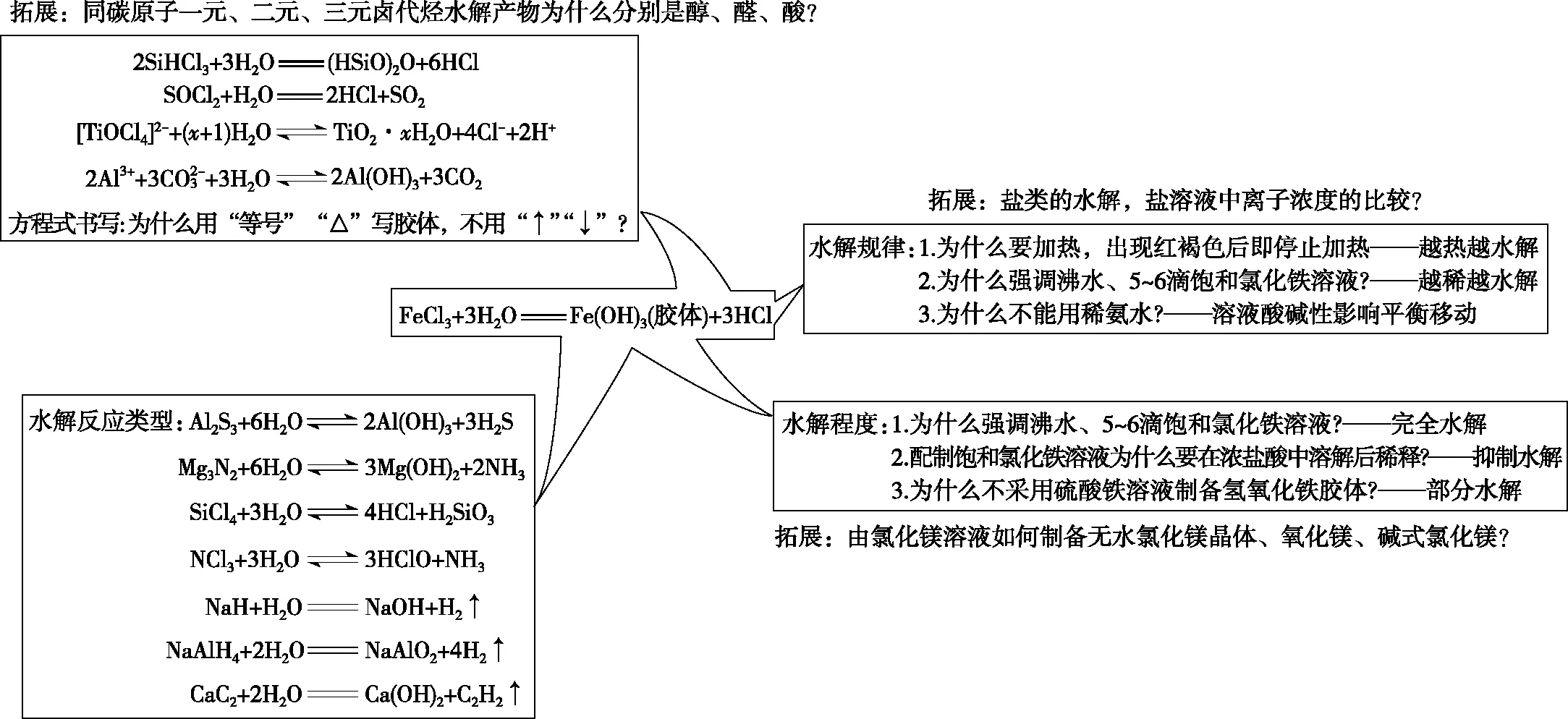
“Fe(OH)3胶体制备”承载水解反应的规律


