分析特殊点 突破“三平”图像题
江西 张万程 浙江 屠飞杰
“三平”问题即弱电解质的电离平衡、盐类水解平衡、难溶电解质的溶解平衡三部分内容,涉及“三平”问题的图像题是历来高考中的重点、难点,该类试题规律性强、区分度高,充分体现高考命题的综合性和应用性,考题渗透对变化观念与平衡思想核心素养的考查,需要考生具有较强的分析问题、解决问题的综合能力。笔者尝试从“三平”图像题的特殊点入手,突破该类试题,以期对高三师生提供一种解决此类试题的方法。
1 建立“三平”图像题的理论体系
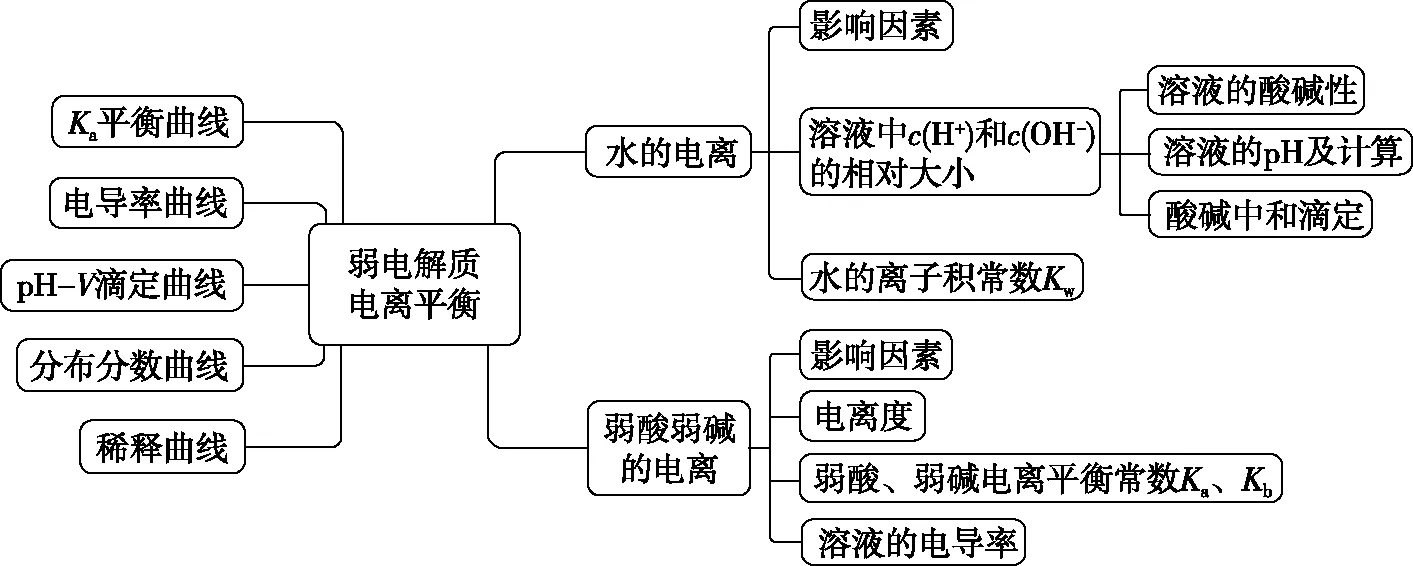
1.1 弱电解质的电离平衡
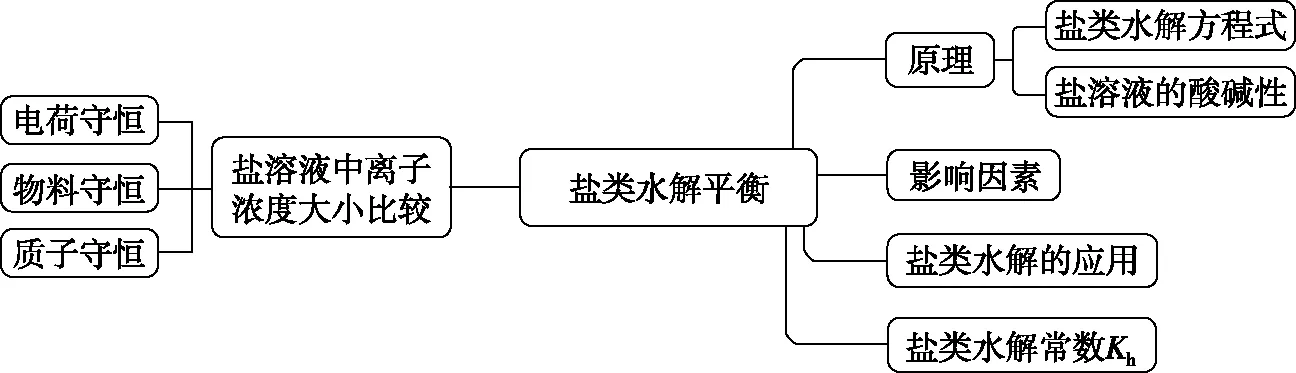
1.2 盐类水解平衡
1.3 沉淀溶解平衡

2 构建图像题分析思维模型

首先分析图像中横坐标和纵坐标所代表的物理意义,可能涉及离子浓度的对数或负对数,需仔细甄别。结合图像找出特殊点,如起点和终点、反应中点、溶液显中性的点、曲线的交点和转折点、对数或负对数(含比值)为0的点、曲线上的任意点,对这些特殊点进行详细分析,找出特殊点所含溶质,结合“三平”原理及守恒关系进行判断,理顺思路,正确得出试题答案。
3 近5年全国卷区“三平”图像题全景赏析

2020·全国卷Ⅰ·13NaOH滴定二元酸H2A的滴定曲线与分布系数δ曲线2019·全国卷Ⅰ·11NaOH溶液滴定邻苯二甲酸氢钾溶液的相对导电能力变化曲线2019·全国卷Ⅱ·12硫化镉(CdS)在水中的沉淀溶解平衡曲线2018·全国卷Ⅲ·12AgNO3滴定Cl-溶液的滴定曲线
由表可知,近年高考中“三平”类问题图像的呈现形式主要有滴定曲线、导电率曲线、分布系数曲线、沉淀溶解平衡曲线、稀释曲线等,在表现形式上,引入对数或负对数值,使曲线转变为直线图像,同时也使试题难度增大,对考生要求更高。
4 从特殊点剖析“三平”图像题
4.1 酸碱中和滴定曲线与分布分数曲线融合
【例1】(2020·全国卷Ⅰ·13)以酚酞为指示剂。用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如下图所示。
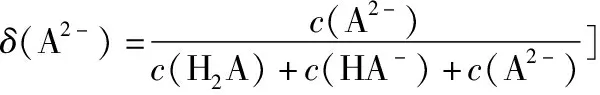
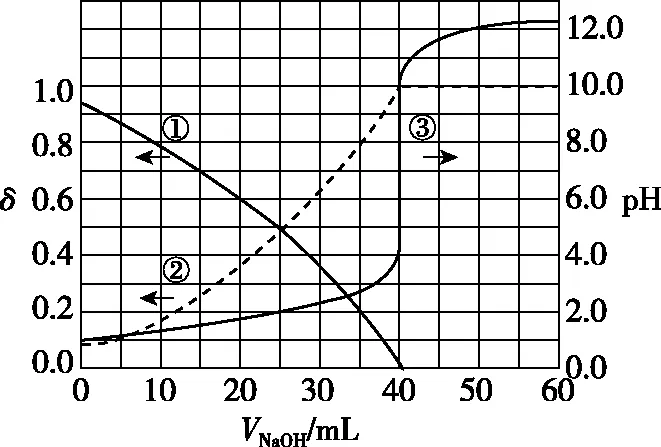
下列叙述正确的是
( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
【答案】C
【解析】对图像进行如下分析:

由图像分析可知,曲线①代表δ(HA-),曲线②代表δ(A2-),A项错误;H2A溶液的浓度为0.100 0 mol·L-1,B项错误;HA-的电离常数Ka=1.0×10-2,C项正确;滴定终点时,存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),滴定终点时,溶液中溶质Na2A能水解,使溶液显碱性,即c(OH-)>c(H+),所以c(Na+)>c(HA-)+2c(A2-),D项错误。
4.2 酸碱中和滴定对数曲线
【例2】(2017·全国卷Ⅰ·13)常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
( )
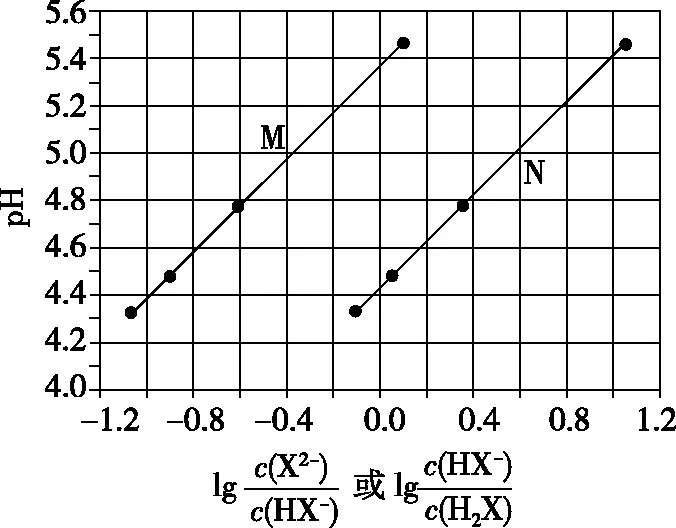
A.Ka2(H2X)的数量级为10-6
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
【答案】D
【解析】对图像进行如下分析:
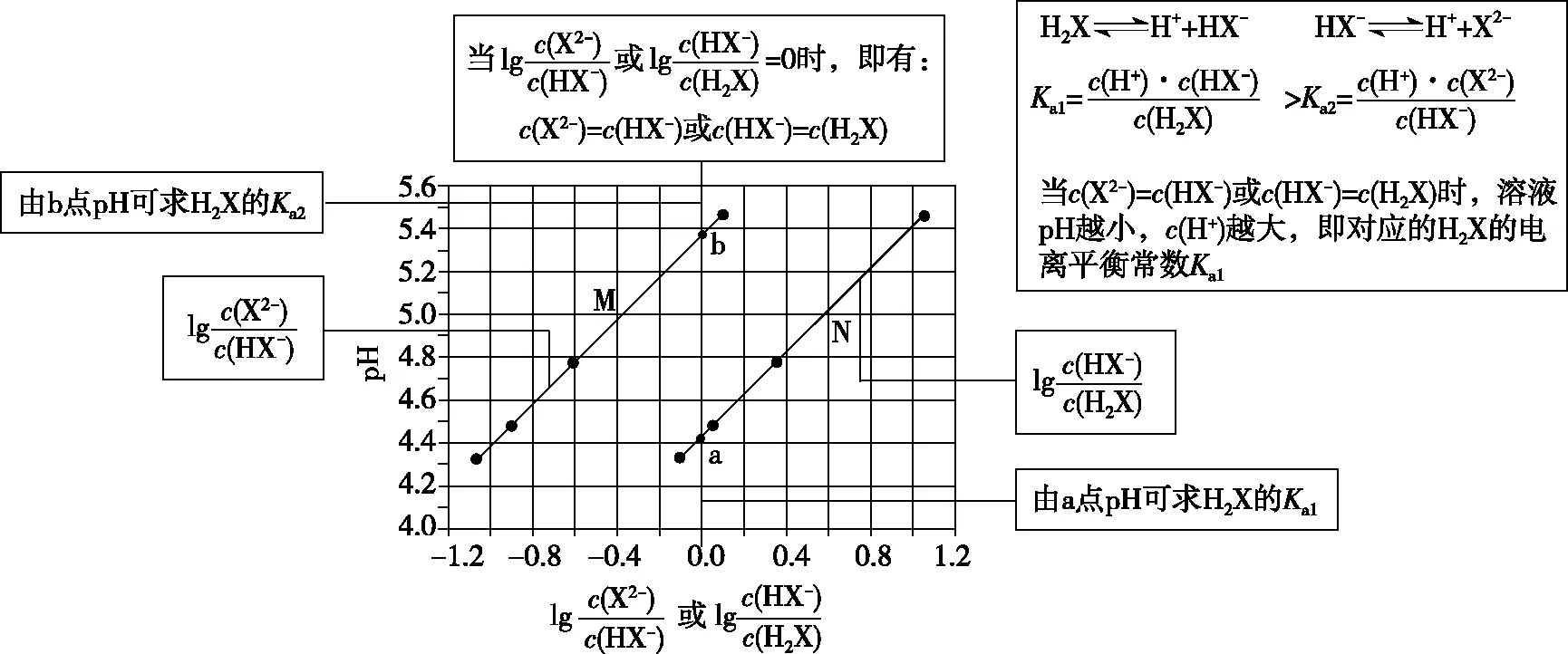
根据图像分析可知,由b点可求得H2X的电离平衡常数Ka2≈10-5.4=100.6×10-6,即Ka2(H2X)的数量级为10-6,A项、B项正确;选择曲线M进行分析,当溶液中c(Na2X)和c(NaHX)相等时,溶液显酸性,即NaHX溶液中,HX-电离大于水解,即c(H+)>c(OH-),C项正确;溶液中存在电荷守恒c(Na+)+c(H+)=c(HX-)+2c(X2-)+c(OH-),若溶液显中性,则有c(Na+)=c(HX-)+2c(X2-),由图像可知若c(HX-)>c(X2-)或c(HX-)=c(X2-)时,溶液应显酸性,则c(HX-)
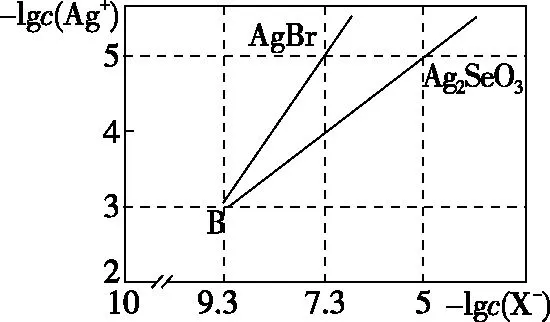
4.3 沉淀溶解平衡曲线
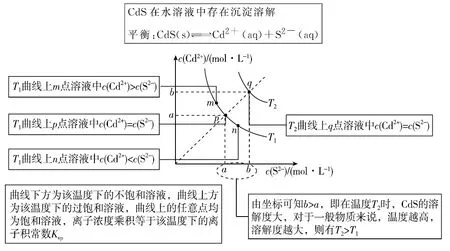
【例3】(2019·全国卷Ⅱ·12)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
( )
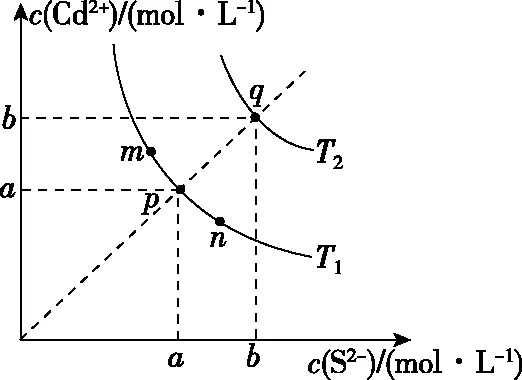
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n) C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动 【答案】B 【解析】对图像进行如下分析: 图中a和b为T1、T2温度下CdS的饱和溶液中的c(Cd2+)或c(S2-),即CdS在水中的溶解度,A项正确;温度(T1)相同时,Ksp相等,温度升高,Ksp增大,即温度T2时Ksp大于T1时Ksp,即有Ksp(m)=Ksp(n)=Ksp(p) 4.4 沉淀滴定曲线 【例4】(2018·全国卷Ⅲ·12)用0.100 mol·L-1AgNO3滴定50.0 mL 0.050 0 mol·L-1Cl-溶液的滴定曲线如图所示。下列有关描述错误的是 ( ) A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10 B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl) C.相同实验条件下,若改为0.040 0 mol·L-1Cl-,反应终点c移到a D.相同实验条件下,若改为0.050 0 mol·L-1Br-,反应终点c向b方向移动 【答案】C 【解析】对图像进行如下分析: 根据c点-lgc(Cl-)≈4.7可得,该温度下Ksp(AgCl)=c(Ag+)·c(Cl-)≈10-9.4=100.6×10-10,即数量级为10-10,A项正确;c点前,溶液中c(Cl-)>c(Ag+),c点后,溶液中c(Ag+)>c(Cl-),但曲线上的任意点c(Ag+)·c(Cl-)均为Ksp(AgCl),B项正确;相同实验条件下,若改为0.040 0 mol·L-1Cl-,恰好完全反应时所消耗V(AgNO3)应为20 mL,反应终点不是在a点,C项错误;若改为0.050 0 mol·L-1Br-,由于Ksp(AgBr) 4.5 曲线大观 【例5】常温下,下列有关电解质溶液中相关曲线的说法正确的是 ( ) 图1 图2 图3 图4 A.用0.100 0 mol·L-1NaOH溶液滴定10.00 mL浓度为0.100 0 mol·L-1CH3COOH溶液过程中的电导率与NaOH溶液的体积关系如图1所示,则A、B、C三点水的电离程度:C>B>A 【答案】B 【解析】对4个图像进行以下分析: 图1 图2 图3 图4 图1:水的电离程度:A>B>C 图2:pH:NaClO2>NaMnO4