多光子吸收、线粒体靶向锌/铕配合物的设计合成
李明昊,李小成,刘丹丹,张 琼,吴杰颖,田玉鹏
(安徽大学 化学化工学院,安徽 合肥 230601)
applications
多光子吸收是一种非线性光学(NLO)过程.在这种过程中,多个光子被同时吸收,以达到激发态,然后在一定条件下回落到基态[1].近20年来,多光子吸收材料已广泛应用于生物成像、光动力学治疗、上转换激光、三维光学数据存储和光学极限等领域[2-4].在生物成像应用领域,与大多数常见的单光子荧光探针相比,具有较大斯托克斯位移的多光子荧光探针具有很大的优势[5],因为在近红外第二窗口中可以使用1 000~1 700 nm的激发波长,这在生物成像中提供了更高的空间分辨率和对比度,以及较高的光物理稳定性和较低的组织损伤[6].
线粒体(mitochondrion)是细胞的“能量工厂”,它是由两层膜包裹的细胞器,是细胞有氧呼吸的重要场所.线粒体除了为细胞供能外,还参与细胞的新陈代谢,拥有调控细胞周期和细胞生长的能力[7-8].所以通过对细胞线粒体状态的检测,可以准确对机体进行疾病诊断和治疗[9-11],探索高效低毒性的线粒体荧光探针得到了研究者的关注[12-15].目前研究的线粒体探针主要是小分子荧光探针,并且多是单光子荧光探针,这类探针与上述多光子探针的特点相比,存在一定的局限性.因此,开发一种亲生物、光稳定性好且长波段激发的多光子荧光探针尤为必要.
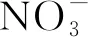
1 实验部分
1.1 试 剂
N,N-二甲基甲酰胺,N, N-二丁基苯胺,三氯氧磷,2-乙酰基吡啶,氢氧化钾,氨水,六水合硝酸锌,α-噻吩甲酰基三氟丙酮,二氯甲烷,四氢呋喃,乙腈,二甲基亚砜,以上试剂均为分析纯,使用前按标准方法纯化.
1.2 仪 器
1H-NMR和13C-NMR分别在Bruker Avance 400 MHz和100 MHz核磁共振光谱仪上记录;质谱数据使用Micro-mass GCT-MS记录(ESI源);紫外可见吸收光谱使用SPECORD S600分光光度计测定;单光子发射荧光光谱(SPEF)使用日立F-7000荧光分光光度计进行;双光子荧光光谱(2PEF)使用飞秒激光脉冲钛宝石系统测定 (Chameleon Ultra II, 680~1 080 nm, 80 MHz, 140 fs) (荧光素作为参比溶液);三光子吸收光谱(3PA)使用飞秒激光脉冲钛宝石光学参量振荡器系统测定(Chameleon Compact OPO, 1 100~1 600 nm, 140 fs);Hela细胞的激光共聚焦显微成像使用Zeiss LSM 710 META正置共聚焦激光扫描显微镜获得;图像数据的采集和处理使用Zeiss LSM Image Browser,Zeiss LSM Image Export和Image J.
1.3 MTT
细胞毒性运用MTT的方法进行检测.将人宫颈癌细胞(HeLa)种于96孔板中,每个孔种5×103个细胞,待细胞贴壁后,设置2个一样的实验组.使用DMSO溶解配合物配置成浓度为1×10-3mol·L-1的母液,测试时用DMEM∶DMSO=99∶1比例稀释成1×10-5mol·L-1,分别加入5,10,15,20 μL的体积梯度,每组设置6个平行,每孔加培养基至100 μL,空白组中加入纯培养基做对照,加样后置于37 ℃,5% CO2培养箱中培养 18 h 后,将其中一组置于紫外灯下进行光照,30 s一次,共照5 min,再置于培养箱继续培养4 h,然后用 MTT 比色法进行检测.
1.4 细胞培养
将人宫颈癌细胞(HeLa)放置于含有10%的胎牛血清的DMEM 培养基中,置于37 ℃、5%CO2的培养箱中培养.当细胞培养增殖至大约铺满培养瓶底部时,去除老旧的培养基,加入2 mL已经预热至37 ℃的PBS溶液对细胞进行清洗,加入1 mL 0.25% 胰蛋白酶溶液浸润细胞,离心去除胰酶,置于37 ℃下消化50 s,置于光学显微镜下观察细胞的形态变化..最后加入2 mL DMEM 培养液,轻轻吹打细胞使得其落壁形成单细胞悬液,分成多份并加入 DMEM 培养基继续培养细胞.
1.5 细胞显影
将HeLa细胞以每孔5×104个细胞的密度接种在培养皿中,24 h后加入待测化合物,化合物最终浓度为1×10-5mol·L-1.在37 ℃、5%CO2培养箱中共培养6 h. 随后吸除培养基溶液后用PBS洗涤3遍,用共聚焦显微镜观察细胞显影效果.
1.6 化合物的合成步骤及表征
化合物合成路线如图1 所示.
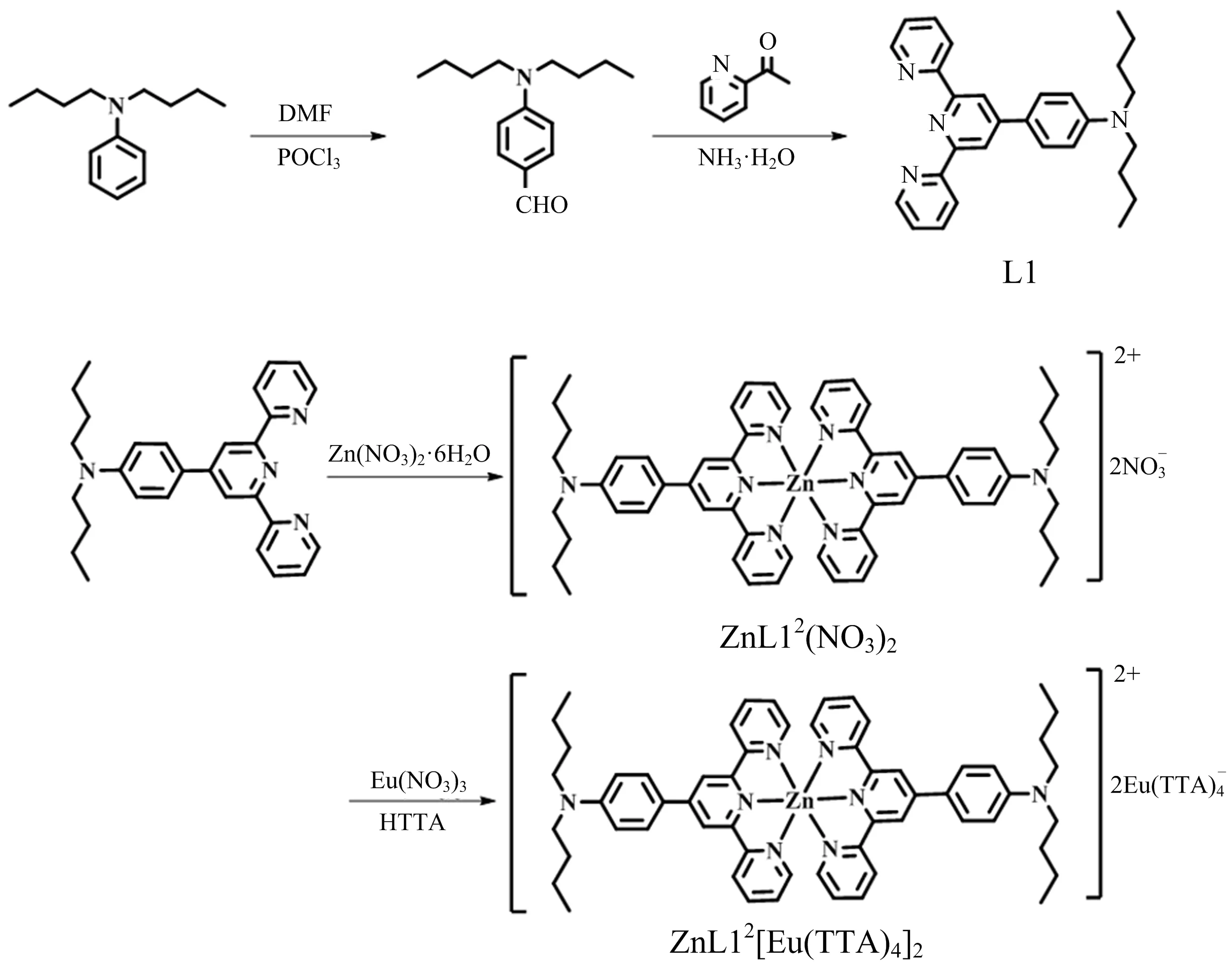
图1 化合物的合成路线
具体合成步骤如下:
N,N-二丁胺基苯甲醛的合成:在100 mL圆底烧瓶中加入二甲基甲酰胺7.30 g (2 mmol),搅拌,溶解后置于冰水浴中,在搅拌下用恒压滴液漏斗缓慢滴加三氯氧磷11 mL (1.5 mmol),形成冻盐.用氯仿溶解N, N-二丁基苯胺10.30 g (1 mmol),再滴加到上述冻盐中,待滴加完毕,转移至油浴,回流4 h.反应结束后,将反应液倒入冰水中,先用氢氧化钾溶液调溶液的pH,使溶液pH在7左右.二氯甲烷萃取多次,蒸干溶剂.将粗产物过硅胶剂柱层析,用石油醚做展开剂淋洗,第一组分即为所需产物,产物呈浅黄色油状.MS (ESI-MS): calc: 233.36, found: 233.12 [M].
L1的合成:称取 N,N-二丁胺基苯甲醛2.30 g (1 mmol)溶于100 mL的乙醇中, 搅拌下分批加入2-乙酰基吡啶3.10 g (2.5 mmol)、氢氧化钾2.30 g( 4 mmol), 常温下搅拌30 min,分批加入40 mL氨水,搅拌10 min,然后升温至78 ℃, 反应6 h,冷却、过滤并用乙醇重结晶得亮黄色固体3.00 g,产率68%.1H-NMR (400 MHz, d6-acetone, ppm) δ 8.76 (dd,J=62.4, 45.6 Hz, 4H), 8.08-7.90 (m, 2H), 7.44 (t,J=25.5 Hz, 4H), 7.27 (t,J=16.5 Hz, 1H), 7.17—6.94 (m, 1H), 6.69 (t,J=19.6 Hz, 2H), 3.47—3.23 (m, 4H), 1.58 (t,J=18.5 Hz, 4H), 1.38 (dt,J=27.3, 13.6 Hz, 4H), 1.13—0.80 (m, 6H).13C-NMR (100 MHz, d6-acetone, ppm)δ154.19, 151.80, 148.26, 139.25, 128.79, 124.05, 119.73, 111.53, 53.49, 30.07, 21.77, 13.79. MS (ESI-MS): calc: 436.60, found: 437.27 [M]+H+.
ZnL12(NO3)2的合成: 称取配体L1 0.22 g(2 mmol)和六水合硝酸锌0.082 g (1.1 mmol)溶于甲醇溶液中,加热回流3 h,停止反应,冷却至室温,逐渐有红色粉末析出.甲醇重结晶,得红色固体0.34 g,产率64 %.1H-NMR (400 MHz, d6-acetone, ppm) δ 8.72 (dd,J=32.0, 24.4 Hz, 12H), 8.03-7.88 (m, 4H), 7.82 (d,J=8.3 Hz, 4H), 7.42 (d,J=25.6 Hz, 4H), 6.89 (d,J=8.4 Hz, 4H), 3.43 (t,J=7.4 Hz, 8H), 1.75-1.59 (m, 8H), 1.42 (dd,J=14.7, 7.3 Hz, 8H), 1.08—0.88 (m, 12H).13C-NMR (100 MHz, d6-acetone, ppm)157.21, 151.51, 149.80, 144.90, 136.76, 130.81, 128.55, 125.18, 124.05, 118.47, 112.48, 110.00, 53.72, 30.05, 20.15, 13.56. MS (ESI-MS): calc: 468.23, found: 468.22 [M]+.
ZnL12Eu(TTA)42的合成: 称取配体L1 0.22 g (2 mmol ) 加热溶于10 mL甲醇中,然后向其加入溶有六水合硝酸锌0.082 g (1.1 mmol)的甲醇溶液30 mL,加热回流约3 h,然后将溶有HEu(TTA)4配合物的甲醇溶液滴加上述溶液中,回流3 h,蒸出甲醇,冷却,得到黄色固体0.81 g,产率53%.ESI-MS m/z in positive ion mode: 468.23, found: 468.22[M]+.
2 结果与讨论
2.1 吸收光谱和单光子荧光性质
化合物(L1, ZnL12(NO3)2, ZnL12[Eu(TTA)4]2)在DMSO中的紫外-可见吸收光谱和荧光发射光谱如图2所示.配合物在DMSO中的光谱学数据列于表1.
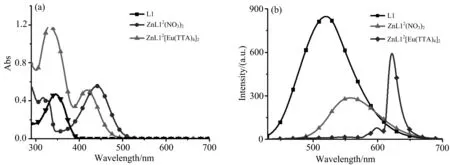
图2 化合物(L1, ZnL12(NO3)2, ZnL12[Eu(TTA)4]2)在DMSO中的紫外-可见吸收光谱(a)和荧光发射光谱(b)(化合物浓度:1.0×10-5 mol·L-1)
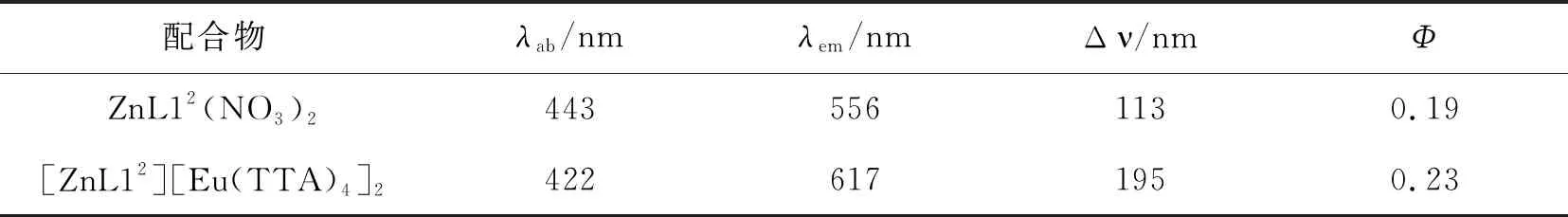
表1 配合物在DMSO中的光谱学数据
量子产率(配合物浓度:1.0×10-6mol·L-1).
由图2和表1可知,L1、ZnL12(NO3)2和ZnL12[Eu(TTA)4]2的紫外-可见吸收光谱均位于300~520 nm范围内,L1在350 nm附近的吸收峰可归属于整个分子内电荷转移(ICT);ZnL12(NO3)2的吸收峰位置在443 nm处,可归属于金属到配体的电荷转移(MLCT);ZnL12[Eu(TTA)4]2不仅在340 nm周围表现出H[Eu(TTA)4]的吸收峰,在420 nm 左右表现出金属到配体的电荷转移(MLCT)的吸收峰,说明[Eu(TTA)4]-影响了Zn(II)到三联吡啶配体的电荷转移[16].
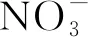
2.2 非线性光学性质
为证明ZnL12(NO3)2和ZnL12[Eu(TTA)4]2的多光子吸收效应,分别用荧光对比法和Z-扫描方法测试其多光子吸收性质,并计算配合物的多光子吸收截面.
2.2.1 双光子吸收性质
配合物(ZnL12(NO3)2, ZnL12[Eu(TTA)4]2)的双光子荧光光谱如图3所示.
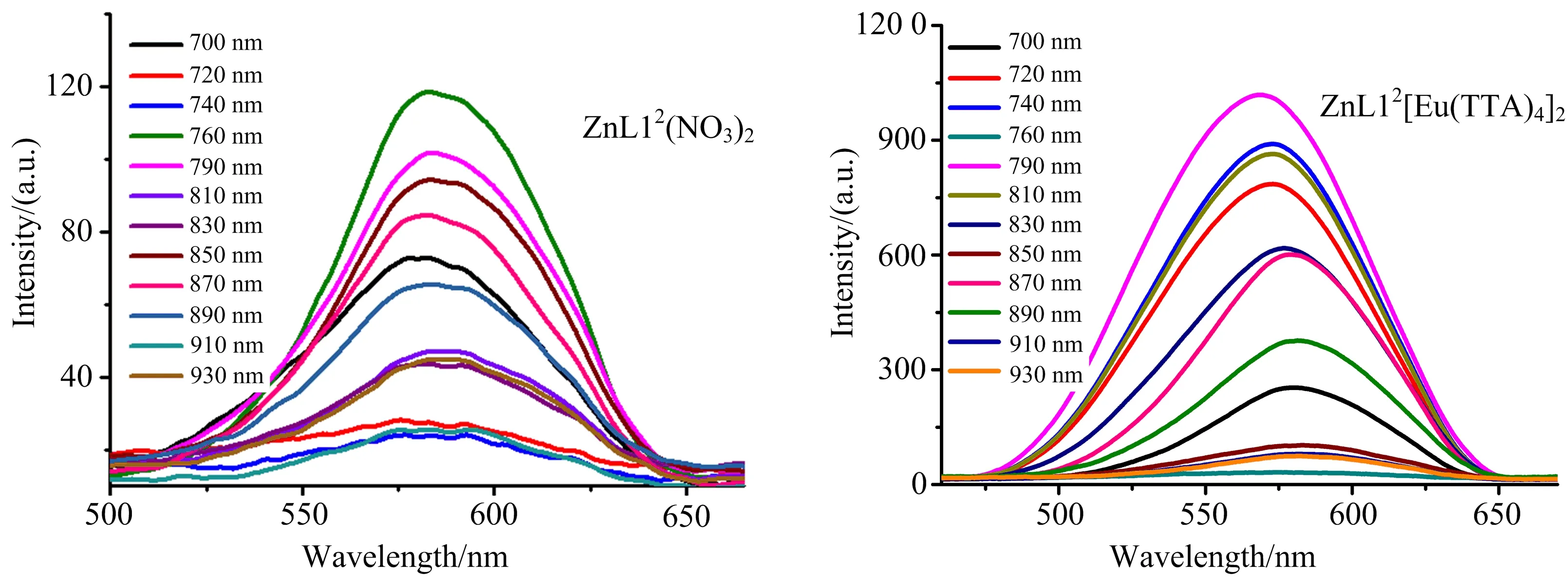
图3 配合物(ZnL12(NO3)2, ZnL12[Eu(TTA)4]2)在700~930 nm波长下的双光子荧光光谱(配合物浓度:1.0 × 10-3 mol·L-1)
如图3所示,ZnL12(NO3)2在700~930 nm激发波长下的双光子荧光发射峰位置为578 nm,同单光子荧光发射峰(557 nm)相比发生了约20 nm红移,这是由于高浓度分子运动造成的能量损失所致.而ZnL12[Eu(TTA)4]2的双光子发射峰位置相对于单光子荧光发射峰发生了蓝移,可能由于长波长激发下没有激发出Eu的特征发射峰,或者是Eu的发射峰较弱,被三联吡啶合锌配离子的发射峰所覆盖.通过荧光对比法计算出其最大吸收截面分别为161 GM和388 GM,如图4所示,数据列于表2中.由于[Eu(TTA)4]-阴离子影响金属锌到三联吡啶环的电荷转移,非辐射跃迁降低,双光子吸收截面增大.
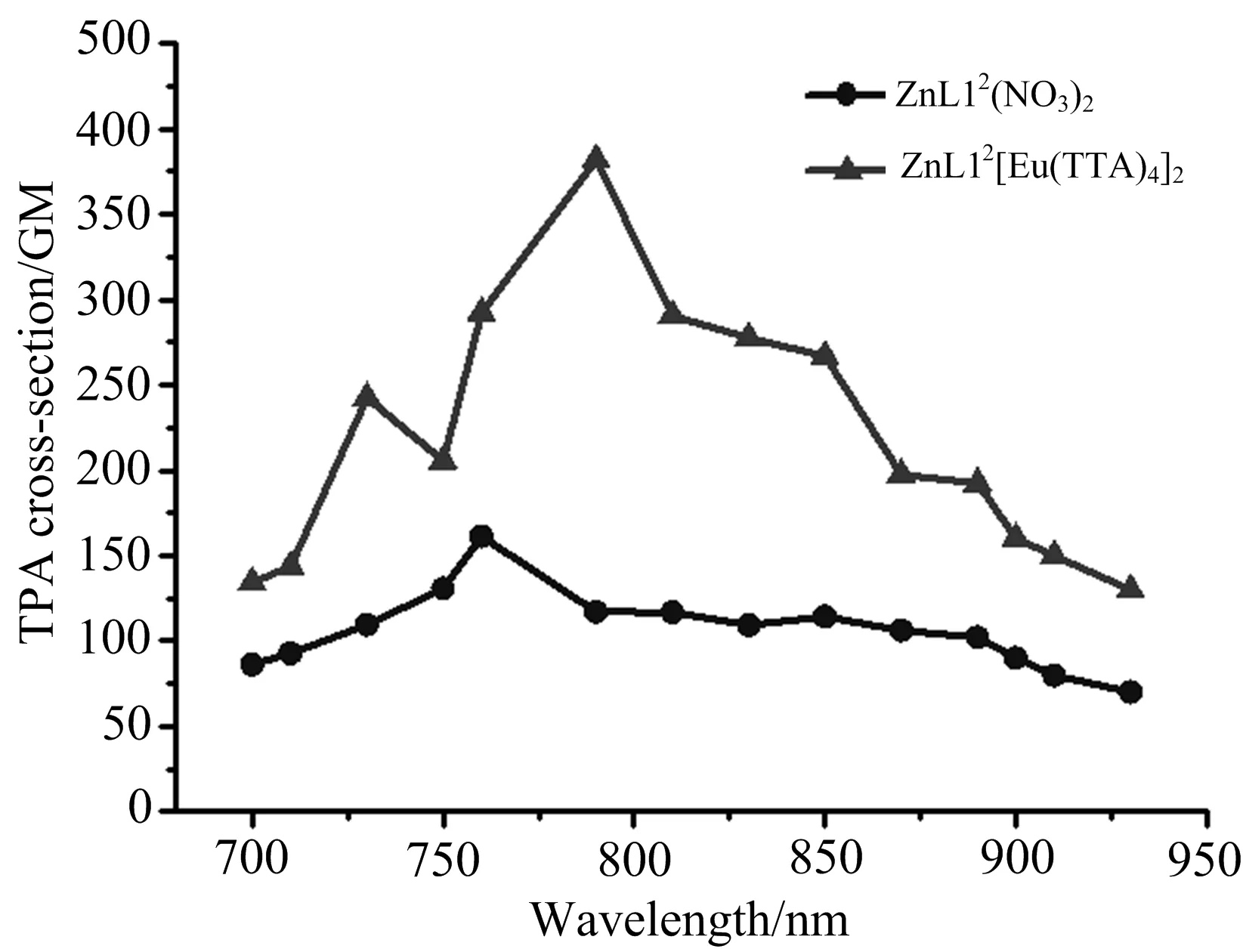
图4 配合物(ZnL12(NO3)2, ZnL12[Eu(TTA)4]2)在DMSO溶液中,700~930 nm激发波长下的双光子吸收截面(配合物浓度:1.0×10-3 mol·L-1)
2.2.2 三光子吸收性质
为了深入探究ZnL12(NO3)2和ZnL12[Eu(TTA)4]2的三光子吸收性能,在激发波长为1 340 nm的条件下通过开孔Z-扫描技术测量化合物的三光子吸收性质,如图5所示.利用Z-扫描测试下的三光子截面计算公式[18]
其中:I0是光功率密度,I是入射光强,L是样品池厚度,γ是三光子吸收系数,d0是样品浓度,λ是波长,h是普朗克常数(6.626×10-34J·s),NA是阿伏伽德罗常数(6.022×1023mol-1).计算得到ZnL12(NO3)2和ZnL12[Eu(TTA)4]2的三光子吸收截面的值分别为4.99×10-82cm6·s2·photon-2和8.11×10-82cm6·s2·photon-2,三光子吸收系数分别为1.44×10-28cm3·W-2和2.60×10-28cm3·W-2,详细数据列于表2.这些结果表明ZnL12(NO3)2和ZnL12[Eu(TTA)4]2配合物在近红外区都具有良好的双光子/三光子吸收性质,为它们在多光子生物探针方面的研究奠定了基础.
图5 配合物(ZnL12(NO3)2, ZnL12[Eu(TTA)4]2)在DMSO溶液中,1 340 nm激发波长下的开孔Z-扫描(配合物浓度:1.0×10-3 mol·L-1)

表2 配合物在DMSO溶液中的多光子吸收性质数据
三光子有效吸收截面,配合物浓度为1.0×10-3mol·L-1.
2.3 生物学应用
基于以上对ZnL12(NO3)2和ZnL12[Eu(TTA)4]2光物理性质的研究,它们在近红外区有较大的双光子、三光子吸收截面,笔者进一步探索它们在生物学上的应用.在探究生物学测试前,用MTT比色法对配合物的细胞毒性进行了检测,如图6所示,当加入配合物的体积达到20 μL时,Hela细胞存活率达到84%,结果表明配合物的毒性很低,有利于共聚焦生物显影.
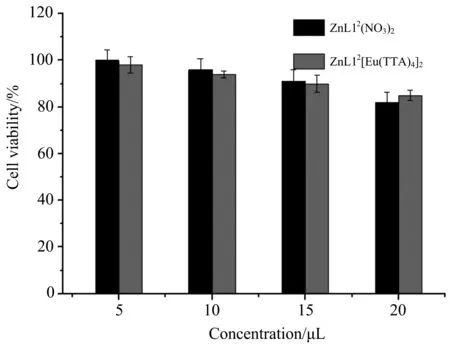
图6 配合物(ZnL12(NO3)2, ZnL12[Eu(TTA)4]2)在 Hela 细胞中的生物毒性(溶剂DMEM∶DMSO=99∶1,配合物浓度为1×10-5 mol·L-1)
为了观察配合物在细胞中的分布情况,取配合物溶液10 μL加入Hela细胞培养皿作用30 min后,进行双光子共聚焦显微成像.如图7所示,配合物穿过细胞膜,着色丝状线粒体,并在线粒体区域发出很强的荧光.为了进一步确定其靶向性,用Mito trackerTM(商业染料,特异性识别线粒体)进行了共定位实验.共定位实验显示,配合物ZnL12(NO3)2和ZnL12[Eu(TTA)4]2的细胞靶向与Mito tracker高度重合,这可能是因为配合物的阳离子部分与负电位的线粒体相结合.因此ZnL12(NO3)2和ZnL12[Eu(TTA)4]2可作为一种线粒体双光子荧光探针.
3 结束语
笔者合成了ZnL12(NO3)2和ZnL12[Eu(TTA)4]2,系统研究了它们的光学性质,阐明阴离子对光学性质的影响.利用荧光对比法测试了它们的双光子吸收性质,Z-扫描技术测试了它们的三光子吸收性质,发现它们在近红外区有较大的多光子吸收截面.生物学测试表明,它们都具有低毒性和良好的生物相容性,在较短时间内进入细胞靶向丝状线粒体,发出很强的荧光,可用作线粒体的双光子荧光探针.该文的研究结果为细胞靶向的多光子荧光探针合理设计提供了新思路.

