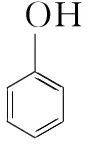
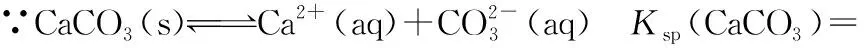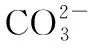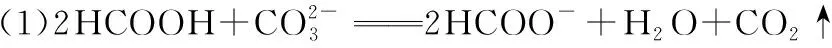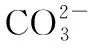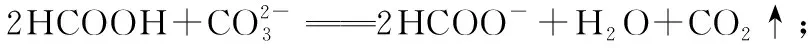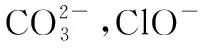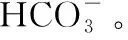多角度透视 认清离子反应本质
云南 沈艳华
一、问题的提出
(2019·全国卷Ⅲ·12)下列实验不能达到目的的是
( )
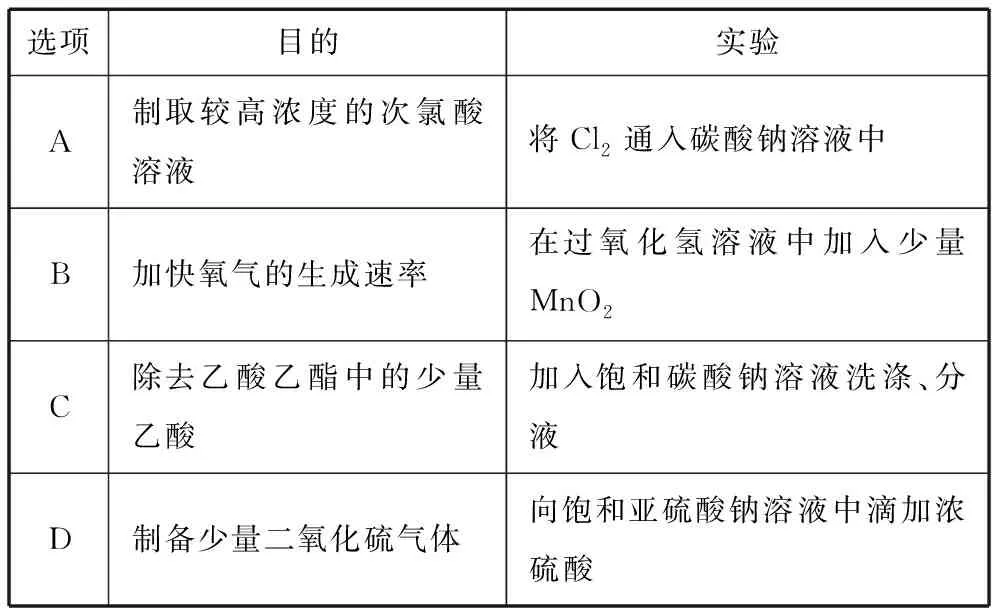
选项目的实验A制取较高浓度的次氯酸溶液将Cl2通入碳酸钠溶液中B加快氧气的生成速率在过氧化氢溶液中加入少量MnO2C除去乙酸乙酯中的少量乙酸加入饱和碳酸钠溶液洗涤、分液D制备少量二氧化硫气体向饱和亚硫酸钠溶液中滴加浓硫酸
选项A需要判断:将Cl2通入碳酸钠溶液中,是否能制取较高浓度的次氯酸溶液。
我们知道,氯气通入水中主要存在两个平衡:



既然体系中存在着“用量”与“酸性强弱”两个影响因素,那么,要回答这个问题就要把这两个因素都考虑进去。
二、理论分析
由弱酸的电离平衡常数表可知:Ka1(H2CO3)=4.4×10-7;Ka2(H2CO3)=4.7×10-11;Ka(HClO)=3.0×10-8


起始浓度(mol·L-1):0.09 0 0 0
转化浓度(mol·L-1):0.03 0.03 0.03 0.03
平衡浓度(mol·L-1):0.06 0.03 0.03 0.03
故:饱和氯水中c(H+)=c(HClO)=0.03 mol·L-1
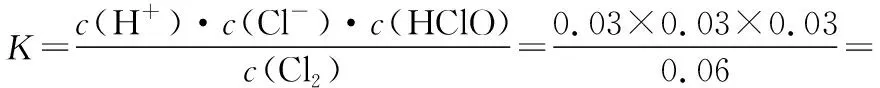
从酸性强弱分析,由于Ka(HCl)>Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3),故过量HCl能与Na2CO3反应生成NaCl、CO2和H2O;过量HClO能与Na2CO3反应生成NaClO和NaHCO3而不能生成NaClO、CO2和H2O。
因此,将Cl2通入碳酸钠溶液中:
(1)氯气不足,HCl、HClO电离出的H+均参与反应,将发生:

①
②
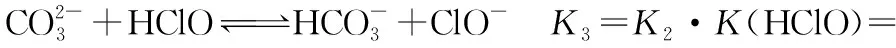
③
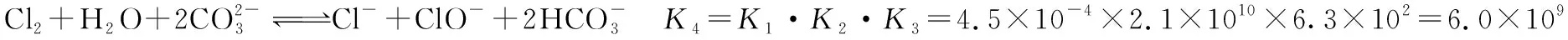
④
一般来说,如果一个反应的平衡常数大于1×105,可认为该反应进行得较完全;如果一个反应的平衡常数小于1×10-5,则认为该反应很难进行。而今K4>1×105,故此反应趋于完全。
(2)氯气过量,产物HCl电离出的H+也过量,仅发生:

①
②
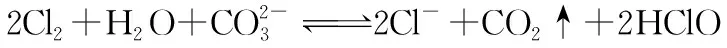
③
此反应也趋于完全。也就是说,将少量Cl2通入碳酸钠溶液中,不能制取较高浓度的次氯酸溶液。即便氯气过量形成饱和氯水,但由于饱和氯水中c(HClO)很小,仅为0.03 mol·L-1,也无法形成较高浓度的次氯酸溶液(次氯酸浓溶液的物质的量浓度可大于9 mol·L-1)。故2019年全国卷Ⅲ选择题第12题A选项不能达到目的,是本题的答案。
选出试题的答案也可以用排除法,这似乎并不难,但却给我们提出了一个问题:是不是所有的碳酸盐都不能增加氯水的漂白性呢?
我们再引入另一个体系——沉淀溶解平衡,以加入难溶物CaCO3为例进行分析:
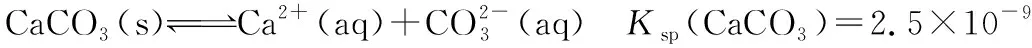
①
②
③

④

⑤
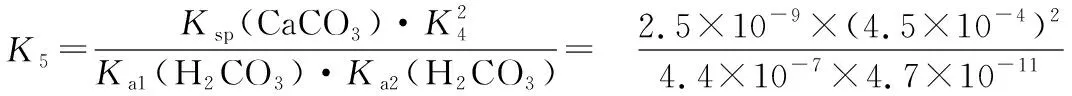
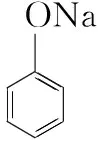
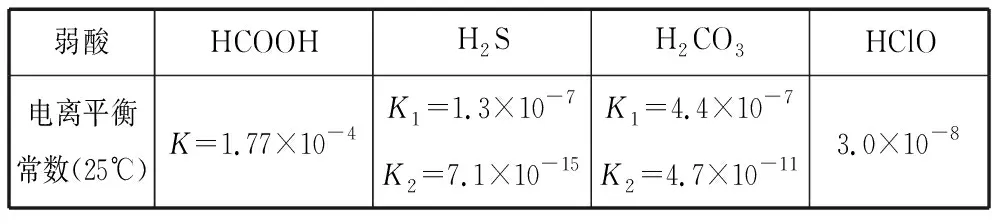
1×10-5 同样是氯水中加入碳酸盐,由于加入Na2CO3只涉及酸性强弱与量的问题,而加入CaCO3除了酸性强弱与量的问题,还涉及沉淀溶解平衡,因此需要考虑的因素更多。 同样的,由于本反应不仅仅涉及酸性强弱有关,还与沉淀溶解平衡有关,因此也需要综合考虑,化学平衡常数给我们提供了极好的理论依据: 查表知:25℃时,Ksp(CaCO3)=2.5×10-9,Ka(HClO)=3.0×10-8 Ka1(H2CO3)=4.4×10-7Ka2(H2CO3)=4.7×10-11 ① ② ③ ④ ⑤ ⑥ 实验证实:往饱和氯水中加入CaCO3,可明显增强溶液的漂白性;往饱和氯水中加入少量或大量Na2CO3,溶液的漂白性均无明显变化。 往饱和氯水中加入NaHCO3,也可明显增强溶液的漂白性,你能够从平衡的角度加以证明吗? 基于以上认识,受多种理论影响的化学反应,应从多个角度分析反应发生的主导因素,才能真正理解反应的本质、找对反应产物。下面分几种情况进行分析: 1.“既与Ksp有关,又与酸性强弱有关”的离子反应 【分析】查表知:25℃时,Ksp(CuS)=1.3×10-36,Ka1(H2S)=1.2×10-7,Ka2(H2S)=7×10-15 ① ② ③ ④ 同理,查表知:25℃时,Ksp(CaCO3)=2.5×10-9,Ka1(H2CO3)=4.4×10-7Ka2(H2CO3)=4.7×10-11。 ① ② ③ ④ 2.“既与量有关,又与酸性强弱有关”的离子反应 既然这类反应需要从“定量”与“强弱”两个角度进行分析,那我们可以先选定一个角度,例如:先按量的多少找出产物,再看是否满足酸性强弱的条件。而满足酸性强弱的条件可以利用“酸碱质子理论”:给出H+的反应物是强酸,接受H+生成的产物是弱酸。故强酸变为产物离子时的K大于产物中弱酸电离时的K,就满足了“强酸制弱酸”的反应条件。 【例2】已知部分弱酸的电离平衡常数如表: 弱酸H2SO3H2CO3OH电离平衡常数(25℃)K1=1.5×10-2K2=1.1×10-7K1=4.4×10-7K2=4.7×10-111.3×10-10 【练习】已知部分弱酸的电离平衡常数如表: 弱酸HCOOHH2SH2CO3HClO电离平衡常数(25℃)K=1.77×10-4K1=1.3×10-7K2=7.1×10-15K1=4.4×10-7K2=4.7×10-113.0×10-8 书写下列反应的离子方程式: (1)将过量的HCOOH溶液与少量Na2CO3溶液混合:________________。 (2)将少量CO2气体通入NaClO溶液中:____________________________。 从“强弱”角度看:此反应若能发生,应满足Ka(HCOOH)>Ka1(H2CO3),这与题给常数大小顺序一致,因此反应可发生。
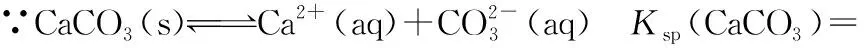


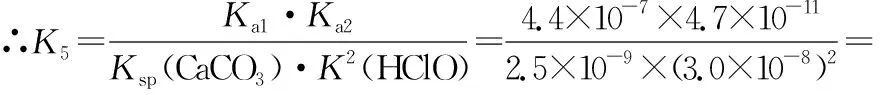
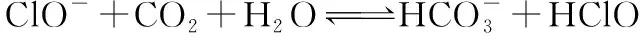

三、应用