调节溶液pH在高中化学试题中的体现
上海 樊亚军
工业流程题经常考查溶液中离子的存在形式,涉及溶液pH的调节,即改变溶液中氢离子或氢氧根离子浓度,目的是调节弱电解质的电离程度、控制盐类水解程度、改变氧化性或还原性强弱,也可能是为了调整浓度积析出沉淀,根据题意或生产实际需要具体分析,以下是几种常见类型:
一、调节水解程度
【例1】聚合氯化铝晶体([Al2(OH)nCl(6-n)·xH2O]m)是一种高效无机水处理剂。它的制备原理是调节AlCl3溶液的pH,通过促进其水解而结晶析出。
回答下列问题:
制备聚合氯化铝晶体,需严格控制溶液的pH在4.0~4.5才能使产率达到最大。结合AlCl3水解的离子方程式,用化学平衡移动原理解释控制pH在4.0~4.5之间的原因:
________________。

【解析】依据题意,Al3+在适当pH条件下可以水解生成聚合氯化铝晶体,如果溶液酸性太强,氢离子浓度太大,不利于Al3+水解平衡的正向移动,导致得到的晶体偏少,产率偏低;如果溶液碱性太强,氢氧根离子浓度过大,容易导致Al3+直接生成氢氧化铝沉淀,使晶体的产率下降。
【备考提示】盐类水解会引起溶液酸碱性的变化,溶液酸碱性的强弱也会影响盐类水解程度的大小,在通过水解得到产品的生产过程中,需要控制适当的酸碱性,从而控制盐类水解程度,得到所需要的产品。解决这类问题,需要找准水解反应,依据水解平衡移动来解答。
【例2】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
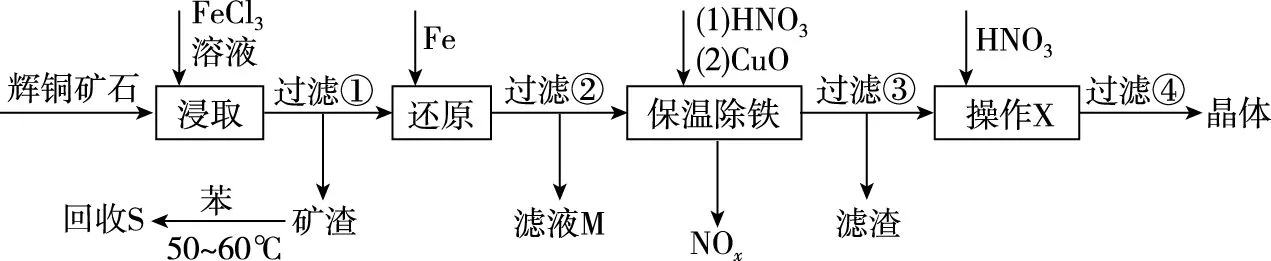
X步操作为________________________;要用硝酸调节溶液的pH,其理由是________________。
【答案】蒸发浓缩、冷却结晶 抑制Cu2+的水解。
【解析】从硝酸铜溶液中获得硝酸铜晶体需要通过蒸发浓缩、冷却结晶两步,用硝酸调节溶液pH的理由是加热会促进Cu2+会水解,加入硝酸可以抑制Cu2+的水解。
二、调节电离程度
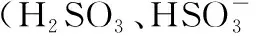
( )
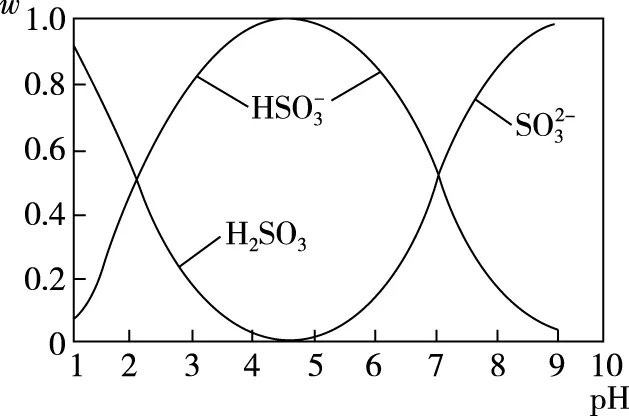
C.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
【答案】C
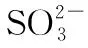
【备考提示】酸和碱的电离影响溶液的酸碱性,溶液的酸碱性也会影响弱酸或弱碱的电离程度,对于多元弱酸,往往涉及多个平衡的移动,情况更为复杂,此时需要根据题目信息,认真分析所涉及平衡的移动方向,综合判断。
【例4】常温下,体积为1 mL、浓度均为0.1 mol/L的XOH和X2CO3溶液,分别加水稀释至体积V,pH随lgV的变化情况如图所示,下列叙述中正确的是
( )
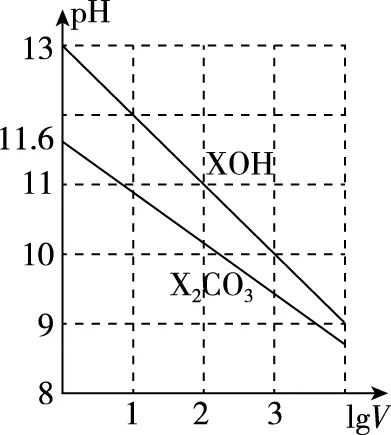
A.XOH是弱碱
B.pH=10的两种溶液中的c(X+):XOH大于X2CO3
C.已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
【答案】C
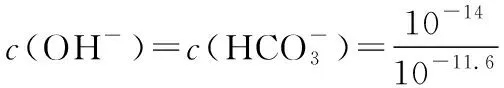
三、调节离子浓度
【例5】酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
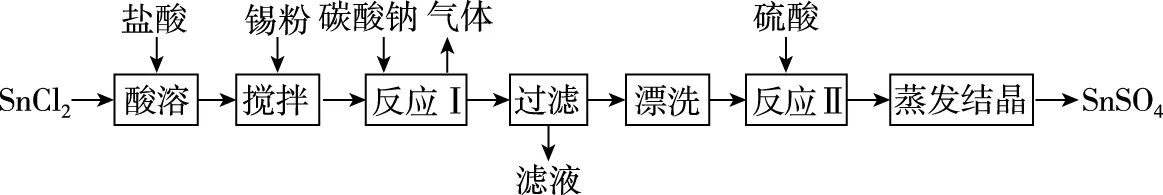
回答下列问题:
反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0 mol·L-1,则室温下应控制溶液pH________。(已知:Ksp[Sn(OH)2]=1.0×10-26)
【答案】<1
【解析】反应Ⅱ加入硫酸的目的是调节溶液中OH-浓度,使生成Sn(OH)2沉淀。根据Ksp[Sn(OH)2]=c(OH-)2×c(Sn2+)=1.0×10-26,将c(Sn2+)=1.0 mol/L代入可得c(OH-)=10-13mol/L,则c(H+)=0.1 mol/L,计算可得pH=1,所以pH小于1时,Sn2+开始沉淀。
【备考提示】依据Ksp,可以调节溶液的氢氧根离子浓度,使金属离子在浓度一定的条件下,产生沉淀。解决具体问题时,要注意观察题目所提供的Ksp数值,认真分析实验过程和实验目的,通过试剂的变化,找到解答问题的切入点。
【例6】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
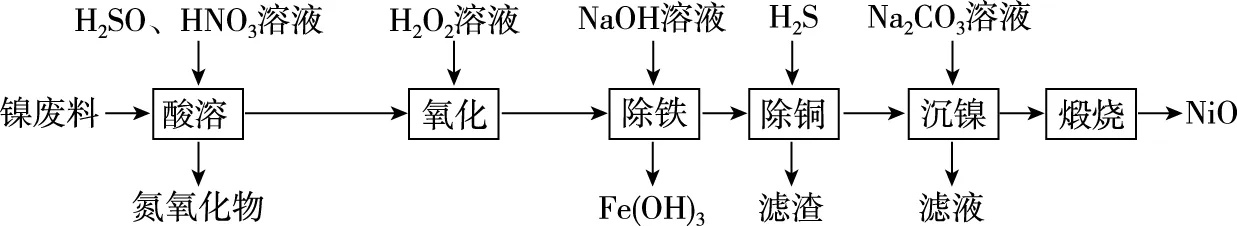
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)。

金属离子Fe3+Fe2+Ni2+开始沉淀的pH1.56.57.7沉淀完全的pH3.39.99.2
“除铁”时需控制溶液的pH范围为________。
【答案】3.3≤pH<7.7
【解析】加入氢氧化钠调节溶液pH除去铁离子,过滤得到氢氧化铁滤渣。依据表格提供的数据,若将铁离子全部除掉,pH≥3.3,保证镍离子留在溶液中,pH<7.7,所以需控制溶液的pH范围为3.3≤pH<7.7。
四、调节pH,控制沉淀种类
【例7】氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上用废铁为主要原料生产氧化铁黄的一种工艺流程如下:
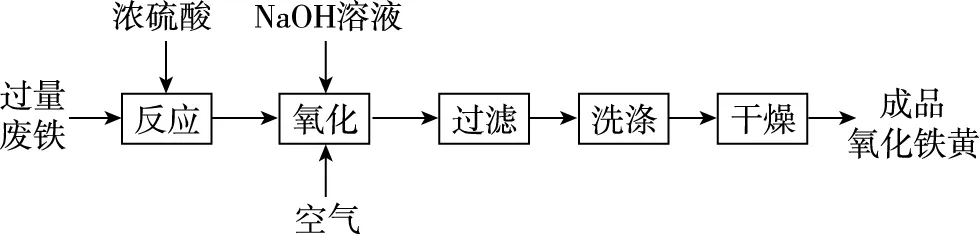
氧化时应控制pH的合理范围是3.5~4.0,pH过小导致氧化铁黄产率较低的可能原因是________________。
【答案】pH过低会导致部分氧化铁黄溶于酸
【解析】通过流程图可知,过量的铁与硫酸反应得到硫酸亚铁溶液,向硫酸亚铁溶液中加入氢氧化钠溶液,并通入空气,在该条件下发生氧化还原反应生成氧化铁黄。控制pH在合理范围内,目的是保证氧化铁黄产率最高,如果加入过多氢氧化钠,pH过高,在氧气存在下,产生氢氧化铁沉淀,pH过低,氧化铁黄会溶解于酸导致产率降低,因此应该将pH控制在合理范围。
【备考提示】对于综合性较强的实验题,在同一个体系中,不同的酸碱性条件下可能涉及多个沉淀反应,分析题目时首先应该找到相互竞争的沉淀反应,通过调节溶液的pH来控制所得沉淀的种类。
【例8】在我国的资源储备中,铬是重要的战略金属资源。如图是以某铬渣(主要成分为Cr2O3,杂质主要是FeO、SiO2等)为原料生产Cr2O3的工艺流程(如图1):
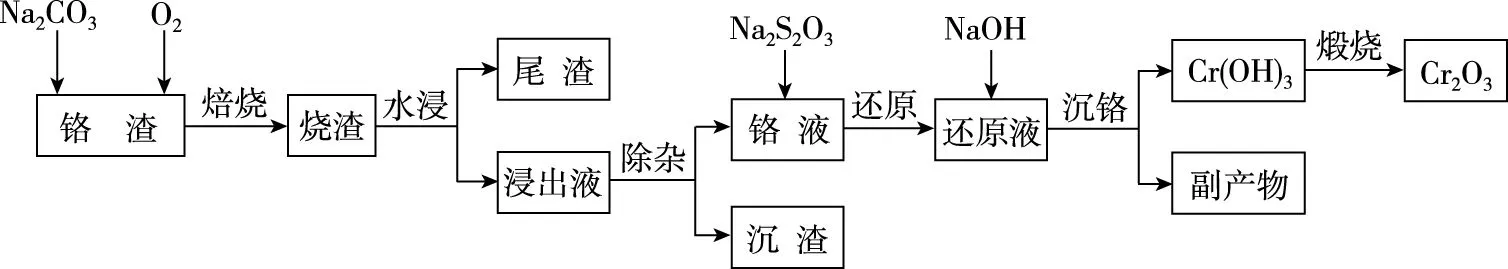
图1
已知:Ksp[Mg(OH)2]=1.2×10-11,Ksp[Cr(OH)3]=6.4×10-31。
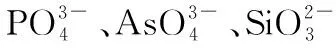
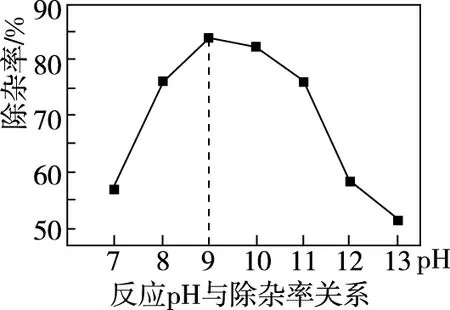
图2
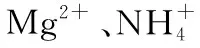
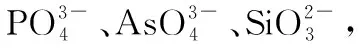
五、调节氧化性和还原性强弱
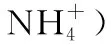
(2)进水pH对氨氮去除率和出水pH的影响如图所示。
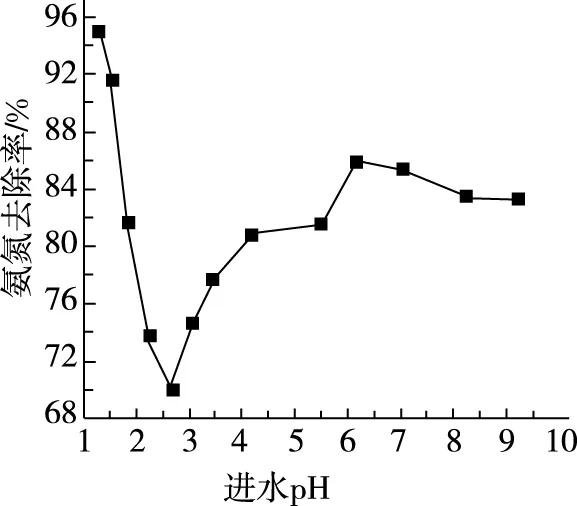
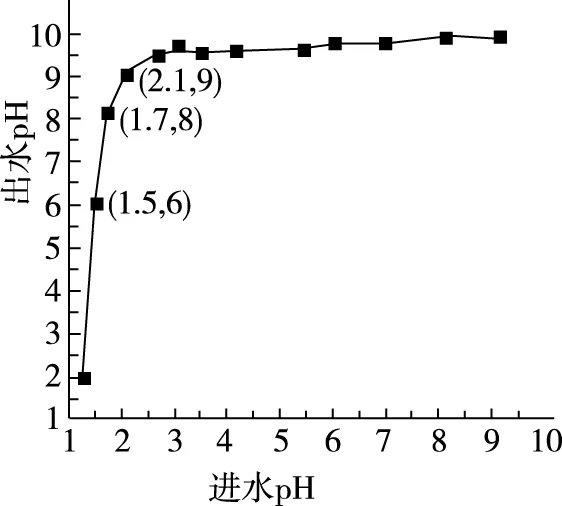
①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是________________。
②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是________________。
③进水pH应控制在________左右为宜。
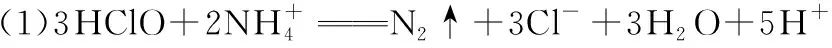
(2)①随着pH升高,NaClO含量增大,氧化性降低,导致氨氮去除率下降 ②随着pH升高,氨氮废水中NH3含量增大,氨氮更易被氧化 ③1.50


【练习】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下:

请回答下列问题:
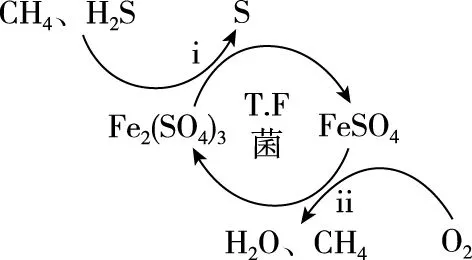
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如图所示。
(1)过程ⅰ中H2S发生了________(选填“氧化”或“还原”)反应。
(2)过程ⅱ的离子方程式是________________。
(3)已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全;
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
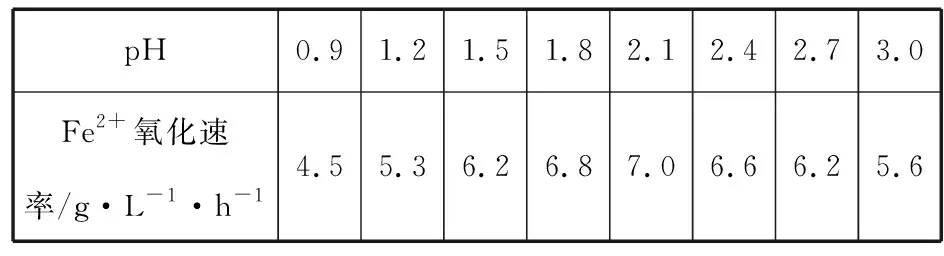
pH0.91.21.51.82.12.42.73.0Fe2+氧化速率/g·L-1·h-14.55.36.26.87.06.66.25.6
请结合以上信息,判断工业脱硫应选择的最佳pH范围并说明原因________________。
【答案】(1)氧化

(3)1.5≤pH<1.9;当pH≥1.9时,Fe3+开始沉淀,导致Fe3+和Fe2+浓度均下降,反应速率降低;pH小于1.5时,T.F菌活性较低,反应速率降低


