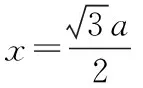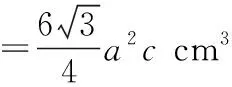挖掘隐含信息 构建晶体密度计算模型
河北 史义静 王民会
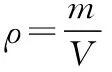
一、明确晶胞中含有的微粒数目,突破晶胞质量的计算
1.熟悉“均摊法”,明确晶胞中微粒数目
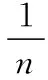
(1)立方晶胞中不同位置的粒子数
(2)六棱柱晶胞中不同位置的粒子数
2.利用摩尔质量架起微粒数目与质量之间计算的桥梁
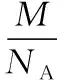
二、明确晶体空间构型,突破晶胞体积的计算
晶体中微粒排列的空间构型影响晶体的密度,常见晶体类型的空间构型是空间想象能力和逻辑思维能力训练的基础,是解题中运用类比迁移思维的捷径。所以要明确常见晶胞中晶胞参数即晶胞的边长a与粒子半径r的关系。以立方晶胞为例,已知晶胞参数为a,则晶胞体积V=a3。
1.简单立方晶胞
立方体中处于相邻顶点位置的粒子相切,晶胞如图1所示,由图可知a=2r,V=(2r)3。

图1
2.体心立方晶胞
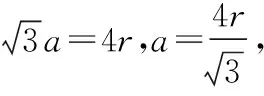
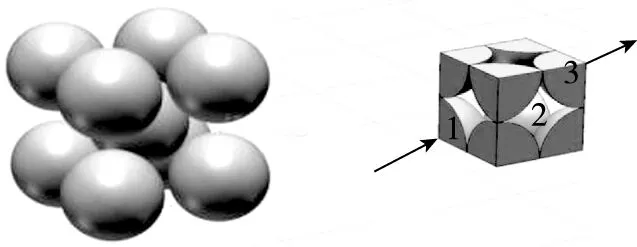
图2
3.面心立方晶胞
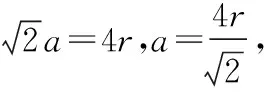
4.金刚石晶胞
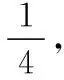
(a)
(b)
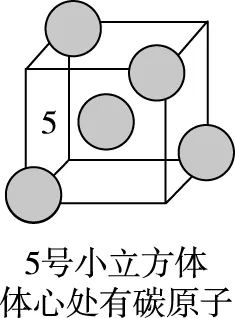
(c)
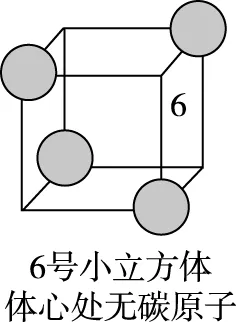
(d)
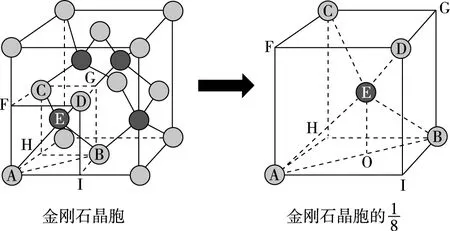
图5
三、典型例题
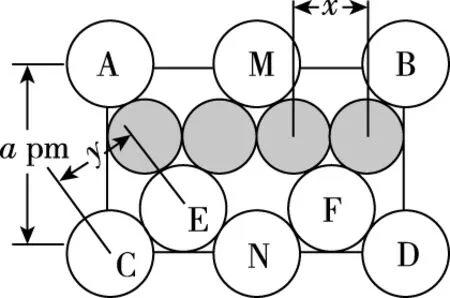
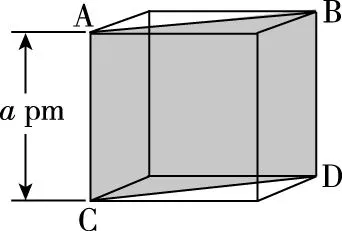
【例1】(2019·全国卷Ⅰ·35节选)(4)图6(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图6(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=________pm,Mg原子之间最短距离y=________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是________g·cm-3(列出计算表达式)。
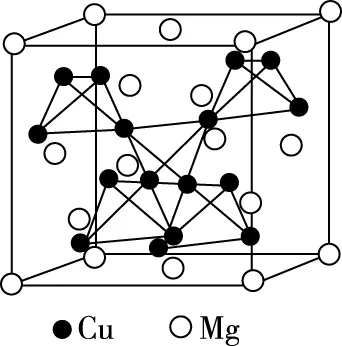
(a)
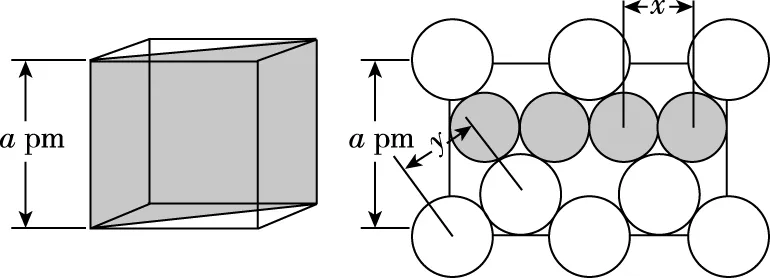
(b)
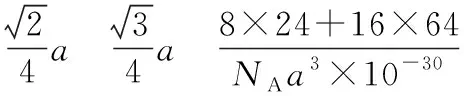
【分析】该题中,图6(a)比较复杂,而图6(b)需要考生将两个图的位置关系对应起来,在有限的考试时间内,考生很难入题,导致放弃该题。这就需要学生们要熟记常见晶体的结构特征,精准审题,快速突破难点。
第一步:提取信息,快速突破思维障碍点
(1)类比常见晶体类型,突破陌生晶体难点
题目需求的“Mg原子之间最短距离y”,根据图7(b)可知,为Mg原子的直径,但是题目并没有给出Mg原子的半径、直径等信息,这需要我们将图7(b)跟图7(a)对应起来,如图7所示:
(a)
(b)
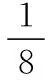
(2)灵活提取题干信息,突破思维难点
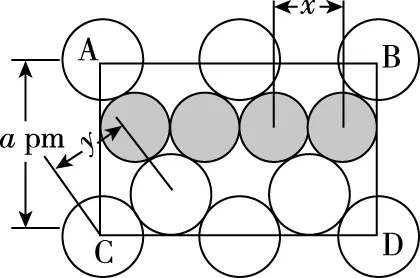
图6(a)过于复杂,多数考生很难看出Cu原子的位置,很多考生到此就放弃了。如果考生能认真审题的话,是不用纠结于Cu原子的具体位置的,因为题目中“图6(a)是MgCu2的拉维斯结构”,这句话表明了Mg原子和Cu原子的个数比为1∶2,这样就能得出晶胞内含有的Cu原子的数目为8×2=16。或者根据题目中“八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu”,可知Cu原子全部在晶胞的体内,即Cu原子的数目为4×4=16。
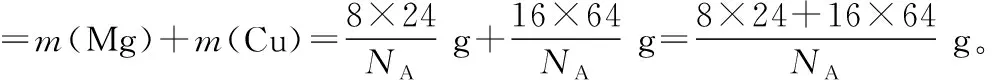
(3)注意单位换算,避免非智力失误
1 pm=10-10cm 1 nm=10-7cm
由图7(b)可知,晶胞的边长为apm,即a×10-10cm,晶胞的体积为V(晶胞)=a3×10-30cm3。
第二步:构建立体晶胞构型与平面截图之间的对应关系,突破边长与微粒半径的关系
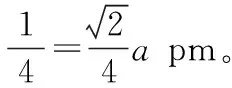
(c)
(d)
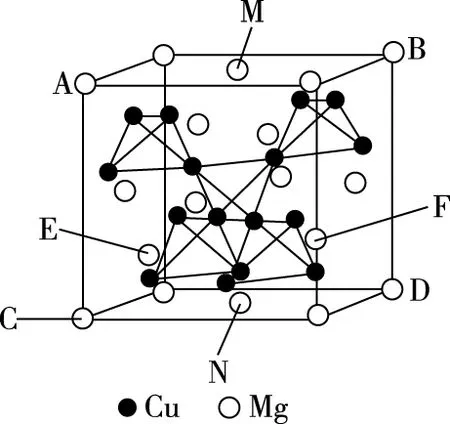
本题中,16个Cu原子的位置排列情况如下,根据题目中“八面体空隙,填入以四面体方式排列的Cu”,这个八面体指的是面心的6个Mg原子围成的正八面体,在其中心填入了四个铜原子以正四面体结构排列,如图9所示。

图9
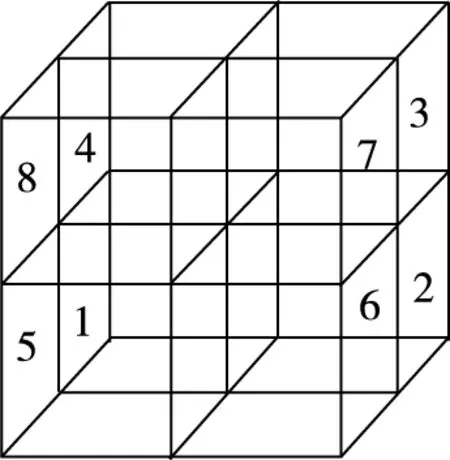
再根据题目中“半数的四面体空隙中,填入以四面体方式排列的Cu”,这个“半数四面体”指的是“Mg以金刚石方式堆积”的晶胞分割成的八个小立方体中,体心内无镁原子的小立方体,即本文图4(b)的8号、3号、1号、6号小立方体,在这四个小立方体的体内分别填充了四个铜原子,以正四面体结构排列,如图10所示。
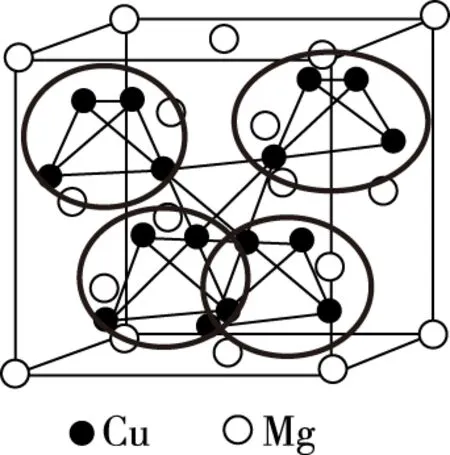
图10
由图10可知,上述八面体空隙中的4个Cu原子,分别处在这四个正面体中,所以,该晶胞中16个Cu原子分为4组,每组4个以正四面体结构排列,填充在该晶胞的体内。
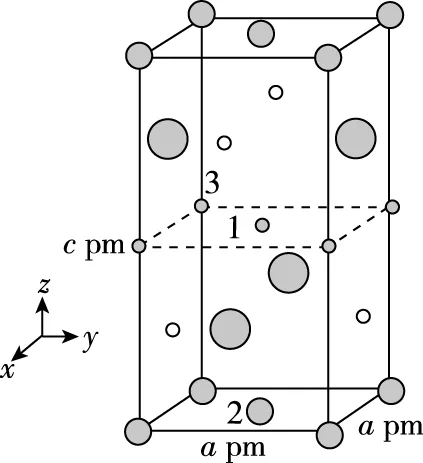
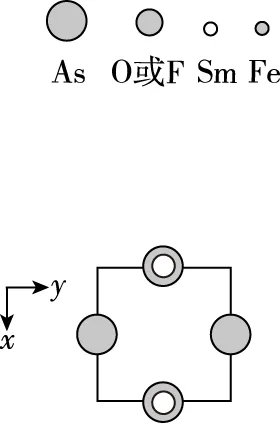
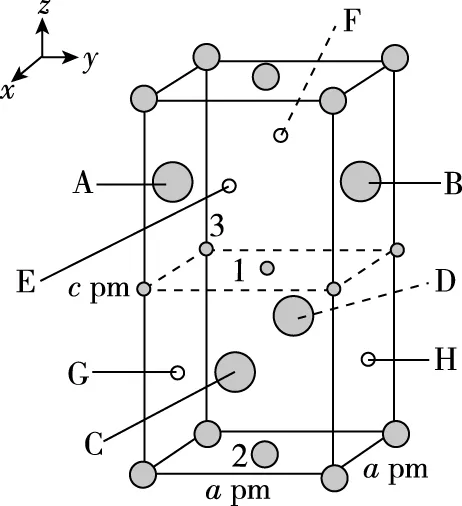
【例2】(2019·全国卷Ⅱ·35节选)(4)一种四方结构的超导化合物的晶胞结构如图11(a)所示,晶胞中Sm和As原子的投影位置如图11(b)所示。
(a)
(b)
图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm-3。
【答案】SmFeAsO1-xFx
【分析】该题晶胞为长方体,对于一些习惯立方晶胞的考生来说,容易陷入思维定式,将晶胞的体积算为a3×10-30cm3,从而失分。除此,该题还考查了数学上的三视图,另外,运用“均摊法”求解各个原子的数目时,一部分考生难以理解题意,无法算出F-和O2-的数目,导致放弃该题。这就需要学生们平时要训练自己的空间想象能力,考试时提取有效信息,突破难点。
第一步:类比常见晶体类型,突破陌生晶体难点
第二步:理解俯视图,突破微粒的相对位置
根据题目中“晶胞中Sm和As原子的投影位置如图11(b)所示”,对比图11(a)和图11(b)可知,图11(b)是图11(a)的俯视图,As和Sm原子位置关系如下:
(a)
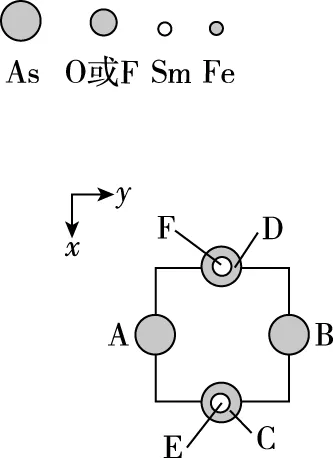
(b)
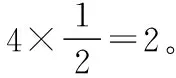
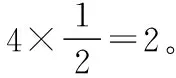
第三步:灵活提取题干信息,突破思维难点
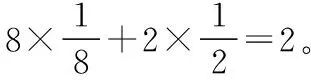
那么,F-和O2-的数目各自为多少呢?根据题目中“两者的比例依次用x和1-x代表”,可得,F-的数目为2x,O2-的数目为2(1-x)。
(1)该化合物中各个微粒的比值为Sm∶Fe∶As∶O∶F=2∶2∶2∶2(1-x)∶2x=1∶1∶1∶(1-x)∶x,故该化合物的化学式为SmFeAsO1-xFx。
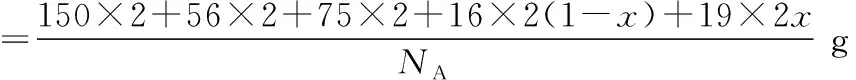
(3)该晶胞为长方体,其体积=底面积×高,即:V(晶胞)=a2c×10-30cm3
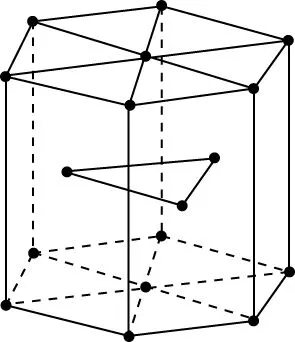
图13
【例3】(2018·全国卷Ⅲ·35节选)(5)金属Zn晶体中的原子堆积方式如图13所示,六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为________g·cm-3(列出计算式)。
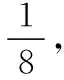
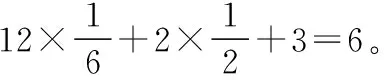
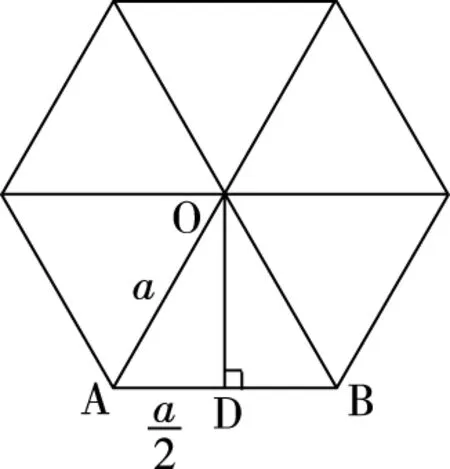
图14
第二步:晶胞的上下面都为正六边形,因为正六边形由六个等边三角形组成,所以,正六边形的面积=三角形OAB的面积×6,如图14所示。
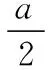
设OD的距离为xcm,根据勾股定理: