高考中陌生的非金属元素——以非金属元素为背景的高考化学试题解题策略三探
吉林 赵鑫光
无机非金属元素一直以来都是高考命题的热点,尤其在工艺流程题和实验综合题中高频出现,从化学基本概念、物质的制备、化学反应原理、性质及检验等方面综合考查学生分析问题、解决问题的能力和接受、提取、运用陌生信息的能力。卤族元素作为典型的非金属元素,学生已经在高中课本中系统的学习过氯气的相关性质,但学生对其他卤族元素和氯元素的一些化合物相对陌生,这给高考命题留出了较大空间。本文选择氟(F)、氯(Cl)、溴(Br)、碘(I)等几种典型的卤族非金属元素及其化合物加以介绍,并配以例题、解析,以期学生通过练习掌握该类试题的解题策略。
一、氟及其化合物
1.氟气(F2)
(1)氟气是淡黄绿色气体,在任何温度下都可与金属直接化合,生成高价氟化物,F2与Cu、Ni、Mg作用时金属表面生成一层致密氟化物保护膜而中止反应,所以F2可储存在Cu、Ni、Mg或合金制成的容器中。
(2)F2在低温黑暗中即可与H2直接化合放出大量热导致爆炸,无法控制。



2.氟化氢(HF)


3.氟化物
(1)氟化钙(CaF2)又叫萤石,不溶于水,氟化银(AgF)易溶于水,与其他卤化物不同。

【典例1】氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出来。
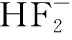
(2)利用化学反应也能制取氟。请配平下列化学方程式

②其中还原产物是________。
(3)某温度下测得浓度均为0.10 mol/L的KF和HF混合溶液的pH=4,近似计算HF的电离平衡常数Ka=____________________(写出计算过程)。
(4)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量f随pH的分布曲线如图所示。用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式:____________________________。

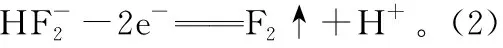
二、氯的化合物
1.二氧化氯(ClO2)
(1)ClO2为黄绿色有特殊刺激性气味气体,其液态时为红褐色,固态时为浅红色。主要用于自来水的消毒、木质纸浆的漂白等。二氧化氯具有杀菌能力强、对人体及动物没有危害以及对环境不造成二次污染等特点。


(4)ClO2属于强氧化剂,其氧化能力比Cl2强,还原产物为Cl-。



(5)ClO2可以用如下方法制备(①为实验室制法,其他为工业制法):





2.次氯酸(HClO)及其盐
(1)次氯酸是弱酸,其酸酐是一氧化二氯(Cl2O)。


(3)次氯酸钠也具有强氧化性:


(4)在氯水中加入新生成的HgO或碳酸盐可制得次氯酸:


3.亚氯酸(HClO2)及其盐
(1)HClO2是弱酸,其酸性大于HClO,Ka=5.0×10-3。
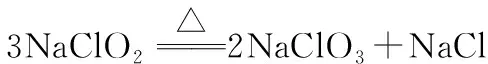


4.氯酸(HClO3)及其盐
(1)HClO3为强酸,仅存在于溶液中,减压蒸馏冷溶液可得到黏稠的浓溶液。
(2)HClO3不稳定,可按如下方式分解:
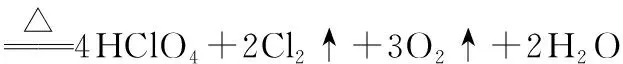

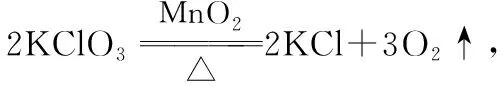
5.高氯酸(HClO4)及其盐
(1)高氯酸是无机含氧酸中最强的酸。KClO4和NH4ClO4的溶解度较小。


混凝土的凝结和硬化是水泥与水发生水化反应的最终结果,要想保证混凝土的强度,就要建立适宜于水化反应的环境。所以,养护对于混凝土的质量至关重要。通常采用的养护方法主要是覆盖浇水养护和覆膜养护,其关键在于为混凝土水化提供适宜的温度和湿度条件,以促进水化反应的顺利进行。
(4)工业上制备高氯酸可采用电解氧化HCl(aq)法:
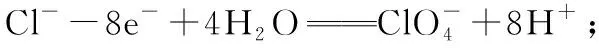

【典例2】亚氯酸钠是重要漂白剂,某校化学实验探究小组设计如图实验制备亚氯酸钠(NaClO2)晶体。

[查阅资料]
Ⅰ:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。

[进行实验]
(1)盛装浓硫酸仪器名称是________。
(2)装置C的作用是________________。
(3)ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的离子方程式为____________________。
(4)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作。
①55℃蒸发结晶;②趁热过滤;③38~60℃热水洗涤;④低于________干燥,得到成品。
[实验反思]
(5)如果撤去D中的冷水浴,可能导致产品中混有的杂质是________。
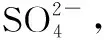
(7)测定样品中NaClO2的纯度。测定时进行如下实验:

①确认滴定终点的现象是________________。
②所称取的样品中NaClO2的物质的量为________(用含c、V的代数式表示)。
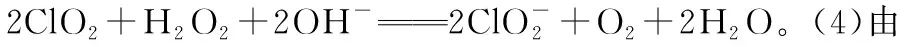
【典例3】高氯酸可用于生产高氯酸盐、人造金刚石提纯、电影胶片制造、医药工业等方面。工业上用如图工艺流程生产高氯酸,同时得到副产物亚氯酸钠(NaClO2)粗品。

已知:①NaHSO4的溶解度随温度的升高而增大,适当条件下可结晶析出;
②高氯酸是迄今为止已知含氧酸中的最强酸,沸点为90℃;
③NaClO2固体受热易分解。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为________________,冷却过滤的目的是________________,
能用蒸馏法分离出高氯酸的原因是________________。
(2)反应器Ⅱ中通入SO2的目的是________________。
(3)从反应器Ⅱ中获得NaClO2粗品的实验操作依次是________(填字母,下同),进一步提纯的操作为________。
a.过滤 b.重结晶 c.蒸馏 d.蒸发浓缩 e.蒸干灼烧 f.冷却结晶 g.萃取分液


三、溴及其化合物
1.单质溴(Br2)
(1)溴单质是深红棕色液体,是卤素单质中水溶性最好的,每100 g水中可溶解3.58 g单质溴。


2.溴化氢(HBr)和溴化物
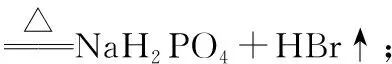


3.溴的含氧酸及其盐
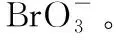
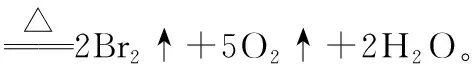

【典例4】溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等制造上,回答下列问题:

(2)溴原子与氯原子能以共价键结合形成BrCl。BrCl分子中,________显正电性。BrCl与水发生反应的化学方程式为__________________________。

在密闭容器中将过量CuBr2于487 K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会________(填“增大”“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为________。

四、碘及其化合物

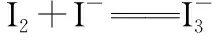
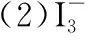
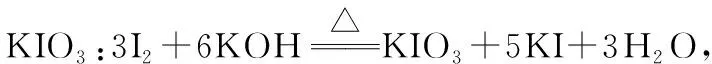
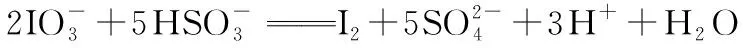

2.碘量法在定量分析中的应用


(2)剩余碘量法:是先在具有还原性的待测样品中加入过量且定量的碘标准溶液,待I2与待测样品完全反应后,再用硫代硫酸钠标准溶液滴定剩余的碘单质,以求出待测样品纯度。
(3)间接碘量法:也称置换碘量法,是先在具有氧化性的待测样品中加入过量碘化钾溶液,待测样品将碘化钾氧化,析出定量的碘,再用硫代硫酸钠标准溶液滴定析出的碘,从而测出待测样品的纯度。
【典例5】KIO3是一种无色易溶于水的晶体,医药上可作防治地方甲状腺肿的药剂,目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如图:
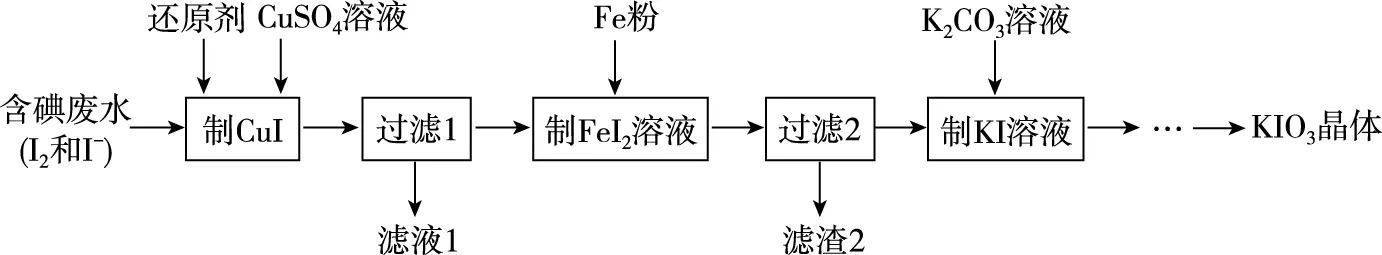
(1)检验“含碘废水”中含有的单质I2,常用的试剂是________。
(2)进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加________盐溶液来检验其是否已洗涤干净。
(3)“滤渣2”的成分为________(填化学式)。
(4)“制KI”时,发生反应的化学方程式为____________________。
(5)食用加碘盐新标准是每千克食盐中碘元素含量为25毫克(波动范围为18~33 mg/kg)。测定食盐试样中碘元素含量的步骤如下:称取4.000 g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00 mL 6.000×10-4mol·L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理:

①计算该食盐试样中碘元素的含量(单位mg/kg,写出计算过程):________________。
②该食盐试样是否符合新的食用加碘盐标准,并说明判断依据:________________。

【典例6】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:



(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:

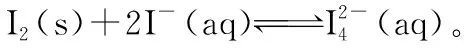
温度降低时,反应①的平衡常数将________(填“增大”“减小”或“不变”);反应②的平衡常数的表达式为K=________。

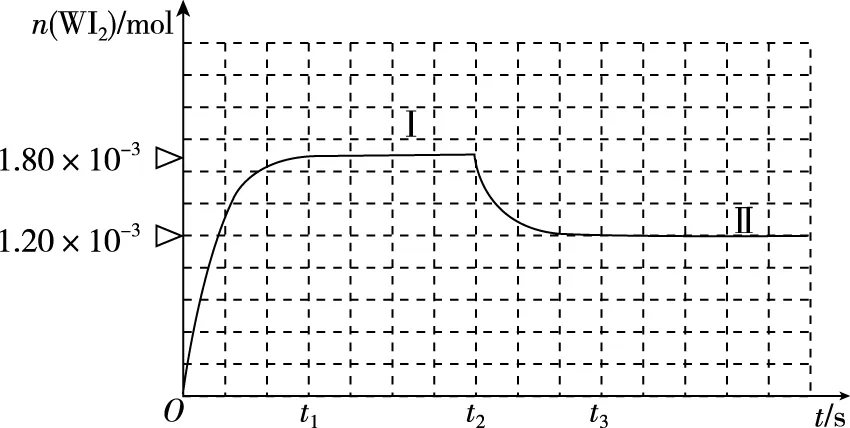
①该反应ΔH________(填“>”或“<”)0。
②反应从开始到t1(t1=3 min)时间内I2的平均反应速率v(I2)=________。
③在450℃时,该反应的平衡常数K的值为________。
④能够说明上述反应已经达到平衡状态的有________(填选项字母)。
A.I2与WI2的浓度相等
B.容器内各气体的浓度不再改变
C.容器内混合气体的密度不再改变
D.容器内气体压强不发生变化
五、小结


