拆分法解决氧化还原问题
浙江 刘忠英
氧化还原反应是中学化学核心理论知识,是充分学习元素及其化合物性质等知识的基础,也是分析电化学问题的重要手段,成了各地高考中高频出现的考点。但学生还是常考常错,其根本原因在哪里?笔者在教学实践中发现:若能把氧化还原反应“拆分”为有价态变化的主体反应和介质中的物质参与的离子反应去思考,再将主体反应“拆分”为氧化和还原两部分去分析,就能够使思维更加有序,极大降低错误率。本文就拆分法梳理氧化还原反应,巩固基础知识,重建知识网络,理清守恒关系的先后规律,建立分析问题的系统思维,拓展学生思维的广度和深度,提高学生解决问题能力。
一、拆分反应,分析主体物质价态变化
氧化还原反应必然有元素的化合价升降,含有这些元素的物质构成了方程式的主体部分,我们一般称之为“两剂两产物”,其余物质属于反应的环境部分,化合价不会改变,其主要功能在调配电荷、使其他元素守恒。据此,可以建立氧化还原反应的认知模型如下:
从半反应视角去看,氧化剂转化为还原产物,从强氧化剂变为弱还原剂,还原剂转化为氧化产物,从强还原剂变为弱氧化剂,遵循化学反应“强+强=弱+弱”的一般规律。我们可以通过元素化合价的变化分析和定义氧化还原反应的“两剂两产物”,其中氧化剂和还原产物,还原剂和氧化产物是成对出现的。氧化剂具有氧化性,是描述物质所含元素得电子、化合价降低的性质,高价元素一般具有氧化性,低价元素一般具有还原性,梳理常见氧化剂和还原剂的价态变化规律,有助于对氧化还原反应的理解。
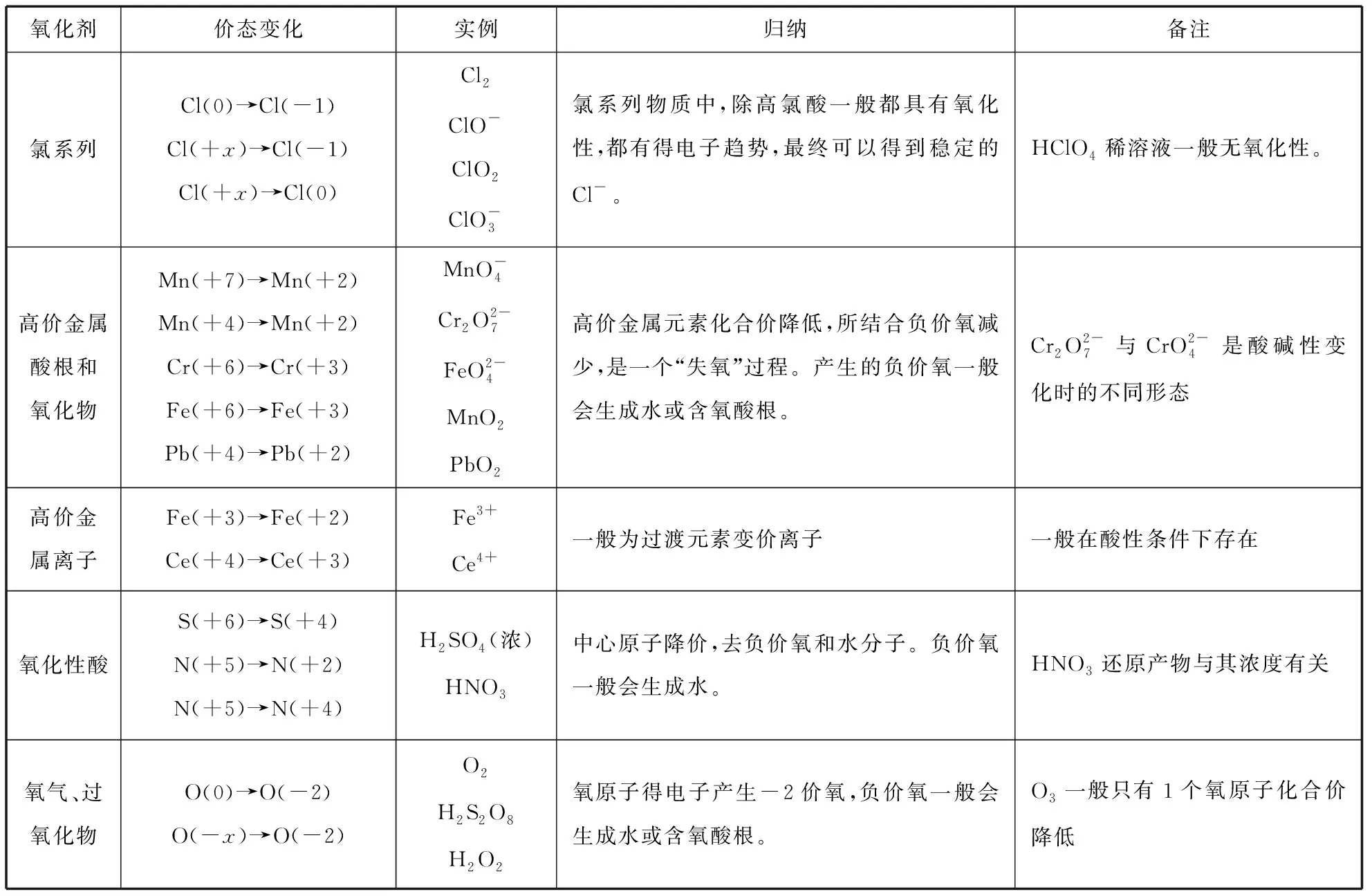
表1 常见氧化剂和其还原产物
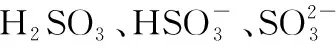
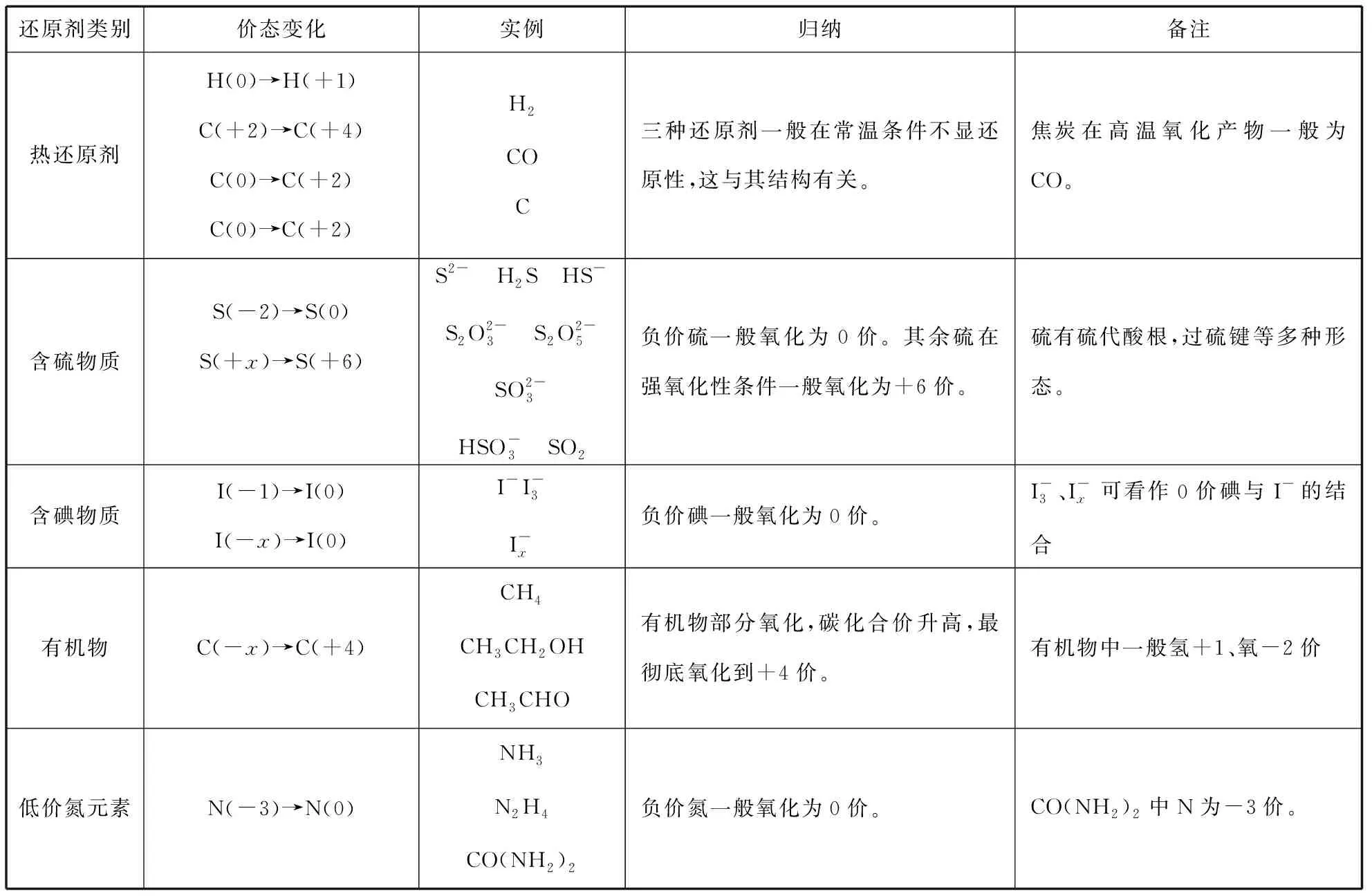
表2 常见还原剂和其氧化产物
【例1】1.写出O2将Mn2+氧化成MnO(OH)2的离子方程式:____________________。
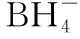


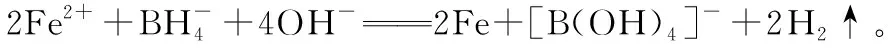
二、电子守恒,确定变价原子之间关系
从哲学的角度来说:物质不可能被毁灭,也不会被创造,只能从一种形式转化为另一种形式。电子也是如此,电子可以从一个物质转移到另一个物质,在化学变化中电子是守恒的,得失电子数相等,在化学反应中表现为化合价升降相等。在明确了“两剂两产物”价态变化数之后,氧化剂、还原剂、氧化产物和还原产物之间存在确定的物质的量之比,据此,不需要书写方程式就可以确定变价原子之间的关系式。

【答案】2∶7

【例3】3.84 g铁和氧化铁的混合物溶于过量的盐酸,标准状况下生成0.672 L氢气,若反应后溶液中无Fe3+,求氧化铁的质量?
【答案】1.6 g
【解析】如何绕开三个化学方程式列出关系式呢?根据氧化还原反应可知:反应过程中只有铁是还原剂,失去电子;氧化铁和盐酸是氧化剂,得到电子,其中盐酸得到的电子可以通过其还原产物的量氢气得知,根据得失电子相等解答如下:
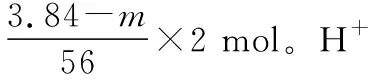
三、计算电荷,判断环境参与反应物质
化学反应的实质是原子间重新组合,氧化还原反应过程中,元素的化合价改变,与原子重组配比也要改变,新生成的离子电荷数也可能要发生变化,反应前后的电荷数可能并不相等,为了使溶液保持电中性,需要介质中存在的一些离子参与或者生成。所以氧化还原反应在配平了“两剂两产物”的关系之后,需要计算电荷数,在水溶液中一般用H+或OH-调平电荷,具体如下:

其中左边补H+和右边补OH-都能够对正电荷“左少右多”的反应达到相同的平衡电荷效果,此时要关注溶液的酸碱性,也就是溶液中氢、氧元素主要存在的形式,这就是所谓原子守恒考虑的问题。所以,从逻辑上来说:首先需要配平电荷,再进行原子配平,初学者因为接触的氧化还原反应比较基础,在这两步的顺序没有严格区分,造成了认识的误区。若溶液没有明确酸碱性,可以认为是水分子参与反应,生成了酸或碱。所以,酸性溶液进行并不一定就是有H+参加反应,有H+生成的情况也很常见,碱性溶液进行并不一定就是有OH-参加反应,有OH-生成也可以。
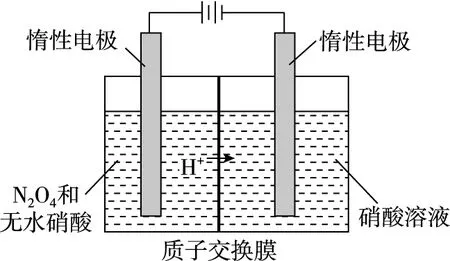
【例4】N2O5是绿色硝化试剂,溶于水可得硝酸,如图是以N2O4为原料电解制备N2O5的装置示意图,写出阳极区生成N2O5的电极反应式:____________________。