构建思维模型 突破“最佳条件”类试题
天津 郑玉海
对反应条件的选择和优化的掌握是课标所要求的,其目的是利用所学化学原理来解决实际问题,体现化学的实用性。在高考的考查中不仅要会选择最佳条件,而且还要分析其原因,因此要求学生具有扎实的基础知识,同时对识图能力、信息迁移能力和语言表达能力提出了更高的要求,所以试题难度较大。
1.《课程标准》对学生的要求
(1)能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动的方向及浓度、转化率等相关物理量的变化,能讨论化学反应条件的选择和优化。
(2)能运用温度、浓度、压强和催化剂对化学反应速率的影响规律解释生产、生活、实验室中的实际问题,能讨论化学反应条件的选择和优化。
(3)针对典型案例,能从限度、速率等角度对化学反应和化工生产条件进行综合分析。
(4)能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
2.在高考中由图象确定最佳条件考查统计
由图象确定或判断最佳条件以陌生图象形式呈现,主要考查根据反应的转化率、产率、溶解度、浓度的变化图象来选择最适宜的温度、浓度、催化剂、投料比、时间、pH等条件,一般都属于中档题或难题,具体考查见表1。
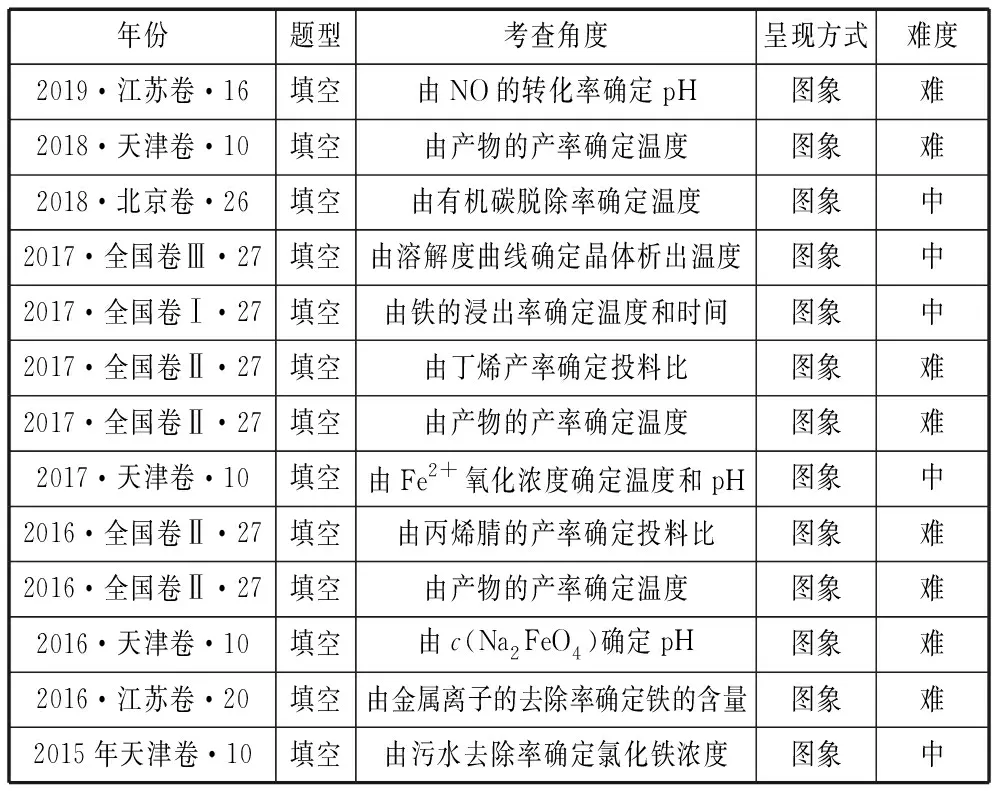
表1 在高考中由图象确定最佳条件考查统计
3.最佳条件的选择在高考中考查角度分析
(1)最佳温度选择
【例1】(2018·北京卷·26节选)(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图1所示。80℃后脱除率变化的原因:________________。
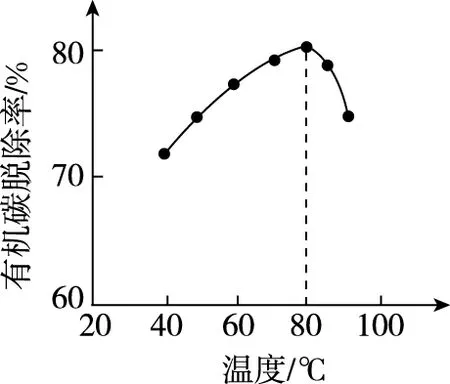
图1
【答案】(4)80℃后,H2O2分解速率大,浓度显著降低
【解析】本题信息有①H2O2将粗磷酸中的有机碳氧化为CO2脱除,②同时自身也会发生分解。控制条件有相同投料比、相同反应时间,要求根据有机碳脱除率与温度的变化图象判断最佳温度。由图知,随着温度升高,有机碳脱除率先增加后减小,80℃时,有机碳脱除率最高,该点是最佳温度。若温度低于80℃,随着温度升高,反应速率加快,除碳率增加;若温度高于80℃,考虑到H2O2自身会发生分解,所以氧化碳的能力减弱,有机碳脱除率减小。
【例2】(2018·天津卷·10节选)(2)CO2与CH4经催化重整,制得合成气:
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图2所示。此反应优选温度为900℃的原因是________________。
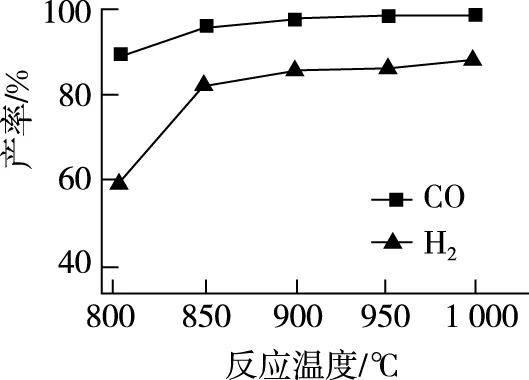
图2
【答案】(2)②900℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低。
【解析】本题控制条件有①按一定体积比加入CH4和CO2,②保持恒压;要求根据CO和H2产率随着温度变化图象找出最佳温度。由图知,随着温度升高,CO、H2的产率开始增加比较快,900℃后,产率变化不大,所以最佳温度为900℃。选用900℃主要考虑此时转化率已经较高,若升高温度产率增加不大,但会增大能耗,造成生产成本增加。
【例3】(2016·全国卷Ⅱ·27节选)(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
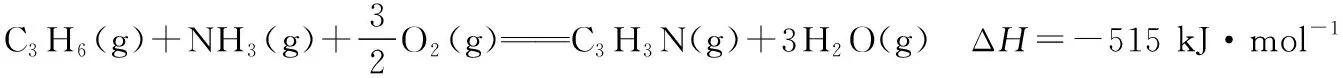

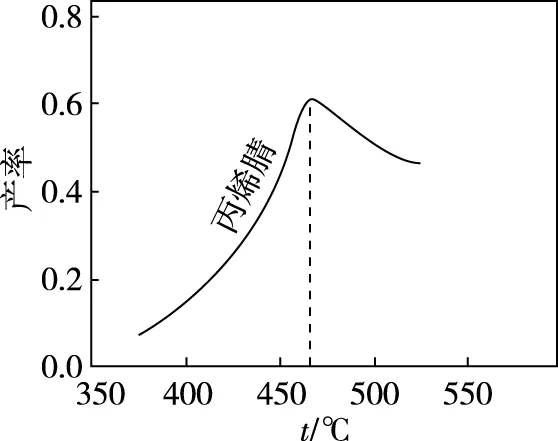
图3
(2)图3为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃。高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大
C.副反应增多 D.反应活化能增大
【答案】(2)AC
【解析】由图3知,随着温度升高,丙烯腈产率先增加后减小,最高产率对应的温度为460℃,所以该温度为最佳温度。判断温度高于460℃时,丙烯腈产率降低的可能原因,大部分同学认为,460℃是平衡态,随着温度升高,①平衡逆向移动,所以产率降低。这样理解正确吗?实际工业生产的反应都比较复杂且反应速率都比较慢,因此工业上是边投料边改变条件,并不是要等化学反应达到平衡态再改变条件。既然不能从反应的热力学角度去分析,那么只能从反应动力学角度去考虑。当温度低于460℃,随着温度的升高,催化剂活性增加且温度升高也能使反应速率加快,这两个因素都能使丙烯腈产率增加;当高于460℃时,再升高温度会引起副反应发生且催化剂活性会降低,因此会造成丙烯腈产率降低,答案选AC。
对于B项,由于460℃之后反应的状态不一定是平衡态,所以不能用平衡常数去分析。当然我们假设是平衡状态,温度升高时,反应①平衡逆向移动,则平衡常数也会减小。
最不好理解的是D项,大多数同学认为,升高温度催化剂活性降低,会使反应的活化能变大,这样理解对吗?我们知道对某一个具体的反应而言,使用催化剂,能降低反应的活化能,但该催化反应的活化能为一定值,如图4所示,该催化反应的活化能为E2,不会因催化剂活性变化而变化。因此说催化剂的活性与温度有关,但催化反应的活化能与温度无关,只与催化剂种类有关,一旦催化剂确定了,活化能是不变的,所以我们不要把催化剂活性与活化能大小两个概念相混淆。
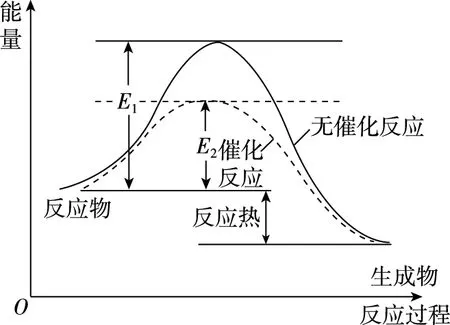
图4
【思维建模】一般可由图象变化趋势找到最佳温度,温度改变对某物质量的影响可通过反应速率变化、平衡移动方向、引发其他副反应、催化剂的活性及工业生产效益等方面来考虑,分析模型如图5所示。
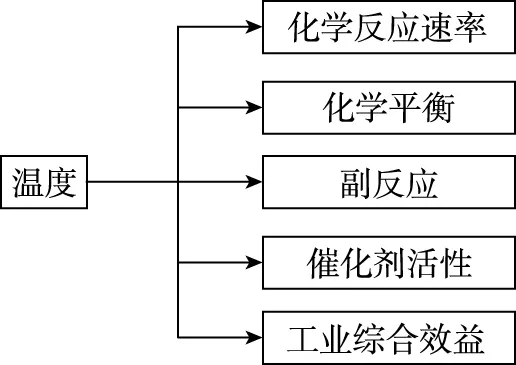
图5 选择温度最佳条件模型
(2)最佳pH选择

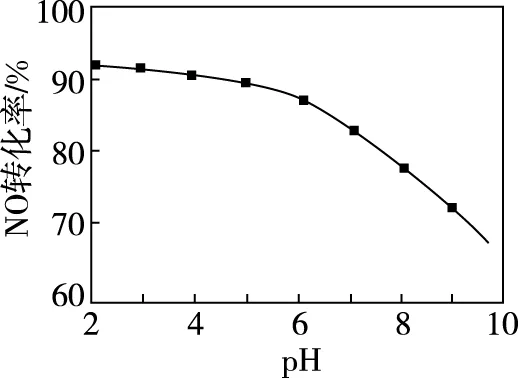
图6
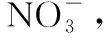
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________________。



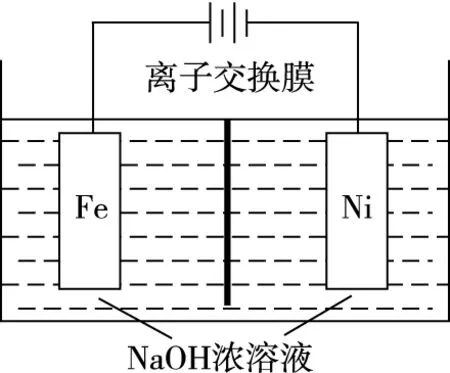
图7
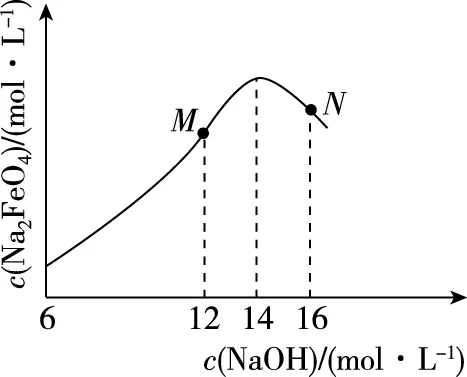
图8
②电解过程中,须将阴极产生的气体及时排出,其原因为________________。
③c(Na2FeO4)随初始c(NaOH)的变化如图8,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:________________。
【答案】(5)②防止Na2FeO4与H2反应使产率降低
③M点:c(OH-)低,Na2FeO4稳定性差,且反应慢[或N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低]。
【解析】本题不仅考查了电解的原理,也考查了信息提取、迁移及运用能力。
文本提取的信息有①氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质,②Na2FeO4只在强碱性条件下稳定,③Na2FeO4易被H2还原。
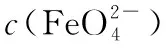
根据信息③知,Na2FeO4易被H2还原,所以电解过程中,须将阴极产生的气体及时排出。
分析M点c(Na2FeO4)低于最高值的原因,结合信息⑤和②可得,碱性较弱,Na2FeO4稳定性差;且c(OH-)较小使反应速率变慢。
分析N点c(Na2FeO4)低于最高值的原因,结合信息⑥和①可得,碱性较强,会有氢氧化铁生成。
(3)最佳投料比选择
【例6】(2016·全国卷Ⅱ·27节选)(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
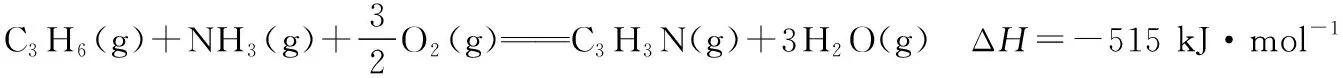


图9
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图9所示。由图可知,最佳n(氨)/n(丙烯)约为________,理由是________________。
【答案】(3)1.0 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低
【解析】由图9知,随着n(氨)/n(丙烯)的增大,丙烯腈产率先增加后减少,而副产物丙烯醛的产率一直降低,当n(氨)/n(丙烯)=1.0时,丙烯腈的产率最高,而副产物丙烯醛产率最低,为最佳投料比。
【例7】(2017·全国卷Ⅱ·27节选)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:

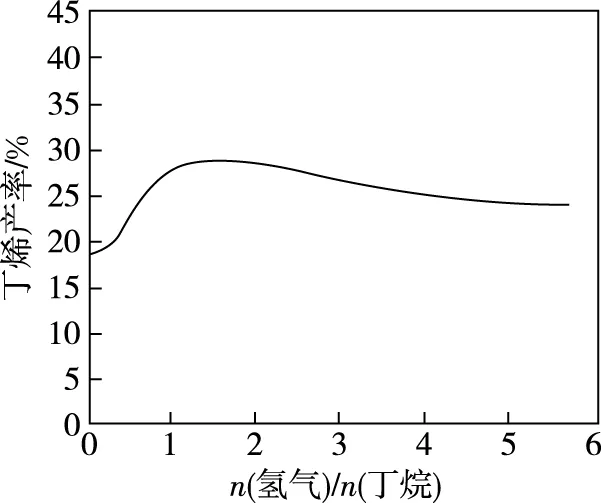
图10
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图10为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是________________。
【答案】(2)氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大
【解析】由图10知,随着n(氢气)/n(丁烷)的增大,丁烯产率先增加后减少。当n(氢气)/n(丁烷)≈1.5时,产率最高。结合题意知,氢气作为产物之一,其作用是活化催化剂,因此当n(氢气)/n(丁烷)较小时,随着n(氢气)/n(丁烷)增大,造成氢气的量增加,使催化剂的活性增强,加快反应速率,使丁烯产率增加。当n(氢气)/n(丁烷)较大时,由于氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大,使丁烯产率减小。
(4)最佳浓度选择
【例8】(2015·天津卷·10节选)(4)天津某污水处理厂用聚合氯化铁净化污水的结果如图11所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为________mg·L-1。

图11
【答案】(4)18~20
【解析】由题意知,聚合氯化铁既能吸附水中悬浮物,也能除去水中的还原性物质而使污水得到净化。由图11知,当浑浊度最高时,铁的浓度为18 mg/L;当除去还原性物质的量最高时,铁的浓度为20 mg/L。因此铁的浓度最佳范围约为18~20 mg/L。
(5)复合条件选择
【例9】(2017·全国卷Ⅰ·27节选)(1)“酸浸”实验中,铁的浸出率结果如图12所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为________________。
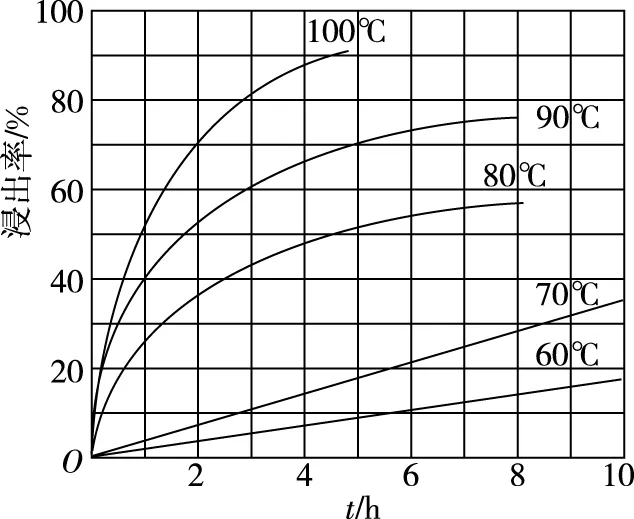
图12
【答案】(1)100℃、2 h,90℃、5 h
【解析】由图12知,当铁的浸出率为70%时,若温度为100℃,对应的时间为2 h;若温度为90℃时,对应的时间为5 h。本题出现的错误主要是漏选90℃、5 h。

(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是________________。
(2)由图13和图14判断使用硫杆菌的最佳条件为____________________。若反应温度过高,反应速率下降,其原因是________________。
图13
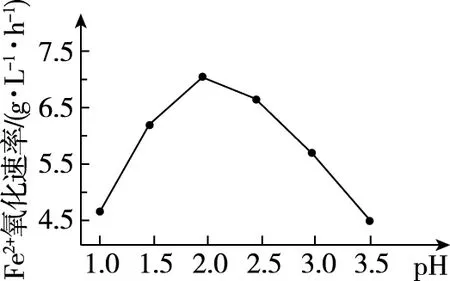
图14
【答案】(1)降低反应活化能(或作催化剂)
(2)30℃、pH=2.0 蛋白质变性(或硫杆菌失去活性)
【解析】硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,说明硫杆菌大大加快了反应速率,只有作为催化剂,才能使反应速率大大提高。
由图13知,当Fe2+氧化速率最大时,对应的温度为30℃;由图14知,当Fe2+氧化速率最大时,对应的pH为2.0,所以最佳条件为30℃、pH=2.0。
由于硫杆菌作为催化剂,若温度过高,催化剂的活性减弱,反应速率下降。
【思维建模】由图象确定最佳条件模型认知,如图15:
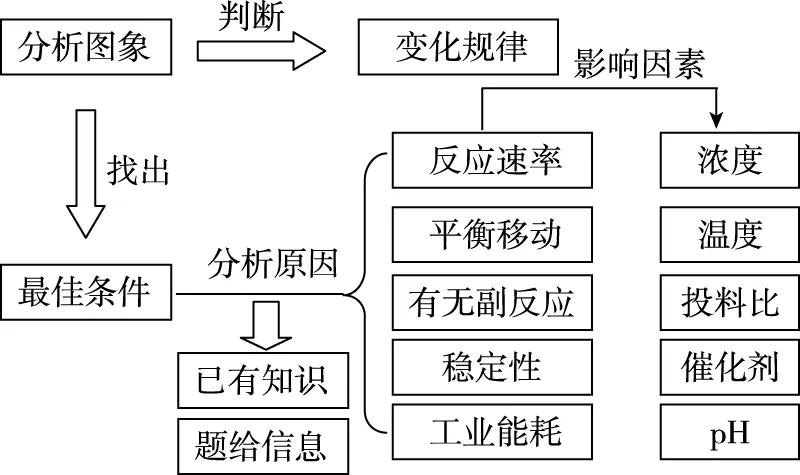
图15 由图象确定最佳条件模型
4.结语
基于《化学课程标准》和《中国高考评价体系》的指导,高考试题通过对反应条件的选择和优化的考查,主要考查了学生利用所学化学原理来解决实际问题的能力,更好地体现了化学原理对实际生产的指导意义。通过图象中转化率、产率、溶解度、浓度等物理量的变化,来考查最适宜的温度、浓度、催化剂、投料比、时间、pH等条件的选择,不仅要求学生具有扎实的基础知识,还要具备识图能力、信息迁移能力和语言表达能力,充分体现了高考考查必备知识、关键能力、学科素养、核心价值的命题导向。随着新课标不断推进和新高考的不断完善,新高考中必将继续体现“一核四层四翼”的高考评价体系,本文通过剖析从图象中选择最适宜的条件,来培养学生学习化学的基本思维方法和解题的思维模型。

