探析给定分子中“大π键”的判断方法
陕西 葛秋萍 李歆瑞
人教版普通高中课程标准实验教科书化学《选修5 有机化学基础》37~38页“科学视野”栏目中,有意识地通过分析苯的结构提出了“大π键”概念。2017年全国卷Ⅱ、卷Ⅲ及2018年全国卷Ⅱ中均有“大π键”试题,非常好地体现了《普通高中化学课程标准(2017年版)》和《考试说明》的要求。但是从考生作答情况看,得分率很低。究其原因,主要有三点:一是“大π键”自身在教材中的尴尬位置,在选修5模块中学习却不考,在选修3模块不学习却会考;二是“科学视野”栏目缺乏趣味性和互动性,在实际教学中可操作性不强,教师不知道如何教,学生不知道如何学;三是教师和学生对“科学视野”栏目的作用重视不够,在实际教学中,抽象、难于理解的“大π键”没有引起教师的足够重视,往往作为学生课上、课下的阅读材料,甚至不进行讲解。针对这一现状,笔者就如何判断给定分子中的“大π键”来谈谈自己的看法。
一、认识大π键
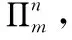
二、判断大π键的方法
1.确定分子的空间构型
根据大π键的概念可知,只有平面型分子才能形成大π键,这是形成大π键的首要条件。那么,如何确定分子的空间构型呢?
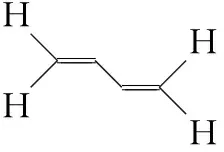
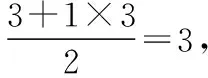
2.确定大π键的原子数
除了分子构型为平面型外,相邻原子中还必须有相互平行且未参与杂化的p轨道才能形成大π键,这就要求参与形成大π键的原子必须采取sp2杂化或sp杂化,这是形成大π键的第二个条件。那么,如何确定形成大π键的原子数呢?
对于有机分子,依据化学键特征来确定。烷烃中只含有单键,中心原子为sp3杂化,无相互平行且未参与杂化的p轨道,无法形成大π键;若分子中存在单双键交替结构,形成碳碳双键的碳原子为sp2杂化,原子中有相互平行且未参与杂化的p轨道,能形成大π键。例如,在1,3-丁二烯中,构成单双键交替结构的4个碳原子都采取sp2杂化,4个碳原子提供4个相互平行且未参与杂化的p轨道可参与形成大π键。
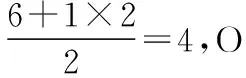
3.确定大π键的电子数
由杂化轨道理论可知,若相互平行且未杂化的p轨道都已容纳2个电子时不会重叠成键,所以形成大π键的每个p轨道有的容纳2个电子,有的容纳1个电子,有的是无电子的空轨道,由此可知形成大π键的第三个条件是p轨道上的电子总数小于p轨道数的2倍。那么,如何确定大π键的电子数呢?
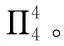
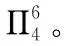
三、经典试题探究
【例1】(2017·全国卷Ⅱ·35节选)我国科学家最近成功合成了世界首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。

图(b)



第三步:每个N原子均有3个单电子,拿出2个单电子分别参与形成σ键,还剩余1个单电子参与形成大π键,再加上1个负电荷,共6个电子,满足形成大π键的第三个条件。
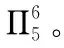

硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
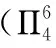

第二步:用杂化轨道理论确定大π键的原子数。N原子采取sp2杂化,假设参与杂化的轨道是2s、2px、2py,则N原子未参与杂化的2pz轨道与3个O原子的2pz轨道相互平行,4个原子提供4个相互平行且未参与杂化的p轨道,满足形成大π键的第二个条件。
第三步:确定大π键的电子数。N原子的3个单电子全部参与形成σ键,提供给大π键的电子数为5-3=2;每个配位O原子2p轨道上有两个单电子,其中1个单电子与N原子形成σ键,还剩余1个单电子参与形成大π键,再加上1个负电荷,共有6个电子,满足形成大π键的第三个条件。
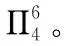
【例3】(2018·全国卷Ⅱ·35节选)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种。
【答案】SO3空间构型为平面三角形;单个SO3分子含有2种共价键。
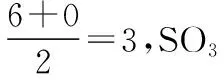
第二步:用杂化轨道理论确定大π键的原子数。S原子采取sp2杂化,假设参与杂化的轨道是3s、3px、3py,则未参与杂化的3pz轨道与3个O原子的2pz轨道相互平行,4个原子提供4个相互平行且未参与杂化的p轨道,满足形成大π键的第二个条件。
第三步:确定大π键的电子数。S原子提供3个电子参与形成σ键,提供给大π键的电子数为6-3=3,每个配位O原子2p轨道上有2个单电子,其中1个单电子与S原子形成σ键,剩余1个单电子参与形成大π键,共6个电子,满足形成大π键的第三个条件。
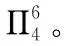
综上所述,高考命题的灵活程度在逐年加大,高考试卷上出现了越来越多的“课外知识”。其实课外知识并不“课外”,多数会在教材“科学视野”中涉及。这就要求教师在实际教学时,一定要认真研读教材,准确理解教材的编写意图,正确把握教学内容的深度和广度,设计出符合教材要求、符合学生认知水平和思维能力的教学流程,真正发挥好“科学视野”栏目的作用,提高学生的应变创新能力。

