借力盖斯定律 联动复习反应焓变及平衡常数计算
云南 沈艳华
盖斯定律、化学平衡常数是教育部制定的2003版《普通高中化学课程标准(实验)》《普通高中课程标准实验教科书化学选修四化学反应原理》新增教学内容,时隔十四年,应“提升学科核心素养”之需而产生的《普通高中化学课程标准(2017年版)》依然保留了这一板块的内容,以初步介绍热力学与动力学相关知识。
课程标准的制定指导了《普通高等学校招生全国统一考试大纲》的制定。正是因为课程标准十六年来关于盖斯定律及平衡常数不变的要求,导致考试大纲十六年来也一直看重平衡常数的考查:“理解盖斯定律,并能运用盖斯定律进行有关反应焓变(2017以前的版本为“能进行有关反应热的简单计算”,现版本更加严谨和科学)的计算”“了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算”“理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算”“理解溶度积(Ksp)的含义,能进行相关的计算”。
近五年高考试题对盖斯定律、化学平衡常数的计算考查频率统计如下:

项目20152016201720182019盖斯定律K计算盖斯定律K计算盖斯定律K计算盖斯定律K计算盖斯定律K计算卷Ⅰ键能算ΔH√判断吸放热√√√√√判断吸放热√卷Ⅱ√√√√√√√√√√卷Ⅲ√√√√√√√√√√
统计结果显示:反应焓变及平衡常数的计算在全国卷中几乎每一年、每一套均有考查。作为教材主干内容和考纲必考内容,如能联合复习,必能提高备考效率。那么,二者之间怎么联系呢?
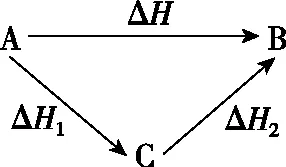
1840年,瑞士化学家盖斯(G.H.Hess)通过大量实验事实证明:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。盖斯定律的应用使那些实验难以测定的ΔH可以通过计算获得,例如,如图转化中存在:ΔH=ΔH1+ΔH2。
由于焓(H)、熵(S)、和温度(T)都是状态函数,因此,由三者组合而成的函数——吉布斯自由能(G)也是一个状态函数。恒温恒压下ΔG=ΔH-TΔS,故如图转化中也存在:

如果我们深入研究标准自由能和平衡常数的关系:
ΔG0=-RTlnK②
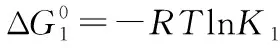

将②③④代入①式,则有
-RTlnK=-RTlnK1-RTlnK2
故如图转化中存在:K=K1·K2
这也就是“多重平衡规则”。由于高中化学没有介入“化学反应等温式”的学习,也就没有提及“多重平衡规则”。但在高中化学教学中,我们可以借力盖斯定律,通过方程式的叠加或删减得到上述结论,从而简化平衡常数的计算。例如:
对反应:


(1)式×p+(2)式×a删去A物质得:

结论:若已知数个相关反应的焓变,求一个新反应的焓变,我们可以根据目标反应的配平系数进行已知反应的加、减、乘、除,借助盖斯定律计算出目标反应的焓变;借此,我们也可以根据方程式的加减乘除得到目标反应的化学平衡常数:方程式相加K相乘;方程式相减K相除;方程式扩大n倍,K为原来的n次幂;方程式缩小n倍,K为原来的n次方根。因此,每一次盖斯定律的考查,亦可同时作为化学平衡常数计算训练。
一、气体体系中的联动复习

ΔH1=100.3 kJ·mol-1①

ΔH2=-11.0 kJ·mol-1②

ΔH3=________kJ·mol-1。
本题仅涉及简单的方程式叠加,是一道基础的盖斯定律运算题。二轮复习中,我们可以增加平衡常数的计算,加强思维训练,例如:




ΔH3=ΔH1+ΔH2=100.3 kJ·mol-1-11.0 kJ·mol-1=+89.3 kJ·mol-1
因为方程式相加K相乘,所以K3=K1·K2
【练习2】(2019·全国卷Ⅲ·28节选)需要方程式扩大一定的倍数后方可与其他反应进行叠加,因此,二轮复习中,联动复习平衡常数的计算会增加指数的应用,思维的综合力度明显提升,因此,我们可以将之改编为
Deacon直接氧化法可按下列催化过程进行:
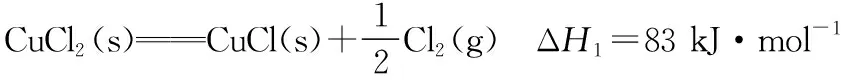


【解析】因为④式反应物中的4 mol HCl(g)来自③式且均为反应物,故③式×2正写;④式反应物中的1 mol O2(g)来自②式且均为反应物,故②式×2正写,此时引入1 mol Cl2(g)在产物,但还缺1 mol Cl2(g)在产物,因此①式×2正写。故④式=③式×2+②式×2+①式×2:
ΔH4=2ΔH3+2ΔH2+2ΔH1
=2×(83 kJ·mol-1-20 kJ·mol-1-121 kJ·mol-1)
=-116 kJ·mol-1
因为方程式相加K相乘,方程式扩大n倍,K为原来的n次幂;
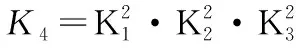
二、电离平衡中的联动复习
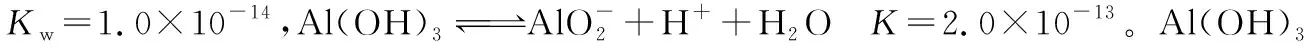
本题直接进行平衡常数的运算较为困难,但先设置反应焓变的计算有利于为学生搭建思维台阶:

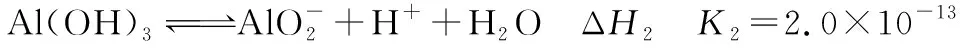
(1)Al(OH)3溶于NaOH溶液反应的ΔH3等于________(用含ΔH1、ΔH2的表达式表示)。
(2)Al(OH)3溶于NaOH溶液反应的平衡常数K3等于________。

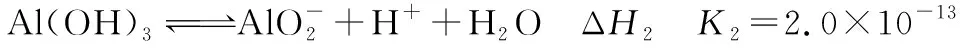
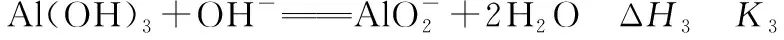
③式的Al(OH)3来自②式且同为反应物,故②式正写;③式反应物中的OH-来自①式且为产物,故①式反写:③式=②式-①式,故:ΔH3=ΔH2-ΔH1
三、水解平衡中的联合复习

与上题相似,电解质溶液中平衡常数的计算是比较抽象的一类难题,故增加反应焓变的计算加以强化。
【练习4】常温下,已知:

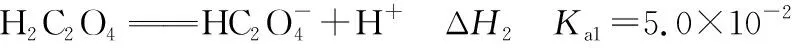




ΔH5=-ΔH1-ΔH3+ΔH4
有了盖斯定律的台阶,平衡常数的计算迎刃而解——方程式相加K相乘,方程式相减K相除:
四、沉淀溶解平衡中的联动复习

本题解析方法较多,为了同时巩固反应焓变的计算,同样可以改编试题为:





由③式=①式-②式可知:ΔH3=ΔH1-ΔH2
五、更多平衡体系中的联动复习
一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;如果一个反应的平衡常数小于10-5,则认为该反应很难进行。

多次强化后,对于平衡常数难以直接计算的试题,学生已经能够马上想到借助于盖斯定律。




由④式=①式-②式-③式,可知ΔH4=ΔH1-ΔH2-ΔH3
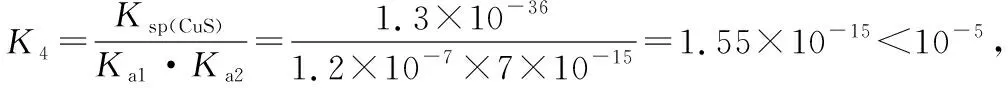
盖斯定律、各种平衡常数的计算是近几年高考的必考题型。综上所述,二轮复习中整合盖斯定律及平衡常数计算,练习中同时要求写出二者的表达式,有利于学生充分理解状态函数的特征,建立借助盖斯定律简化平衡常数计算的思维模式,从而简化有关电离平衡、水解平衡、络合平衡、氧化还原平衡、沉淀溶解平衡等多重平衡体系中求解平衡常数的问题,提高备考效率。

