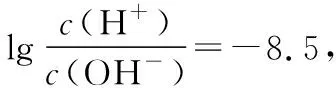思维建模 有的放矢——破解pH图象题
广东 张映辉
一、考纲定位

考纲定位核心素养1.了解电解质的概念。了解强电解质和弱电解质的概念。2.理解电解质在水中的电离以及电解质溶液的导电性。3.了解水的电离、离子积常数。4.了解溶液pH的含义及其测定方法,能进行pH的简单计算。5.理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算。6.了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。7.了解离子反应的概念、离子反应发生的条件。掌握常见离子的检验方法。8.了解难溶电解质的沉淀溶解平衡。理解溶度积(Ksp)的含义,能进行相关的计算。1.变化观念———正确认识溶液中粒子的行为和有关反应的实质。2.平衡思想———能用动态平衡的观点考查、分析溶液中的平衡问题。3.科学探究———对溶液中的粒子的变化和规律进行实验探究。4.模型认知———对中和滴定实验模型拓展和创新应用。
二、近四年高考题分布情况
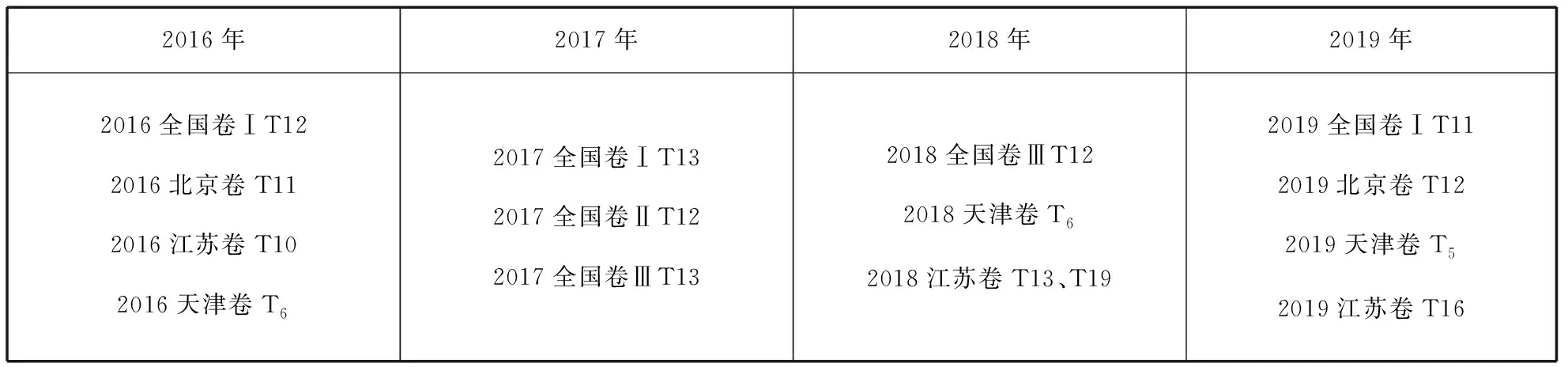
2016年2017年2018年2019年2016全国卷ⅠT122016北京卷T112016江苏卷T102016天津卷T62017全国卷ⅠT132017全国卷ⅡT122017全国卷ⅢT132018全国卷ⅢT122018天津卷T62018江苏卷T13、T192019全国卷ⅠT112019北京卷T122019天津卷T52019江苏卷T16
三、思维建模
1.pH图象题的分析步骤
(1)首先看纵坐标,搞清楚是酸加入碱中,还是碱加入酸中。
(2)其次看起点,起点可以看出酸性或碱性的强弱,这在判断滴定终点时至关重要。
(3)再次找滴定终点和pH=7的中性点,判断滴定终点的酸碱性,然后确定中性点(pH=7)的位置。
(4)最后分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况。
2.举例说明
以用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0 mol·L-1HA溶液为例,其滴定曲线如图。
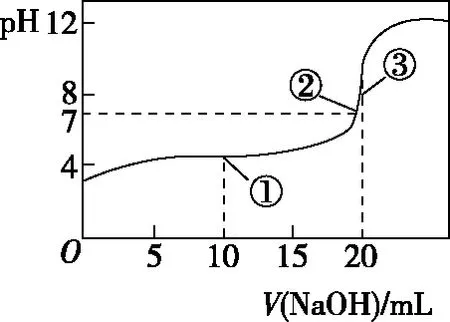
pH图象中五个关键“点”
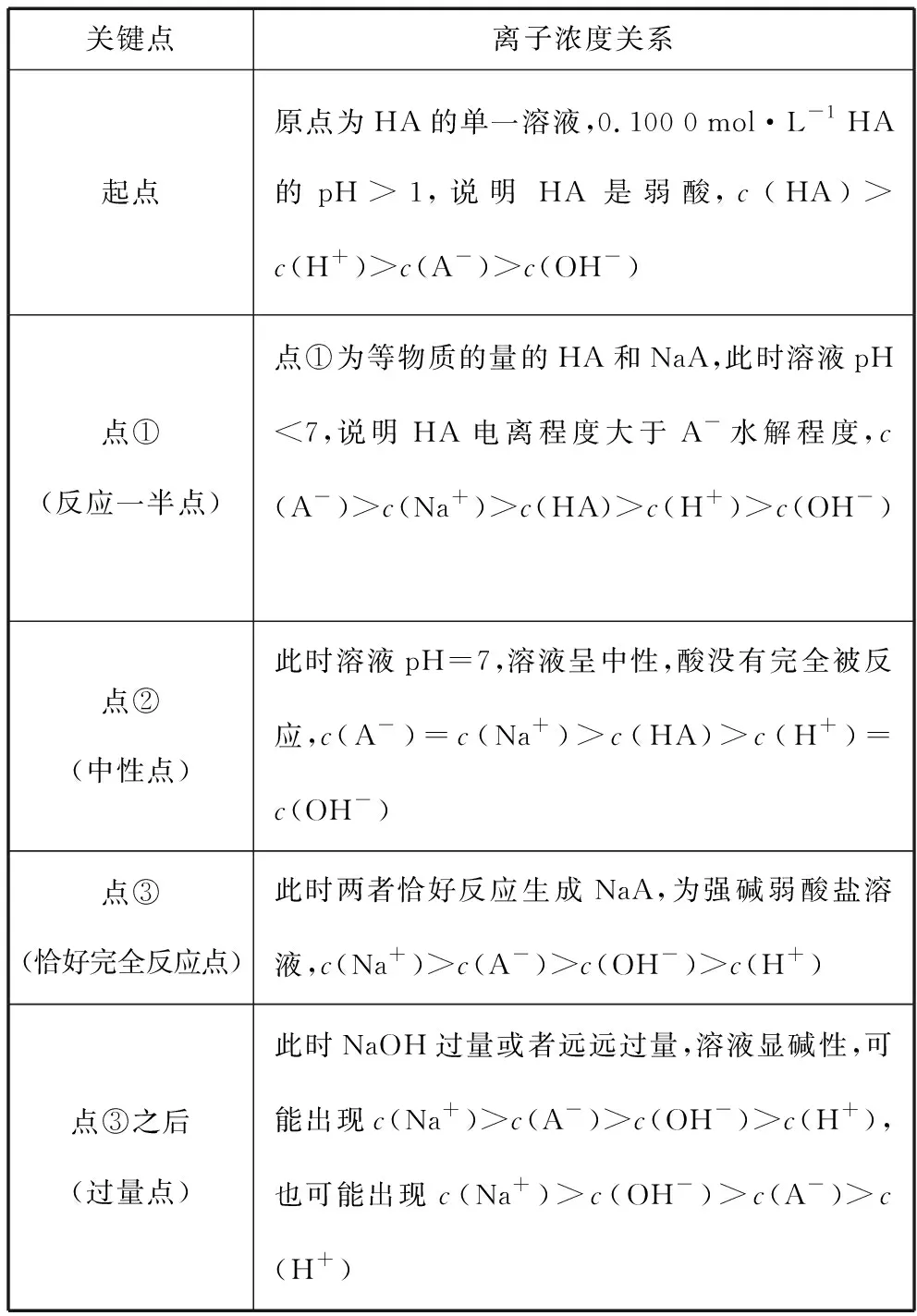
关键点离子浓度关系起点原点为HA的单一溶液,0.100 0 mol·L-1 HA的pH>1,说明HA是弱酸,c(HA)>c(H+)>c(A-)>c(OH-)点①(反应一半点)点①为等物质的量的HA和NaA,此时溶液pH<7,说明HA电离程度大于A-水解程度,c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) 点②(中性点)此时溶液pH=7,溶液呈中性,酸没有完全被反应,c(A-)=c(Na+)>c(HA)>c(H+)=c(OH-) 点③(恰好完全反应点)此时两者恰好反应生成NaA,为强碱弱酸盐溶液,c(Na+)>c(A-)>c(OH-)>c(H+)点③之后(过量点)此时NaOH过量或者远远过量,溶液显碱性,可能出现c(Na+)>c(A-)>c(OH-)>c(H+),也可能出现c(Na+)>c(OH-)>c(A-)>c(H+)
四、实例剖析
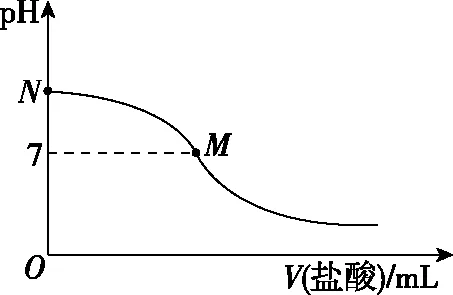
【例1】(2016·全国卷Ⅰ·12)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是
( )
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
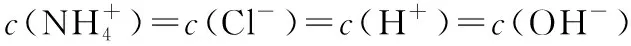
D.N点处的溶液中pH<12
【答案】D
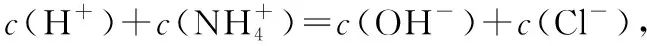
【点评】本题考查酸碱中和滴定、弱电解质的电离以及离子浓度大小比较等知识。酸碱中和滴定是中学化学的重要实验,通常是用已知浓度的酸(或碱)来滴定未知浓度的碱(或酸),由于酸、碱溶液均无色,二者恰好反应时溶液也没有颜色变化,所以通常借助指示剂来判断,指示剂通常用甲基橙或酚酞,而石蕊溶液由于颜色变化不明显,不能作中和滴定的指示剂。酸碱恰好中和时溶液不一定显中性,通常就以指示剂的变色点作为中和滴定的滴定终点,尽管二者不相同,但在实验允许的误差范围内。进行操作时,要注意仪器的润洗、查漏、气泡的排除,会进行误差分析与判断。判断电解质溶液中离子浓度大小时,经常要用到三个守恒:电荷守恒、物料守恒、质子守恒,会根据相应的物质写出其符合题意的式子,并进行叠加,得到正确的算式。掌握水的离子积常数的计算方法、离子浓度与溶液pH的关系等是本题解答的关键所在。本题难度适中。
【例2】(2017·全国卷Ⅰ·13)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
( )
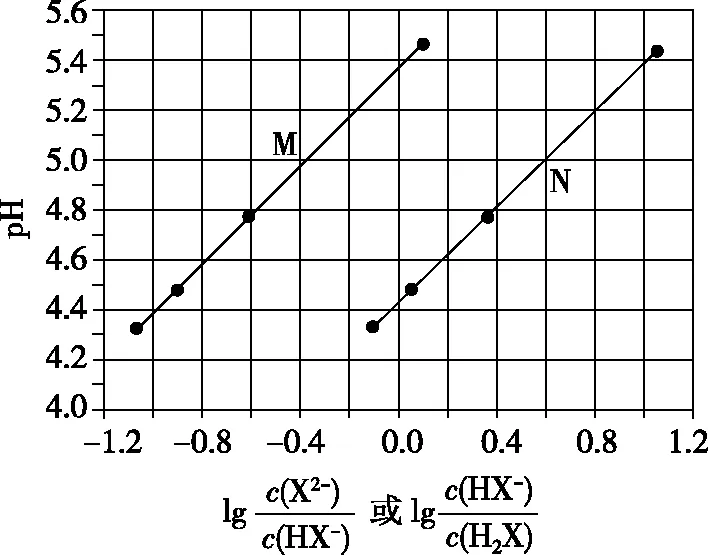
A.Ka2(H2X)的数量级为10-6
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
【答案】D

【点评】该题综合性强,该题解答时注意分清楚反应的过程,搞清楚M和N曲线表示的含义,答题的关键是明确二元弱酸的电离特点。电解质溶液中离子浓度大小比较问题,是高考热点中的热点。多年以来全国高考化学试卷几乎年年涉及。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握程度以及对这些知识的综合运用能力。围绕盐类水解的类型和规律的应用试题在高考中常有涉及。解决这类题目必须掌握的知识基础有掌握强弱电解质判断及其电离、盐类的水解、化学平衡理论(电离平衡和水解平衡)、电离与水解的竞争反应、化学反应类型以及化学计算,甚至还要用到“守恒”来求解。
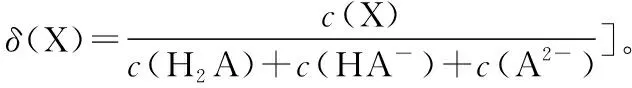
( )
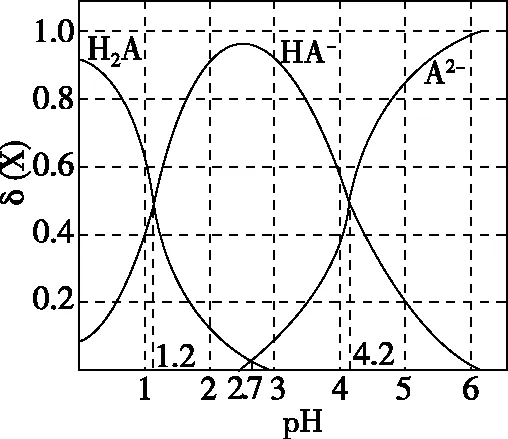
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
【答案】D

五、考情预测
本考点是高考的必考内容,预测2020年高考将更加注重知识的应用,以典型元素化合物为载体,结合离子共存,以图象、图表形式进行综合考查。2020年要特别关注溶液稀释、水的电离、pH的计算与判断、粒子浓度比较等。
【预测1】25℃时,向50 mL含有0.1 mol Cl2的氯水中滴加2 mol·L-1的NaOH溶液,得到溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是
( )

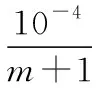
B.若x=100,b点对应溶液中c(OH-)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中c(OH-)-c(H+)=2c(Cl-)+c(HClO)
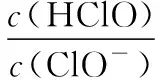
【答案】C
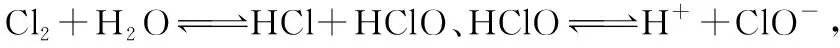
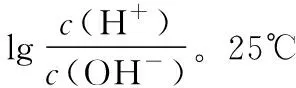
( )
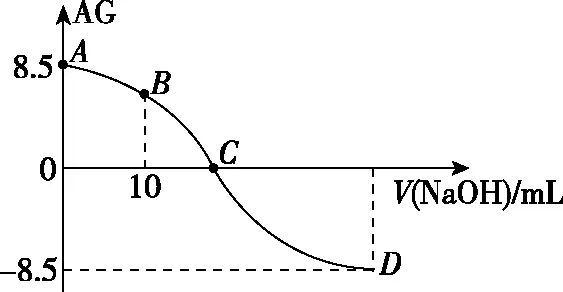
A.D点溶液的pH=11.25

C.C点时,加入NaOH溶液的体积为20 mL
D.25℃时,HNO2的电离常数Ka=1.0×10-5.5
【答案】A