多视角剖析离子平衡“前世今生” 巧破高考化学“拦路虎”
湖南 周学兴
离子平衡选择题,是高考热点、难点,该类型题具有较好区分度,能够较好地考查学生的创新能力、思维方法。纵观近年高考真题,该类习题具有规律性、基础性、区分度强的特点,笔者从呈现形式、图象类型、考查内容等多视角剖析离子平衡的考查规律,并尝试对2020届高考进行一定的预测,以期为高三复习过程中的教师、学生提供一定的复习方向。笔者还介绍了“定量分析”“溶质分析法”在解决离子平衡图象题中的运用。
1.多视角剖析 窥命题规律
1.1 呈现形式多变
离子平衡题是高考必考题型,选择题对离子平衡的考查常作为压轴题呈现,具有较好的区分度,难度较大。从信息呈现形式的角度分析,离子平衡选择题主要有文字叙述类、图象分析类,近十年具体考查情况见表1。
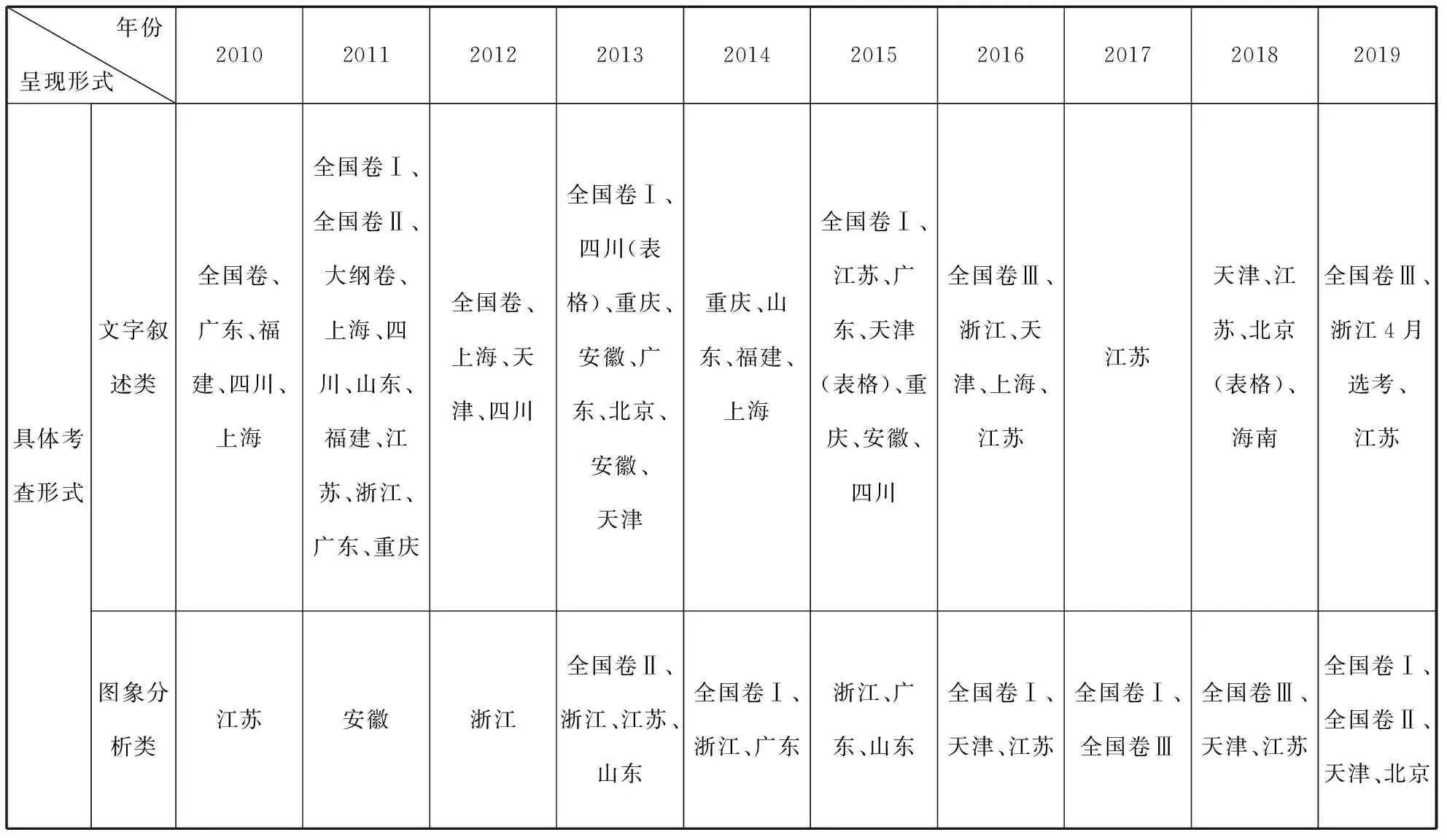
表1 近十年离子平衡选择题的考查情况
由表所述,不难发现,离子平衡选择题在呈现形式上,由以文字叙述类为主,逐步转变为以图象分析类为主,符合新课程标准、考纲不断修订的目的。
1.2 考查内容变迁
人教版选修4《化学反应原理》中的离子平衡内容主要包括电离平衡、水解平衡、沉淀溶解平衡等方面。纵观各省市高考真题关于离子平衡的考查,不难发现高考真题中离子平衡内容的考查主要建立在酸碱中和、酸碱稀释、沉淀溶解或生成等方面。其中近六年全国卷、北京卷、江苏卷、浙江卷、天津卷关于离子平衡选择题考查内容具体情况见表2。

表2 近六年部分地区真题考查内容情况汇总
1.3 图象信息多变
由表2不难发现,近年考查离子平衡选择题中图象信息主要有滴定曲线、分布分数曲线、导电率曲线、稀释曲线等形式。曲线的数目有单曲线、多曲线等情况。命题者还在数据处理上,进行对数处理,以让曲线转变为直线图象。这些发现为高三化学复习离子平衡指引了方向,选题时要注重题型的全方位落实。
1.4 解题策略初探
离子平衡选择题难度相对较大,是学生所面对的高考化学题的“拦路虎”,笔者从定性角度(溶质分析法)、定量角度剖析离子平衡题的解题思路,能够高效突破该类题型。
1.4.1 定性角度
离子平衡题,研究的对象是“某”溶液,该溶液可能是单一溶质或混合溶质,对溶质的认识是该类习题的解题关键。笔者将利用溶质来分析离子平衡相关考查的思路称为“溶质分析法”。溶质分析法的目标是明晰溶质及比例关系,反应方程式的分析成为该法的关键。面对图象题时,需要重点分析的是恰好反应点、1∶2、2∶1等特殊点的溶质。
【小试牛刀】
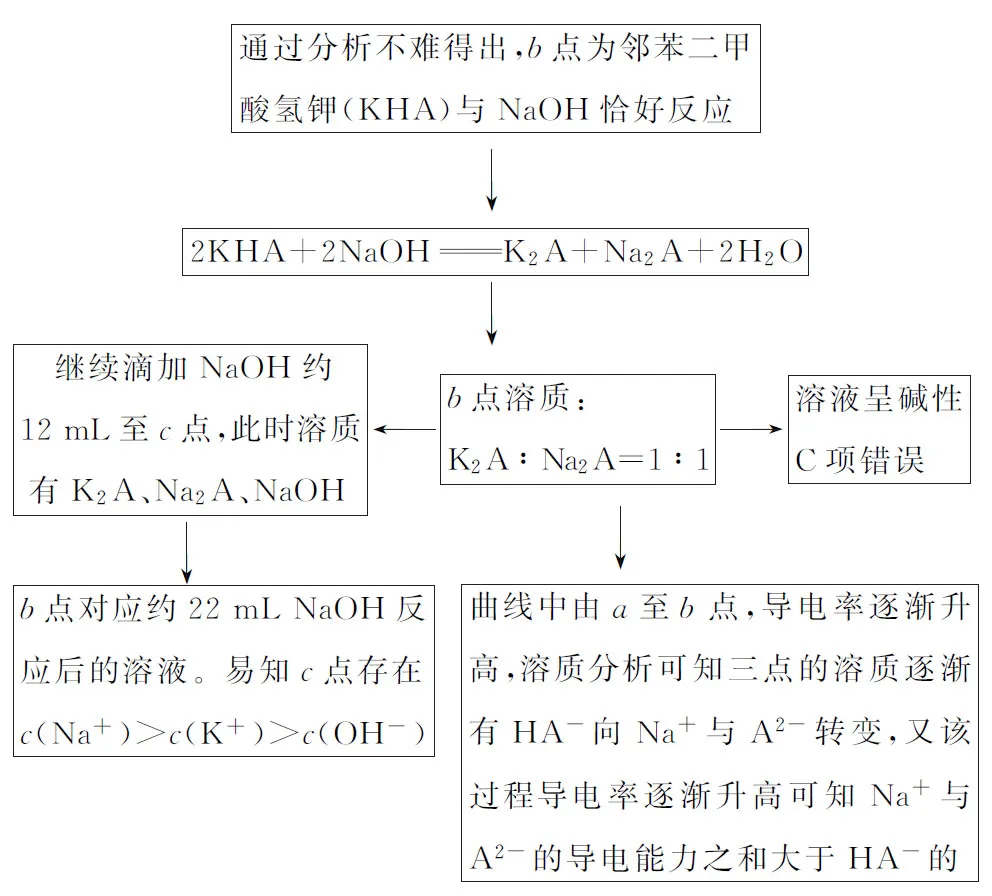
【例1】(2019·全国卷Ⅰ·11)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图1所示,其中b点为反应终点。下列叙述错误的是
( )
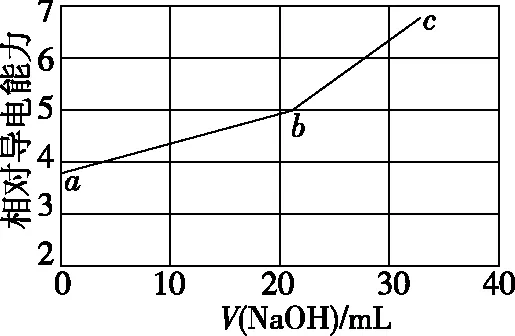
图1
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
【解题思路】
1.4.2 定量角度
定量,顾名思义,即“计算”,计算离不开离子平衡常数的运用。笔者提出构建“三步法”,巧解离子平衡常数相关计算:
第一步:书写平衡方程式——电离平衡、水解平衡、难溶电解质的溶解平衡等方程式
第二步:书写平衡常数表达式——包含题给常数和待求常数、浓度商
第三步:利用题给数据或者图象中关键点代入表达式——常常需要数形结合分析(数学思维)
通过习题的训练,构建三步法巧解离子平衡常数相关计算。
【例2】(2017·全国卷Ⅰ·13)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图2所示。下列叙述错误的是
( )

图2
A.Ka2(H2X)的数量级为10-6
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
【解题思路】
定量角度:
该题难度较大。表面上看考查酸碱中和滴定,通过进一步观察横坐标及选项可知该题主要考查己二酸电离常数。
运用三步法对电离常数进行计算,可快速解决所有选项,可进一步巩固定量计算在离子浓度大小比较等方面的运用。

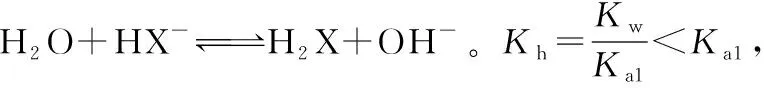
从定量计算的角度,更能锻炼学生的理科思维,也是该题的证据论证,有助于学生化学学科核心素养的培养与提高。
溶质分析法:
C项:溶液中阴离子X2-为主要成分时,一定呈碱性,但当c(X2-)=c(HX-)时,溶液呈酸性,故只有HX-才可能让溶液呈酸性,故C项正确。
D项:当c(X2-)=c(HX-)时,溶液呈酸性,HX-以电离为主,则应该X2-更多一些时,才可能是中性,故D项错误。
定性的角度更能快速解决这道难题,但是在学习过程中,并非仅为了应试,而是从多角度领略化学的魅力,理解宏观与微观的关系,了解化学反应过程中的真实变化。而且还可以活跃学生思维,培养学生的创新意识,培养学生辩证哲学观。
不难发现定性角度中,为了比较微粒浓度的大小关系,需要对溶质进行定量比例的分析,但并不需要将离子浓度具体算出来或利用平衡常数进行分析。
2.多视角命题预测
2.1 捕捉课标考纲新动态
2019年4月8日教育部发布《关于做好2019年普通高校招生工作的通知》深化考试内容改革。2019年高考命题要充分体现德智体美劳全面发展要求,以立德树人为鲜明导向,减少单纯死记硬背的知识性考查,推动学生关键能力和核心素养在教学和考试中的落地落实,助力高中育人方式改革。高考命题的基本框架,见图3。
图3 高考命题基本框架
2019年教育部考试中心命制的高考化学试题包括全国卷Ⅰ、Ⅱ、Ⅲ理科综合能力测试卷及全国Ⅳ化学试卷(海南化学卷),共四套试卷,供26个省区使用。四套高考化学试题积极贯彻落实全国教育大会精神,以高考评价体系为指导,对接高中化学课程标准,链接化学学科核心素养,落实高中育人方式改革理念,突出对应用实践能力和创新思维能力的考查,发挥高考积极的育人选人功能,积极推动新时代高考内容改革。与4月8发布《通知》高度一致。关注教育部对高考的相关部署通知,才能更好把握命题动态。
2017版普通高中化学课程标准指出“通过对电离平衡、水解平衡、沉淀溶解平衡等存在的证明及平衡移动的分析,形成发展学生的微粒观、平衡观、守恒观”。
这要求在复习过程中,注重学生素养能力的培养,“三观”的构建,强化对水溶液中“四大平衡”的精准掌握。比如掌握水溶液中微粒的组成及关系、溶液中存在的平衡对微粒的影响及外界影响因素对平衡的影响、微粒之间存在一定的守恒关系。
2.2 捕捉能力增长点视域
立足高中教材,精准把握大学教材中的能力增长点。涉猎大学一年级教材发掘新素材考查高中化学知识,适当进行拓展,精准把握高中知识的能力增长点。笔者认为大学一年级教材中实验部分、元素知识、热化学基础、动力学基础、沉淀平衡、配位平衡、电化学基础、有机化学基础中一些经典的有机反应等是值得去挖掘素材的,同时关注科学前沿研究,开阔视野。部分总结见表3。

表3 符合学生能力增长点的大学教材内容
笔者认为立足大学教材,展开命题,具有一定的基础性、创新性。
比如:以沉淀溶解平衡曲线为载体展开命题。


图4
下列说法正确的是
( )
A.Ksp(Ag2CrO4)=10-10.7
B.区域Ⅰ表示两者均不能沉淀
C.区域Ⅱ表示只有AgCl沉淀产生
D.用AgNO3标准溶液滴定Cl-时,可用K2CrO4溶液作指示剂
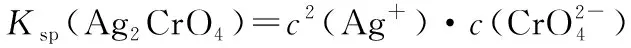
图形的精准制作,减少了客观的困扰因素,增加了数据的真实性、准确性,提高了试题的质量。

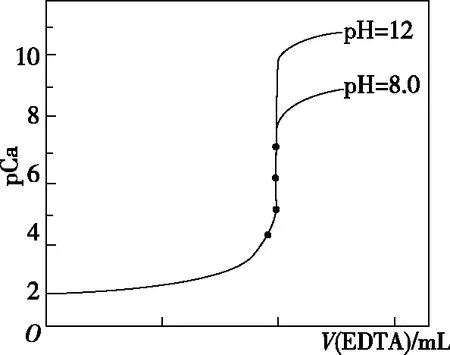
图5
下列说法错误的是
( )
A.由图象可知,Ca2+的初始浓度为10-2mol/L
B.滴定终点时,消耗EDTA标准溶液20.00 mL
C.若含Ca2+溶液的pH发生改变,滴定曲线突变范围不变
D.pH=12时,滴定终点的c(Ca2+)=10-6.49mol/L
2.3 省市新题助力复习效率
江苏、浙江两省及北京的题型一直比较新颖,对全国卷的命题存在一定的影响,应该注重江浙两省命题的认识。以期对全国卷地区复习给予正确的指导。由表1,不难发现,全国卷对离子平衡内容的考查相比江苏、浙江、北京等地的命题而言,更具有基础性,在一定程度上对三地的试题具有一定传承和创新。部分情况见表4。

表4 全国卷与江苏、浙江、北京等地的试题的联系示例
此外,导电率的图象,往往是通过手持技术等仪器描绘测定的,试题具有真实性。很好地体现了素养立意、真实情境创设的高考命题基本原则。
3.结语
笔者从命题规律、命制等多视角对离子平衡选择题进行了阐述,不一定全面,仅一家之言,希望对高三复习的教师、学生有一定的指导意义。2020年高考化学试题将进一步全面落实党的教育方针,弘扬爱国主义精神,深入考査化学观念、思维方法,聚焦实践与创新能力,全面落实高中化学课程标准中的情境教育理念,体现化学学科的育人功能,有利于推进基础教育课程改革和高考内容改革。

