硫化物的性质及复习导引
河北 韩万中
在无机化学中,与氧化物类似的化合物是硫化物。硫化物是指硫与电负性比其小的金属或非金属元素形成的二元化合物,由于S元素的电负性比O元素的电负性小,存在多种氧化态的物质,在硫化物中显低氧化态,而在氧化物中相应元素可表现最高氧化态。例如,自然界中铁与氧形成Fe2O3(赤铁矿)、与硫形成FeS2(黄铁矿);铅与氧、硫则分别形成PbO2、PbS(方铅矿)。
在人教版必修1中,介绍硫溶解性时提及了有机溶剂CS2,CS2也是选修3学习等电子原理、相似相溶原理的常用素材;书中也从毒性、环保角度介绍了“著名”的非金属硫化物H2S,并笼统地指明某些硫化物与酸反应可生成H2S;必修2中介绍了利用Cu2S进行火法炼铜的化学反应,让学生体会化学在自然资源开发和利用中的价值;选修4指出H2S和Na2S常用作金属离子的沉淀剂,还特别强调Ag2S、HgS及CuS等金属硫化物的极难溶性。必修1中,在介绍金属单质的化学性质时,指出金属单质可与硫化合,“含蓄”地说明了实验室制备金属硫化物的方法原理;在选修4中,从物质溶解性变化规律讲述了矿物铜蓝(CuS)的形成过程,启发学生从溶解平衡移动视角领悟地质作用中的化学变化。
硫化物是硫元素形成的一类重要化合物,是常见无机物知识框架的组成部分。《普通高中化学课程标准(2017年版)》明确指出:能从物质类别角度或借助元素周期表,预测物质的化学性质和变化;结合真实情境中的应用实例和实验探究,了解硫及其重要化合物的主要性质。同时,还给出了“ZnS与Ag2S沉淀的转化”“火山喷发含硫物质的转化”等情景素材建议,帮助学生理解化学知识,启迪科学思维,促进学生化学学科素养的形成和发展。但是,硫化物虽为一种物质类别,因其零星分布在教材的不同模块,常被一些学生甚至老师忽略。因此,高三复习设置硫化物主题是必要的,通过设置必要的问题情景,以硫化物类型为主线,强化其结构、性质及其反应原理的整合融通,并架通与氧化物、酸、碱和盐之间的横向联系,促使学生形成元素化合物知识的结构化、功能化和素养化。
一、非金属硫化物
H2S是最常见的非金属硫化物,它的熔沸点比同族的H2O、H2Se和H2Te都低,其原因可从分子间作用力的类型及其大小分析;其稳定性低于同周期的HCl和同主族的H2O,体现“位-构-性”认知模型的运用;H2S中的硫为-2价,是硫的最低化合价,具有较强的还原性,可燃烧,能被Cl2、Br2、KMnO4、浓H2SO4等大多数氧化剂氧化,其水溶液在空气中放置后变浑浊就是空气中O2将H2S氧化为游离态的硫造成的。自然界中游离态硫易在火山地区出现,是因为H2S常含于火山喷射气中,被空气氧化形成自然硫。
H2S可作沉淀剂,能使溶液中某些金属离子形成硫化物沉淀,H2S中毒就是由于它与血红素中的Fe2+作用形成FeS沉淀,从而使Fe2+失去原来正常的生理作用。
【例1】某溶液中含有Fe2+、Al3+、Ag+、Cu2+,为了分别得到各含一种金属阳离子的沉淀,可采取:①通入H2S;②通入CO2;③加盐酸;④加NaOH溶液4个步骤。设试剂均过量,且每次都把所生成的沉淀过滤出来。其正确的操作顺序是
( )
A.③①④② B.①③④②
C.④②①③ D.④②③①
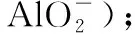

上述数学推演虽然不是高三复习备考的主流定量分析,也不必让每一位学生都掌握,但通过这样的计算探究,有理有据,逻辑清楚,疏通了结论形成的因果关系,有利于克服老师硬下结论、学生死记结论的弊端。
二、金属硫化物
碱金属硫化物和BaS易溶于水,CaS、MgS微溶于水,除此之外,大多数金属硫化物难溶于水,如CuS、HgS、Ag2S等极难溶于水。金属硫化物的溶解性特点在生成、科研和环保领域具有一定的应用价值。
【例2】(2014·四川·11·节选)某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜,镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
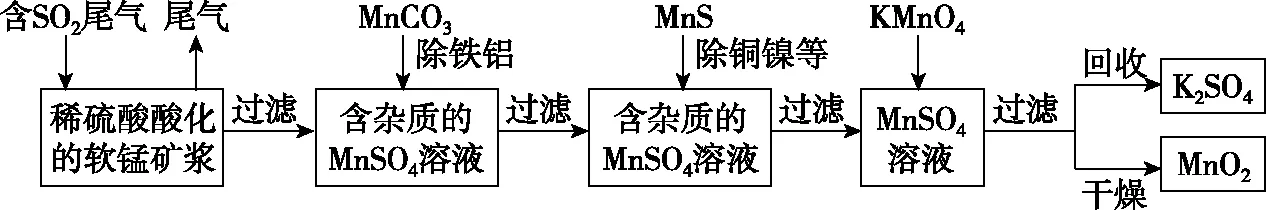
上述流程图中的MnS是怎样去除铜镍杂质的呢?

上述过程是一种沉淀转化为另一种沉淀的过程,实质是沉淀溶解平衡的移动。至此,教师可引导学生依据推理过程和数据结果得出结论:一种沉淀可以转化为更难溶的沉淀,两者的溶解能力差别越大,这种转化的趋势就越大。

【例3】(2019·全国卷Ⅱ·26节选)立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:

(1)在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为____________________。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为____________________。
(2)在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的________(填化学式)。
(3)沉淀器中反应的离子方程式为_________________
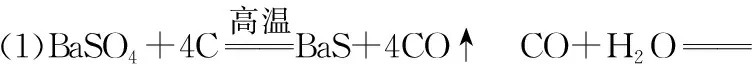
(2)BaCO3


【例4】某同学为试验CuS在不同酸中的溶解性,取4份黑色CuS粉末试样置于试管中,分别加入醋酸、浓盐酸、浓硫酸、浓硝酸溶液。观察到如下现象:①CuS不溶于醋酸溶液;②CuS不溶于盐酸;③CuS不溶于浓硫酸;④CuS在稀硝酸中溶解,在试管上方产生浅红棕色刺激性气味气体。根据上述现象,该同学得出了以下结论,其中正确的是
( )
A.CuS不溶于弱酸,能溶于强酸
B.CuS不溶于非氧化性酸,能溶于氧化性酸
C.CuS溶于硝酸,是因为S2-结合硝酸中的H+,放出H2S气体,使溶解平衡往溶解方向移动
D.CuS溶于硝酸,是因为硝酸将S2-氧化,使溶解平衡往溶解方向移动
【答案】D
【解析】CuS能溶解于硝酸,而不溶于盐酸和浓硫酸,说明CuS的溶解与酸性强弱无关,A选项错误;浓硫酸和硝酸均为氧化性酸,B选项错误;依据CuS溶于硝酸的实验现象,可知反应属于氧化还原反应,C选项错误;硝酸将S2-氧化,破坏了CuS的溶解平衡,只要硝酸足量,CuS可以全部溶解,D选项正确。
至此,善思考、爱质疑的学生可能会问:第一、硝酸能将S2-氧化,从而“拉动”平衡向着溶解方向移动,同样具有强氧化性的浓硫酸为什么不能溶解CuS呢?第二、既然CuS溶于硝酸是因沉淀溶解平衡正向移动,那么盐酸中的H+结合S2-生成H2S气体,为什么不能促使CuS的溶解平衡向溶解方向移动呢?

复习建议:建构硫化物知识框架和性质分析模型。对于可溶性硫化物,以Na2S为代表物,从S2-出发分析它的碱性、水解性、沉淀性和还原性等化学性质,体现微粒观(见图1)。对于难溶性金属硫化物,既要关注它的高温下的活性,如氧化焙烧,体现条件观;也要关注它的酸溶。它们在酸中的溶解程度与Ksp大小有关,能否溶解可用耦合后反应的ΔrGө(或多重平衡常数)衡量,体现定量观;Ksp越小MS越难溶,则向M2+的可溶性盐溶液中通入H2S气体则越容易析出MS沉淀来,体现辩证观;无论在何种类型的酸中通过不同的途径形成可溶物均涉及沉淀溶解平衡的移动,体现平衡观(见图2)。

三、多硫化物




电池充电时间越长,电池中Li2S2的量越________(填“多”或“少”)。
【答案】少



高三复习是对所学知识的二次学习和加工整合,基于这点,教师应将有关硫化物的复习放在课本知识的基础上,以培养学生学科素养为目的,构建其理化性质和应用为情景主线,来激活新信息和旧经验的触点,搞清它与其他含硫化合物的相互转化关系,强化化学反应原理的应用和迁移,提升学生解决特定问题所需要的关键能力和思维品质水平。

