教学考试杂志社“优师计划”阶段性成果展示——工艺流程相关试题选登
【例1】重铬酸钠为红色至橘红色结晶,有强氧化性,易溶于水。可以采用辉铋矿和含铬废渣用以下工艺制备。
已知:①辉铋矿主要成分是Bi2S3,还含少量SiO2等杂质,含铬固体废渣主要成分为Al2O3·Cr2O3,还含有FeO、SiO2。
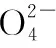
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
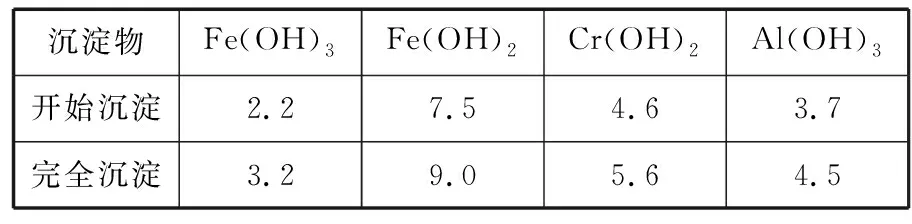
沉淀物Fe(OH)3Fe(OH)2Cr(OH)2Al(OH)3开始沉淀2.27.54.63.7完全沉淀3.29.05.64.5
回答下列问题:
(1)Ⅰ加H2O2并调节pH目的是_________________
(2)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,辉铋矿中Bi2S3与FeCl3溶液发生反应,该反应的氧化剂和还原剂之比________;加入盐酸,既可提高铋的浸出率,又可________;辉铋矿和FeCl3溶液、盐酸反应后滤渣主要成分是________和硫。
(3)NaBiO3是为数不多的钠盐沉淀之一,由BiCl3制得纯净的NaBiO3,操作Ⅳ包括________。
(4)写出Ⅱ中发生反应的离子方程式:_________________
(5)Ⅲ中酸化是用硫酸而不用盐酸酸化,理由是
(结合化学方程式回答)。
(6)NaBiO3可作为钢铁分析中测定锰的氧化剂,利用原子守恒确定缺项物质及其他物质的化学计量数。
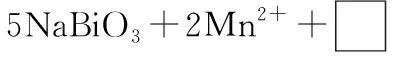
【答案】(1)使Fe2+转化为Fe3+,调整pH,使Fe3+和Al3+完全沉淀,与铬元素完全分离
(2)6∶1 抑制溶液中Bi3+的水解 SiO2
(3)过滤、洗涤、干燥
(6)14H+7H2O
【命题意图】本题考查化工流程,涉及知识流程图分析、氧化还原反应方程式的书写、反应条件控制、溶度积运用。考查提取信息能力、理解和简单应用、关联和迁移能力、推理和论证能力、实验和探究能力。涉及证据推理与模型认知、科学探究与创新意识素养。

化工流程题实际上是考查考生运用元素化合物,化学实验,化学反应原理及相关知识来解决工业生产中实际问题的能力。化学工艺流程题结构一般包括题头、题干和题尾三部分。题头一般用引导性的语言,简单介绍该工艺生产的目的、原料、产品,有时还提供相关表格、图象等参考数据或物质的性质和用途信息。题干部分则是用框图形式将原料到产品的主要生产工艺流程表示出来。题尾部分则是命题者根据工业生产流程中涉及的化学知识精心设计的系列问题。对于学生解题需要的未学过的信息在三个部分都有可能出现,审题时须全盘考虑。解题的基本步骤是①审题:从题干中获取有用信息,了解生产的产品。②分析流程中的每一步骤,从几个方面了解流程:A.反应物是什么B.发生了什么反应C.该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为获得产品而服务。③从问题中获取信息,帮助解题。其流程主线可表示为原料→对原料的预处理→核心化学反应→产品的提纯分离→目标产物。
【例2】锂离子电池因其具备高能量密度、长使用寿命、无记忆效应、环境友好等特点而被广泛应用,然而锂资源匮乏制约了其发展,因此,开发新型储能器件迫在眉睫。与锂离子电池相似,钠离子电池由于成本低、资源丰富,成为取代锂离子电池在大规模储能领域应用的理想选择。作为钠离子的正极材料之一,束状碳包覆K3V2(PO4)3纳米线电极材料成为关注焦点之一。其制备工艺流程如图:
【资料】①石煤的主要成分为V2O3,含有Al2O3、CaO、Fe2O3等杂质。
②+5价钒在溶液中的主要存在形式与溶液pH 的关系:
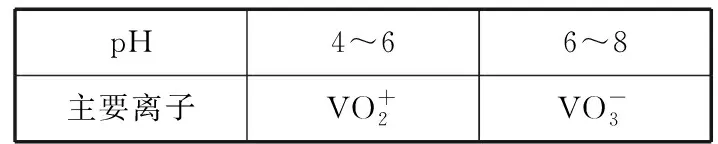
pH4~66~8主要离子VO+2VO-3
(1)K3V2(PO4)3中V的化合价为。
(2)焙烧时,向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2。
①为了提高焙烧过程中氧化效率,下述工艺步骤方法合理的是_________________
a.在回转窑进行富氧焙烧,助燃风气量为煤气量的0.5~2倍
b.焙烧过程中,焙烧物料加入辅助剂,增加物料疏松度和透气性
c.窑体进行分段控温
②焙烧过程中主要反应的化学方程式为_________________
(3)实验时将NH4VO3、KOH和H3PO4按物质的量分别为5 mmol 、7.5 mmol 、7.5 mmol依次溶解于20 mL 去离子水中,溶液颜色依次为白色浑浊、无色澄清透明和棕红色透明溶液。随后再加入H2C2O4·2H2O,搅拌至溶液变为黄绿色,草酸的量对 K3V2(PO4)3形貌的影响如下:

草酸的量01.0 g2.0 g4.0 g6.0 g12.0 gK3V2(PO4)3形貌杂乱的微米颗粒少量杂乱的纳米线有束状的形貌出现大部分为束状纳米线均一的束状纳米线纳米线的均一性较差
请回答:
①实验条件下束状碳包覆K3V2(PO4)3纳米线样品制备的最佳条件:
;
②亚硫酸钠是常用的还原剂,但实验中不能用亚硫酸钠代替草酸晶体,原因为_________________
(5) “氩气中煅烧”时,氩气的作用为_________________
(6)某工厂利用上述工艺流程,用10 t石煤生产束状碳包覆 K3V2(PO4)3纳米线0.806 4 t,若整个过程中钒的总回收率为80%,则石煤中钒元素的质量分数为。
【答案】(1)+3
(3)①草酸质量为6.0 g ②草酸在合成束状碳包覆纳米线的过程中起还原剂和导向剂的作用
(5)防止K3V2(PO4)3被氧化
(6)2.04%
【命题意图】本题以束状碳包覆 K3V2(PO4)3纳米线的制备、应用为载体,考查学生对流程的分析、分离提纯方法、解释试剂的选择、离子方程式的书写、含量计算等,呈现的内容可以引导学生自觉传承我国科学文化,弘扬科学精神,体现了科学探究与创新意识的学科核心素养。
解决本类题目的关键是分析流程中的每一步骤,可从以下几个方面了解流程:①反应物是什么;②发生了什么反应;③该反应造成了什么后果,对制造产品有什么作用。即抓住一个关键点:一切反应或操作都是为获得产品而服务的。
【例3】某硫铅矿(主要成分是PbS,含有杂质Fe2O3、Al2O3和SiO2),利用该硫铅矿制备金属铝和PbO2的流程如下:
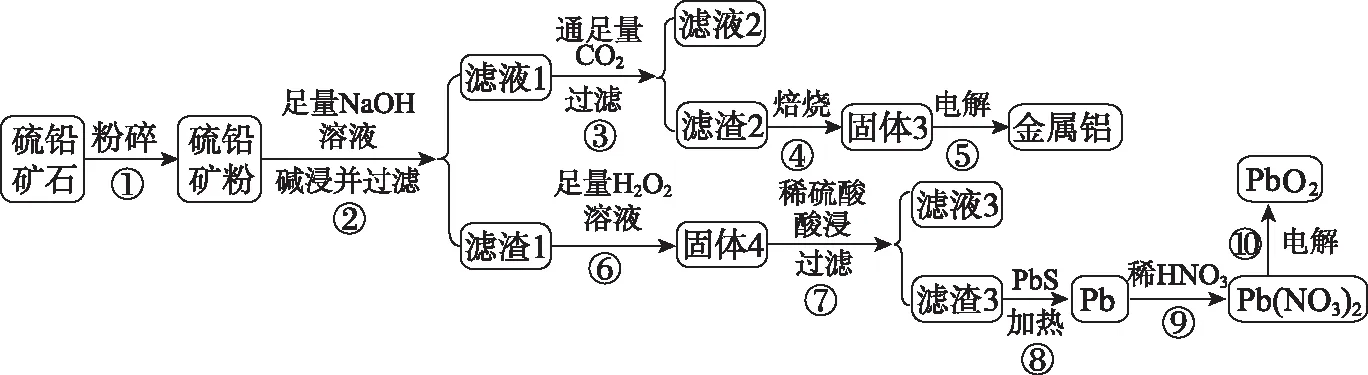
已知:ⅰ.PbS不溶于强碱溶液,但可以被H2O2氧化为PbSO4;
ⅱ.PbSO4与PbS共热可以产生Pb,铅可以和稀硝酸反应。
回答下列问题:
(1)步骤③通入足量CO2发生的与Al元素相关的离子方程式为________;滤液2的溶质为________。
(2)冶炼金属铝时需加入某种物质降低体系熔点以节约能量,该物质的名称为________。
(3)步骤⑥一般需控制较低温度的原因是____________。若将滤液3和步骤⑥的残液混合,会产生的现象是_________________
(4)步骤⑨的离子方程式为_________________
(5)若用铅蓄电池作为步骤⑩的外接电源,与铅蓄电池PbO2一极相连的电极的电极反应式为_________________
(2)冰晶石(或六氟合铝酸钠)
(3)防止H2O2受热分解 产生大量气泡

【命题意图】本题考查工艺流程综合知识,考查考生设计、评价、优选的能力,提升考生掌握、迁移、灵活应用的素养。
【解析】该流程的推断过程如下:
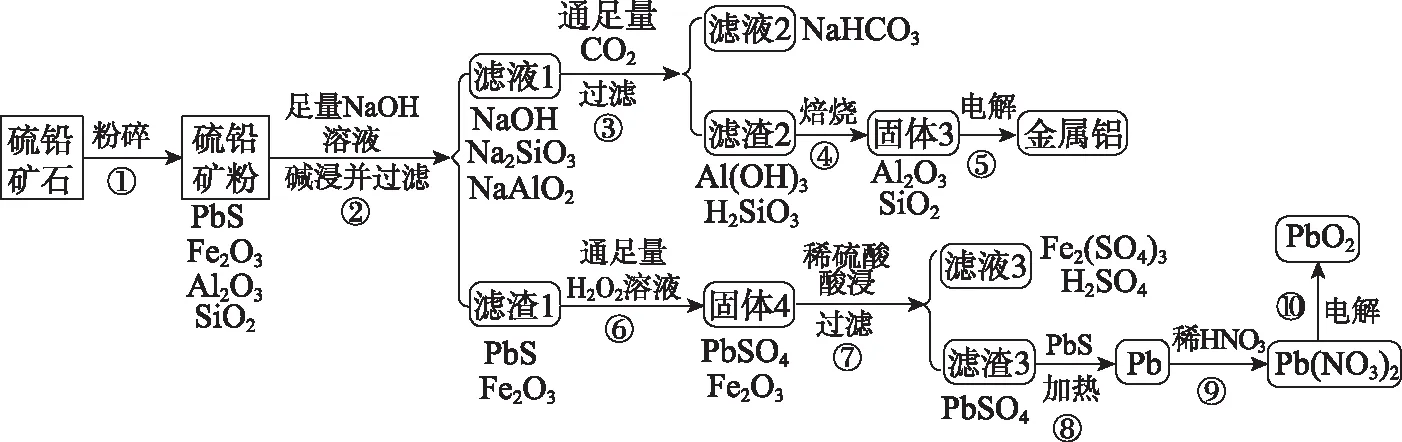
(1)向NaAlO2溶液中通入足量CO2得到Al(OH)3和NaHCO3,根据原子守恒和电荷守恒配平即可;NaOH和Na2SiO3溶液中通入足量的CO2也得到NaHCO3溶液,故滤液2的溶质仅有NaHCO3。(2)由于氧化铝的熔点高,冶炼过程为了降低体系熔点,节约能量,需加入冰晶石即Na3AlF6,其学名为六氟合铝酸钠。(3)H2O2受热易分解,故有H2O2参与的化学反应都需控制低温环境;滤液3中含有Fe3+,步骤⑥的残液中含有H2O2,Fe3+会催化H2O2分解,产生大量O2。(4)Pb被氧化为Pb2+,稀硝酸被还原为NO,根据化合价升降相等配平即可。(5)铅蓄电池中PbO2为正极,与之相连的一极为阳极,该极Pb2+被氧化为PbO2,用H+保证电荷守恒,用水保证H和O原子守恒即可配平电极反应式。

