肝细胞癌介入治疗术后并发肿瘤溶解综合征的诊断及治疗(附9例报告)
王京艳,周霖,余强,王华明
中国人民解放军总医院第五医学中心,北京100039
肿瘤溶解综合征(Tumor Lysis Syndrome, TLS)是肿瘤细胞大量溶解,快速释放细胞内物质,导致人体发生代谢异常和电解质紊乱[1]。既往报道[1~6],TLS多见于白血病、淋巴瘤、多发性骨髓瘤等血液系统肿瘤经全身化疗治疗后患者,发病率高达25%[7],偶见于生长速度较快或对治疗敏感的实体肿瘤患者,如肝脏神经内分泌肿瘤[8]、肝细胞癌(Hepatocellular carcinoma ,HCC)[9]等。目前关于HCC肿瘤介入治疗后并发TLS的相关报道较少。我们回顾性分析了9例肿瘤介入术治疗合并急性TLS的HCC患者临床资料,探讨TLS的临床特点、诊断及治疗等。
1 临床资料
选取2013年1月~2019年12月间解放军总医院第五医学中心肿瘤介入治疗科收治的HCC患者9例,其中男8例、女1例,年龄43~71岁,平均52岁;24 h尿量1 000~2 000 mL;均经病理或影像学检查,符合原发性肝癌的诊疗规范明确诊断为HCC;肿瘤直径(12.59±3.68)cm;8例为慢性乙型病毒性肝炎(CHB);Child-Pugh分级为A级6例、B级3例;5例合并高血压,1例合并2型糖尿病,1例同时合并高血压病及2型糖尿病;7例存在门静脉癌栓(PVTT),其中3例合并右支癌栓,3例合并主干癌栓,1例同时合并主干和右支癌栓;1例出现肺转移,1例出现腹膜后淋巴结转移瘤。9例患者中,7例接受经导管肝动脉化疗栓塞术(Transcatheter hepatic arterial chemoembolization,TACE)治疗,1例接受了经皮射频消融(Radiofrequency ablation, RFA)治疗,1例接受了肝动脉栓塞(Transcatheter hepatic arterial embolization, TAE)联合RFA治疗。
术后第2天,3例患者24 h尿量<400 mL,9例患者血清尿素氮(BUN)、肌酐(CR)、尿酸(UC)、钾(K)、磷(P)水平均升高,钙(CA)及甲胎蛋白(AFP)水平明显降低,确诊为TLS,进行静脉补液水化、应用利尿剂、纠正电解质紊乱、连续性肾脏替代治疗(Continuous renal replacement therapy, CRRT)后,术后第7天,纳入者血清各项指标均明显好转。术前及术后第2、7 天时9例患者肝肾功能及电解质指标水平见表1。
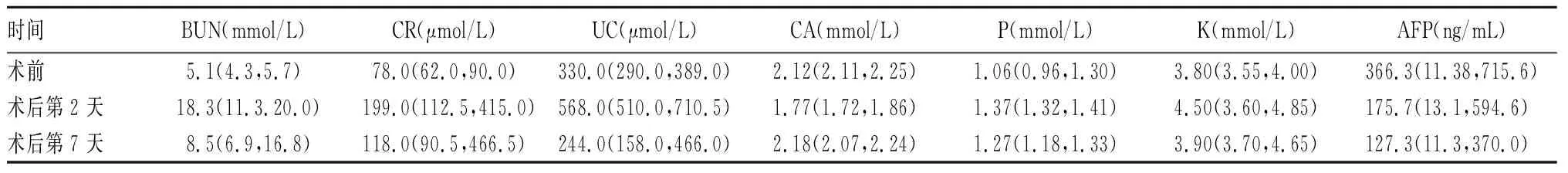
表1 术前及术后第2、7 天时9例患者肝肾功能及电解质指标水平[M(P25,P75)]
9例患者术后第2、7天血清AFP水平下降,说明肿瘤对治疗敏感。其中1例患者术前腹部增强CT检查可见肝左右叶交界处可见7.2×4.2 cm巨块型病灶,有明显包膜,血供丰富,TAE术中给以将微导管选择性置于肝右及肝左动脉肿瘤供血血管处,再次造影肿瘤染色清晰,经微导管缓慢漂注超液态碘化油,术后即刻行以CT引导下RFA治疗,联合治疗第20天时腹部平扫CT可见肿瘤组织内多发碘油沉积,肿瘤内片状坏死。
2 讨论
TLS是指肿瘤负荷重、对治疗极其敏感的恶性肿瘤经过化疗、放疗以及其他诊疗手段治疗后出现的肿瘤组织崩溃溶解,肿瘤细胞大量破坏,导致细胞内容物快速释放,引起机体内电解质紊乱及代谢异常的代谢紊乱[1],主要临床表现为高钾血症、高尿酸血症、高磷血症、低钙血症,同时伴有肾功能不全及代谢性酸中毒等[2]。由于肝癌细胞对化疗药物抵抗的特性,HCC并发TLS的病例比较罕见,既往关于HCC相关的TLS有自发性、TACE治疗术后、RFA术后、索拉菲尼靶向药物治疗术后等[9~12]。
TLS是肿瘤科常见的急症,早发现、早诊断、早治疗有利于降低患者的病死率。HCC患者并发TLS的高危因素包括:①肿瘤负荷过重(直径>10 cm)、生长速度过快导致肿瘤细胞代谢产物增多,而机体清除代谢产物能力不足;②肿瘤细胞对化疗药物或抗肿瘤药物或治疗措施敏感,肿瘤细胞迅速凋亡;③乳酸脱氢酶升高(>2倍参考值上限);④白细胞计数升高(>25×109/L)[3,4,13]。TLS的发病机制是凋亡的肿瘤细胞释放大量的核酸物质、钾、磷、细胞因子等入血,核酸的代谢终产物尿酸增多,超过了肾脏排泄的能力,从而导致这些物质在血液中蓄积,并在肾小管沉积造成急性肾功能衰竭;高钾血症可能导致严重的低钙血症、心律失常;细胞因子可能造成全身炎症反应综合征、多器官功能衰竭,进而危及患者生命,甚至导致死亡[1,2]。
临床上TLS多于初始治疗后12~72 h出现症状,可表现为:①肾功能受损导致的排尿困难、腰痛、血尿、少尿或无尿等;②低钙导致的恶心、呕吐、痉挛、抽搐甚至意识障碍;③高钾所致的心律失常、心悸甚至心跳骤停、猝死等;④体液超负荷所致的水肿、浆膜腔积液、呼吸困难、心悸等[3,14]。
Cairo等[1]将TLS分为两种类型:临床 TLS(clinical TLS,CTLS)和实验室TLS (laboratory TLS,LTLS)。LTLS 是指在初始化疗前3天或化疗后7天内,出现≥2个以下代谢指标异常:①血UC≥476 μmol/L(或8 mg/dL)或增高25%基线水平;②血K≥6.0 mmol/L(或6 mg/L)或增高25%基线水平;③(儿童)血P≥2.1 mmol/L,(成人)≥1.45 mmol/L,或增高25%基线水平;④血Ca≤1.75 mmol/L或降低25%基线水平。CTLS是指在LTLS的基础上,合并≥1个以下临床表现:①血肌酐≥1.5倍经年龄校正的正常值上线;②发生危及生命的心律失常或猝死;③癫痫发作。
本研究9例患者中,患者肿瘤直径(12.59±3.68)cm,且均血供丰富,经治疗后肿瘤细胞迅速坏死,血清AFP水平迅速降低,故均有发生TLS的高危因素。其中1例患者于TACE术后第2~5天出现血肌酐、尿酸、尿素氮升高,合并血钾、血磷明显升高,血钙降低,达到了LTLS及CTLS的诊断标准。3例行CRRT的患者不同程度合并腹腔积液、感染、肝损伤,1例病死患者合并了肝衰竭、感染性休克、肾功能衰竭等多器官功能衰竭导致了最终死亡。另5例患者因无尿量减少,无急诊CRRT指征,经过及时的补液水化、纠正电解质紊乱、降尿酸等治疗后,也逐渐恢复。
HCC患者发现肾功能不全时,需将TLS与肝肾综合征相鉴别,如曾注射造影剂,也需与造影剂肾病相鉴别。三者在发病机制上完全不同,TLS是由于大量坏死肿瘤组织的代谢产物所致,肝肾综合征多发生于合并失代偿期肝硬化患者,多合并大量浆膜腔积液,导致肾脏相对血容量不足所致,也可能合并少尿、无尿、肾功能不全、高钾血症等,但经过补充血容量、白蛋白治疗后症状可逆[15]。造影剂肾病多于造影剂应用48~72 h后发生,表现为血肌酐升高≥0.3 mg/dL 或较基线值升高≥1.5~1.9倍,可能同时合并少尿、无尿、电解质紊乱、皮疹等[16]。三者治疗上均需大量补液水化、纠正电解质紊乱必要时行CRRT治疗,由于初期均有可逆性,故早期发现、早期诊断、早期治疗可大大改善患者的生存质量。
一旦发现TLS明确诊断,要及时干预,在密切监测尿量和各项指标的同时,给予大量补液、利尿、纠正电解质酸碱平衡紊乱、降尿酸(别嘌呤醇及拉布立酶)等[3~5],注意液体出入平衡,必要时可给予CRRT治疗,有助于迅速清除体内毒素,降低肾脏负担,缩短脏器功能恢复时间,降低死亡率。行CRRT的指征包括:出现无法控制的①严重的少尿(<100 mL/24 h)或无尿(<400 mL/24 h);②持续性高钾血症;③内科治疗无法改善的高磷血症诱导的低钙血症;④严重酸中毒和/或严重尿毒症伴中枢神经系统毒性;⑤容量过载引起的循环功能障碍等[1]。本文中9例患者均在术后第2~5天即明确诊断,及时给以补液、纠正电解质紊乱等治疗,3例及时给予CRRT治疗,治疗后尿量增多、血肌酐水平下降,停止CRRT治疗后患者尿量仍稳定、血肌酐水平仍持续下降,未发生严重的心律失常、癫痫等并发症,且术后随访,肾功能逐渐恢复正常水平,并无病情反复。
综上所述,对存在肿瘤负荷重、预计治疗敏感等TLS高危因素的HCC患者,应以预防TLS为主,治疗目的应该在尽量减少并发症或在并发症可耐受的前提下实施治疗,严禁单纯的为了治疗而治疗,造成本来可以避免的严重并发症,不仅增加患者的痛苦及经济压力,甚至可能加速患者死亡。治疗过程中应及时监测患者的尿量、肾功能、电解质等各项指标,一旦明确诊断TLS,应及时补液、碱化尿液、降尿酸、利尿、纠正电解质紊乱等,必要时及时行床旁CRRT治疗,能大大降低TLS的病死率,提高TLS的治愈率。

