血管加压素对大鼠大脑皮层星形胶质细胞内钙信号的影响
薛妍,方晓峰
1苏州市立医院北区,江苏苏州215000;2上海科奈技术咨询有限公司
星形胶质细胞作为脑组织内数量最多的细胞,不仅可支持和协助代谢,同时在神经信号传导、血脑屏障正常功能维持中起重要作用。星形胶质细胞与神经元之间通过“三方突触”进行神经信息的传递和释放、离子信号的传导和整合;还可与神经元、脑部毛细血管周细胞构成“神经血管单元”,参与神经元活动引起的局部毛细血管功能性充血[1]。脑部毛细血管周围星形胶质细胞对血脑屏障发育和通透性维持有重要意义,在脑水肿形成中起重要作用。脑组织内的神经递质释放、缺血缺氧和创伤等均可导致星形胶质细胞产生应激性反应,其中最主要的反应为胞内第二信使Ca2+浓度改变。胞内Ca2+信号变化能在胶质细胞间传递,从而影响中枢系统神经元的活动。血管加压素(VP)是哺乳动物体内的一种神经脑垂体激素,多为精氨酸加压素(AVP)。生理条件下,部分AVP可直接释放至脑部作为神经递质作用于中枢神经系统,介导中枢神经系统一系列的行为和认知功能[2]。病理状态下,中枢系统AVP异常升高,引起脑水肿加重、病情恶化。2018年1月—2019年4月,本研究观察VP对大鼠大脑皮层1型星形胶质细胞内钙信号的影响。
1 材料与方法
1.1 动物、试剂及仪器 SD大鼠10只,出生7 d,购自北京维通利华实验动物公司。牛血清白蛋白、VP、HEPES缓冲液均购自美国Sigma-Aldrich公司;DMEM-F12培养基、新生牛血清、MEM氨基酸混合液(×50)购自美国GIBCO-BRL。荧光钙探针Fura-2-五(乙酰氧基甲基)酯(Fura-2 AM)和镁离子-fluo-4-五(乙酰氧基甲基)酯(Mag-fluo-4 AM)均购自美国Molecular Probes公司。Ca2+检测系统购自美国PTI公司。Locke′s缓冲液:NaCl 140 mmol/L、KCl 4.5 mmol/L、MgSO41.2 mmol/L、CaCl22.5 mmol/L、KH2PO41.2 mmol/L、D-葡萄糖5.5 mmol/L、HEPES 10 mmol/L、NaOH调节pH为7.4;PBS缓冲液:NaCl 137 mmol/L,KCl 2.7 mmol/L、KH2PO41.5 mmol/L、Na2HPO48 mmol/L,NaOH调节pH为7.4。
1.2 星形胶质细胞的原代培养 参照文献[3]进行星形胶质细胞原代培养。新生鼠用CO2处死,取大脑皮层,用无菌刀片切成小片,转移到含0.25 mg/mL胰酶组织消化液中,于37 ℃消化15 min,以500 r/min离心2 min,去除上清液。加入PBS缓冲液,巴氏管吹打组织直至分散,以1 000 r/min离心10 min,去除上清液后重悬。滤膜过滤重悬液,去除未消化开的组织团块。将过滤得到的细胞悬液以1 000 r/min离心10 min后去除上清液,用含10% FBS的DMEM/F12培养基重悬,培养基中加入50 U/mL青霉素,50 μg/mL的链霉素。悬浮细胞转移至25 cm2的培养瓶中,种植密度为(3~5)×104个/cm2。细胞在37 ℃含5% CO2、95%空气的培养箱中培养18~21 d。实验前,培养瓶在37 ℃以180 r/min摇床上摇2 h,之后换成冰冷的培养基,再摇16 h。收集黏附在培养瓶上的细胞。
1.3 1型星形胶质细胞的鉴定 采用免疫组化法。取载有星形胶质细胞的玻片,置于4%多聚甲醛溶液(新鲜配制)中固定30 min,PBS清洗3次。清洗后玻片置于Triton X-100中通透10 min,再转移至3%的BSA/PBS处理30 min以阻断非特异性的抗体结合。玻片上细胞用抗胶质原纤维酸性蛋白(GFAP)的一抗(1∶80稀释)于4 ℃孵育过夜,再用荧光素化的羊抗兔IgG二抗(1∶160稀释)于室温孵育1 h。用奥林巴斯IX 70型倒置显微镜观察染色的细胞,激发光波长为488 nm,发射光波长为520 nm。显微镜视野中观察到绿色荧光的细胞即为被标记的1型星形胶质细胞。
1.4 VP干预 用Locke′s 缓冲液配制含0.1、1、10、100 nmol/L VP灌流液,用灌流泵将灌流液分别泵至灌流槽中刺激细胞,同时对细胞钙信号进行实时检测。
1.5 细胞胞质内钙信号检测 采用单荧光探针法[4]。将玻片上的星形胶质细胞于37 ℃下与终浓度5 μmol/L的细胞质钙荧光探针(Fura-2 AM)孵育30 min,将玻片固定于灌流槽中,并将灌流槽放置于Ca2+测量/成像系统(PTI系统)的荧光倒置显微镜载物台上,选定待测细胞,启动激发光源激发探针Fura-2产生荧光,用Felix软件实时采集数据。激发光条件:340 nm/380 nm双波长交替激发(单色仪狭缝宽度为1 nm),采集和检测的发射光波长为510 nm。数据采集软件以荧光值F340/F380表示胞质的钙浓度。每次实验检测1个细胞,用Felix软件持续测量、记录选定细胞的荧光值变化,每秒记录1个荧光值,根据荧光值绘制钙反应波形图,波形包括无钙反应、单峰样钙升高、振荡和高台样反应。计算各种波形细胞所占比例。
1.6 细胞质与内质网钙浓度同时检测 采用双荧光探针法。由于100 nmol/L VP刺激引起的钙反应发生率高,钙峰明显,故选择该浓度刺激细胞[5]。将星形胶质细胞于37 ℃同时与Fura-2 AM(终浓度5 μmol/L)、内质网钙荧光探针(Mag-fluo-4 AM,终浓度2 μmol/L)孵育45 min,选定细胞待测。本实验PTI系统仅支持双通道激发光,故调整两种荧光染料为单波长光激发,Fura-2和Mag-fluo-4的激发光波长分别为340、488 nm,检测两种荧光染料发射光波长均为510 nm。数据采集软件分别以荧光值F340/F0、F488/F0表示胞质、内质网的钙浓度。
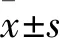
2 结果
2.1 VP对1型星形胶质细胞胞质钙信号的影响 经0.1 nmol/L VP刺激后,92.3%细胞胞质无钙反应,单峰样钙升高比例为7.7%;1 nmol/L VP刺激主要引起细胞胞质出现钙振荡(43.8%),无反应细胞比例降低(31.2%),并出现高台样钙反应(15.6%);10 nmol/L VP刺激后,主要引起单峰样钙升高(50.9%),高台样钙反应比例为41.8%;100 nmol/L VP刺激后,主要引起高台样钙反应(61.1%),单峰样钙升高比例为35.2%。见表1。
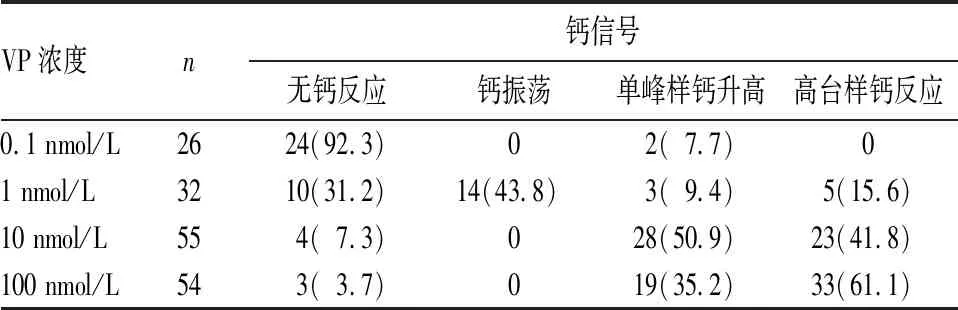
表1 不同浓度VP对1型星形胶质细胞胞质钙信号的影响[个(%)]
2.2 VP干预后细胞胞质和内质网钙浓度的同步变化 100 nmol/L VP刺激前后胞质内Ca2+浓度(荧光强度)分别为22 818±2 878、28 974±2 874;内质网Ca2+浓度(荧光强度)分别为59 368±16 109、52 233±17 584。与100 nmol/L VP刺激前比较,刺激后胞质Ca2+浓度升高(P<0.05),同时内质网Ca2+浓度降低(P<0.05)。
3 讨论
Ca2+在中枢神经元、神经胶质细胞和脑血管内皮细胞的通信中起到桥梁作用。机体内源性激动剂作用于神经胶质细胞引起的钙信号变化可能对中枢神经系统钙信号调控具有重要意义。
本研究结果表明,VP能浓度依赖性地引起星形胶质细胞胞质钙浓度升高,且对应的钙峰形态变化从无反应、振荡、单峰直至高台样反应。生理状态下,人体血液中的VP水平为10~500 pmol/L[6]。但预实验发现,10 pmol/L VP对星形胶质细胞钙信号无影响,而100 pmol/L也仅引起极少量细胞产生钙反应。其他研究结果表明,VP引起半数血管平滑肌细胞系产生钙响应的浓度,需达到生理浓度的100~1 000倍[7];中枢神经系统中VP的浓度可达到血液正常生理水平的1 000倍[8],而浓度梯度从0.1~1 000 nmol/L(10倍浓度梯度)才能够引起星形胶质细胞谷氨酸的释放[9]。因此,离体细胞试验中激动剂VP的效应浓度可能需要高于生理浓度,故本研究选择0.1、1、10、100 nmol/L共4个浓度梯度,探讨VP引起细胞钙动态变化的量—效关系。
中枢释放VP的核心功能通过V型VP受体(VR)发挥作用。VR属于G蛋白偶联受体,包括V1aR、V1bR、V2R三种亚型。其中偶联V1aR和V1bR磷脂酰肌醇信号系统,增加胞内第二信使Ca2+浓度,进而激活蛋白激酶C、钙离子/钙调素依赖性蛋白激酶Ⅱ等下游信号通路;V2R主要通过cAMP信号通路激活蛋白激酶A[10,11]。V1aR、V1bR和V2R均存在胶质细胞中,中枢神经系统胶质细胞主要表达V1型受体(V1aR和V1bR)。V1型受体在大鼠神经突和室周器来源的星形胶质细胞及1、2型星形胶质细胞中均有表达[12]。此外,V1aR和V1bR在中枢神经系统1型星形胶质细胞具有脑区分布的差异性。用免疫印迹法研究V1R亚型在不同脑区表达的差异性,结果表明培养的大鼠海马1型星形胶质细胞主要表达V1bR亚型,而在培养的大鼠大脑皮层1型星形胶质细胞中仅表达V1aR亚型,并无V1bR亚型表达[13]。因此,本研中VP可能作用于V1aR,激活三磷酸肌醇(IP3)信号通路,导致细胞内钙离子浓度升高。
星形胶质细胞属于非兴奋性细胞,胞内的钙信号变化主要通过两种来源进行调控,即胞外钙内流和胞内钙库释放。胞外钙内流的途径主要分为三大类:电压门控的钙通道、受体门控的钙通道和钙库控制的钙通道;胞内内质网钙库有两种钙释放通道,即IP3和兰诺啶受体(RyR)通道,将Ca2+从内质网钙库中释放出来。激动剂引起的非兴奋性细胞的钙信号变化一般为钙振荡、单峰,或是双相钙反应(一个单峰后面紧接着一个高台)[14]。钙振荡或单相钙峰是由于激动剂作用于细胞表面代谢型受体,激活胞内IP3信号通路,诱导胞内钙库钙释放导致胞内钙浓度快速升高,该过程伴随快速清除机制;而激动剂引起细胞胞质高台样的钙浓度变化,通常需通过胞外钙离子跨膜内流的机制进行维持和调节[13]。从本研究结果可知,VP作用于1型胶质细胞后,浓度依赖性地出现振荡、单峰直至高台样的钙信号动态变化。可见在应对外界刺激时星形胶质细胞发生钙信号的复杂调控。从钙反应的波形可知,高浓度VP作用后,可能有两种Ca2+来源途径同时参与了1型星形胶质细胞胞质Ca2+调控。激动剂刺激后波形快速上升相应为胞内钙库Ca2+快速释放,而波形缓慢下降至平台相可能是胞质Ca2+清除过程中伴随着持续外Ca2+内流。
本研究还发现,低浓度(1 nmol/L)VP刺激更易诱发出1型星形胶质细胞的钙振荡。虽然培养的星形胶质细胞其效应阈值应在nmol/L水平,但预计机体生理状态下VP诱导出钙振荡的水平很有可能在pmol/L水平。细胞钙振荡通常出现在生理量-效范围的激动剂作用时,其特点为细胞整体出现重复的振荡波形。钙振荡可以分为质膜上钙通道周期性开放引起的(膜振荡子)或是胞质内钙库引起的(胞质振荡子)两类。钙库引起的振荡包括IP3或RyR通道介导的钙库释放或二者的协同作用。目前的实验结果可以确定至少有胞质内钙库(胞质振荡子)参与了胶质细胞钙振荡的发生。虽然VP诱导出1型胶质细胞钙振荡的波形与通常经典的高频率钙振荡不同,但这也表明星形胶质细胞很有可能通过低频率钙振荡这种频率编码机制产生、携带和传递特定的信息,比如星形胶质细胞通过钙振荡调控其自身分泌神经递质(如谷氨酸)的持续时间,频率和过程。此外,星形胶质细胞自身周期性钙振荡可产生钙波,通过钙波在大脑皮层细胞间持续传递,参与大脑皮层钙信号的空间差异性调控[13]。
星形胶质细胞内钙库主要包括内质网、线粒体和溶酶体等。内质网作为最重要的胞内动态的钙库,是胞质钙离子的主要来源,同时也对钙信号起缓冲作用[13]。本研究选用低亲和力的钙离子荧光探针Mag-fluo-4 AM和Fura-2 AM同时检测VP刺激后1型星形胶质细胞内质网和胞质的钙变化,结果细胞内质网钙排放和胞质Ca2+升高同时发生。表明1型星形胶质细胞内质网作为胞内钙库参与了细胞钙离子的调控。
1、2型星形胶质细胞是中枢神经系统胶质细胞的主要类型,对比研究二者在VP作用下的钙信号变化有重要意义。1 μmol/L VP能够引起2型星形胶质细胞高台样的钙反应,但是发生钙反应的细胞仅占所有监测细胞总数一半左右[15]。本研究发现,VP浓度仅在100 nmol/L就能引起1型星形胶质细胞产生高台样的钙反应,且刺激后发生钙反应的细胞比例高达96.3%(其中高台样反应的比例为61.1%,单峰样钙升高的比例为35.2%)。因此,1型星型胶质细胞比2型星型胶质细胞对外界VP的刺激更敏感。由于目前对2型星形胶质细胞的钙动态研究较少,具体原因尚不明确。推测可能与两类细胞亚群表达VP受体的亚型或细胞表面受体数目差异性有关。
综上所述,神经细胞分泌的VP可激活大脑皮层星形胶质细胞表面VP受体,偶联磷脂酰肌醇信号传递系统,调控细胞内钙离子浓度变化,胞内钙离子浓度可能受质膜上离子通道和细胞器钙库如内质网的共同调控。星形胶质细胞信号传递系统以Ca2+为第二信使,进而激活下游的信号通路。

