乳酸乳球菌硫胺素转运蛋白ThiT提高酸耐受性的机制
朱政明,张 娟,堵国成,3,吴志猛
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122;3.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122)
应用微生物细胞工厂进行相关代谢产物的发酵法生产已广泛应用于食品、化工、医药、纺织等众多领域[1]。在这些工业产品的发酵法生产过程中,由于碳代谢流的转化,其导致的产酸积累是微生物代谢过程中必不可少的部分[2]。微生物的代谢产酸对促进细胞能量转化、增强本体细胞的环境竞争性等具有积极的作用。然而,随着胞内代谢产物持续不断积累,导致胞内pH不断下降,从而使得维持细胞正常生理功能的相关酶类活性受到严重抑制,影响了细胞的代谢活性和细胞结构的完整性。另外细胞膜流动性的降低影响了胞内外物质的转运,并为下游的加工处理以及工业排放物的治理埋下了诸多隐患[3]。因此,提高微生物细胞的酸胁迫耐受性,增强其在酸性环境下的代谢活性与生产效率,成为学术界和产业界急需解决的问题。
基于对微生物酸胁迫耐受性机制的深入解析,提高微生物细胞对酸胁迫环境的耐受性已成为微生物生理功能研究的重要组成部分。近年来,随着合成生物学和系统生物学技术的快速发展,新技术的出现为微生物耐酸机制的解析、抗酸胁迫元器件的发掘和构建奠定了坚定的理论与技术基础。目前,对抗酸胁迫元器件的研究主要集中于对相关结构基因、调控基因以及代谢/解毒模块的研究。对结构基因抗酸元器件的研究主要集中于F1F0-ATPase、脲酶等多亚基编码蛋白的结构解析及功能验证[4-5]。对调控基因型抗酸元器件的研究目前主要集中于对分子伴侣、应激蛋白的功能解析及分子改造[6-7]。解毒/代谢模块是抗酸元器件中的重要组成部分,目前对其中的精氨酸脱氨酶系统(Arginine deiminase,ADI)和鲱精氨脱氨酶系统(Agmatine deiminase system,AgDS)已进行了较为深入的研究[8]。
目前关于乳酸乳球菌(Lactococcus lactis)中酸胁迫耐受性提升的研究已有部分报道。Wu等通过在L.lactis NZ9000中异源表达来自干酪乳杆菌的DNA修复蛋白RecO,提升了菌株对酸胁迫的耐受性以及乳酸产量[9]。Abdullah等通过在L.lactis NZ9000中异源表达来自大肠杆菌的分子伴侣DNA蛋白,重组菌株在0.5 g/dL的乳酸(pH 5.47)胁迫下,其最大生物量是对照菌株的1.44倍[7]。此外,研究发现在L.lactis MG1363中过量表达小热休克蛋白Lo18,明显提升了菌株对酸胁迫和热胁迫的耐受性[10]。关于L.lactis中酸胁迫耐受性提升的研究主要集中于对分子伴侣、热休克蛋白等一些应激蛋白的研究,而关于其他类型的功能蛋白尤其是转运蛋白帮助乳酸乳球菌细胞提升酸胁迫耐受性目前还缺乏深入研究。
已有研究发现,在单核细胞增多性李斯特氏菌(Listeria monocytogenes)中通过敲除thiT基因,敲除菌株对酸胁迫敏感,其对酸胁迫的耐受性低于未敲除thiT基因的对照菌株[11]。另外研究发现,在酿酒酵母中通过外源添加硫胺素可帮助细胞抵御氧胁迫[12]。基于此,本研究中通过在乳酸乳球菌中过表达ThiT转运蛋白,考察了重组菌株对酸胁迫耐受性的影响,并利用比较转录组学技术研究了重组菌株耐受酸胁迫的具体响应机制。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒本研究中所用的菌株和质粒详见表1。
1.1.2 主要试剂Prime STAR(mix)DNA聚合酶、PCR产物纯化试剂盒以及T4 DNA连接酶:购自TaKaRa公司;RNA提取试剂盒:购自天根生物科技有限公司;限制性内切酶Nco I和Xba I:购自Thermo Scientific公司;Nisin:购买自Sigma公司;蛋白胨、酵母粉以及M17肉汤培养基:购买自Oxoid公司;其他常规试剂均为国产分析纯。引物合成及测序均由上海生工有限公司完成。实验中,氯霉素添加的质量浓度分别为大肠杆菌中添加质量浓度为100μg/mL,乳酸乳球菌中添加质量浓度10μg/mL。诱导剂Nisin的添加质量浓度为10 ng/mL。
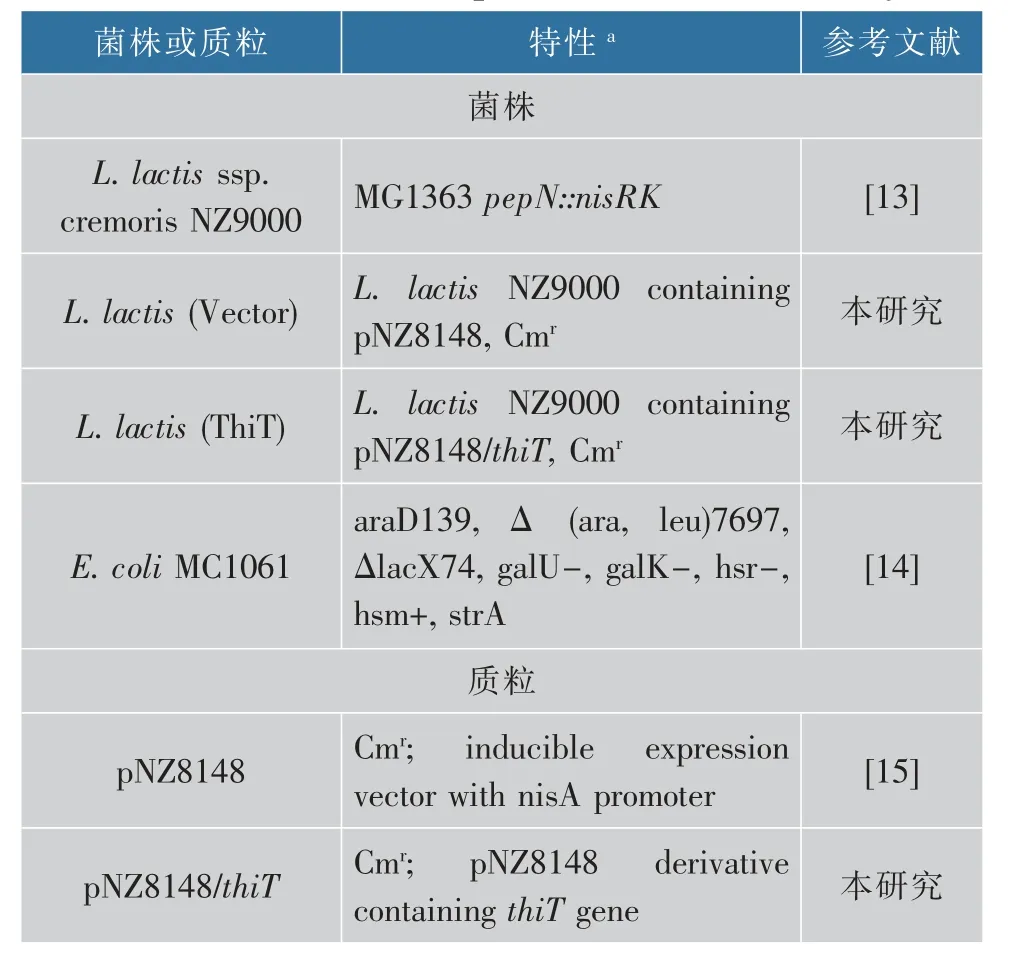
表1 研究所用的菌株及质粒Table 1 Strains and plasmids used in this study
1.1.3 培养基LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10;pH 7.4。GM17培养基:M17培养基补充5 g/L葡萄糖。
1.2 方法
1.2.1 质粒和菌株的构建pNZ8148/thiT的构建过程如图1所示。首先以乳酸乳球菌 (L.lactis NZ9000)的基因组DNA为模板,以pNZ8148/thiT-F和pNZ8148/thiT-R为引物,通过PCR扩增并胶回收得到片段thiT;然后将表达质粒pNZ8148和片段用Nco I和Xba I双酶切,酶切产物纯化后用T4 DNA连接酶连接6~8 h;连接产物转化E.coli MC1061,最后用引物pNZ8148-F和pNZ8148-R进行菌落PCR验证,并挑取条带大小约800 bp的克隆子进行测序验证,得到质粒pNZ8148/thiT。所用引物序列见表2。将空质粒pNZ8148和重组质粒pNZ8148/thiT电转化进入L.lactis NZ9000,通过氯霉素抗性的平板筛选获得对照菌株L.lactis(Vector)和重组菌株L.lactis(ThiT)。

图1 pNZ8148/thiT质粒的构建Fig.1 Construction of plasmid pNZ8148/thiT

表2 本研究所用的引物及序列Table 2 Primers used in this study
1.2.2 生长曲线的测定将经过活化的种子培养液以体积分数2%的接种量接入GM17培养基(含10μg/mL的氯霉素),30℃静置培养至OD6000.4左右,加入10 ng/mL的Nisin诱导培养。每隔2 h取样,使用多功能酶标仪测定OD600处的吸光值,以GM17培养基为空白对照。最后以OD600为纵坐标,培养时间为横坐标,绘制对照菌株和重组菌株的生长曲线。每个菌株测定3个平行,计算其平均值。
1.2.3 酸胁迫下的存活率测定根据1.2.2生长至OD6000.4左右的菌液加入10 ng/mL的Nisin诱导培养(5 h),取4 mL的菌液于8 000 g离心5 min后用等体积的生理盐水(0.85 g/dL)洗涤离心2次,加入等体积的胁迫培养基(GM17,pH 4.0,含10μg/mL的氯霉素和10 ng/mL的Nisin)进行胁迫处理。分别胁迫不同的时间取样后,离心洗涤,用生理盐水等体积重悬后梯度稀释至适宜的菌体浓度,然后取10 μL分别点样于GM17的固体平板上,于30℃条件下培养24 h左右。最后进行菌落计数并计算存活率,存活率的计算方法参考之前报道的方法[16]。
1.2.4 RNA样品的提取将诱导培养至对数中期(4 h)的微生物细胞于8 000 g离心5 min后用预冷的50 mmol/L的PBS(pH 7.4)离心洗涤2次后收集菌体,加入等体积的胁迫培养基(GM17,pH 4.0,含10μg/mL的氯霉素和10 ng/mL的Nisin)进行胁迫处理。然后分别胁迫0 h和2.5 h后离心洗涤并收集菌体,迅速放入液氮中冻存。最后采用液氮研磨菌体,并按照RNAprep Pure Cell/Bacteria Kit说明书提取总RNA。使用NanoDrop ND-2000对纯化的RNA进行定量并将其保存于-80℃冰箱。
1.2.5 转录组学分析RNA样品送往南京诺唯赞生物有限公司进行转录组测序。转录组测序所得的数据成为raw data,随后对raw data进行质控(QC)。质控后,经过滤得到clean reads,然后用HISAT2[17]将clean reads比对到参考序列上。比对完,通过统计reads在参考序列上的分布情况和覆盖度,以此判断比对结果是否可靠。之后采用RSEM[18]计算基因的表达量。差异表达基因的分析采用DEGseq[19]的方法进行分析。我们将差异倍数为2倍以上且pValue≤0.05的基因筛选为显著差异表达基因。基于Gene Ontology(GO)和Kyoto Encyclopedia of Genes and Genomes(KEGG)数据库,采用phyper对分别差异基因进行GO功能富集分析和pathway功能富集分析,随后对pValue进行FDR校正,并以FDR≤0.01的功能视为显著富集。
2 结果与分析
2.1 重组菌株的生长性能分析
为了考察过表达ThiT转运蛋白对乳酸乳球菌生长的影响,实验测定了乳酸乳球菌在正常生长条件下的生长曲线。如图2(a)所知,根据生长曲线可以确定对数中期的培养时间约为4 h。同时,图2所示的重组菌株和对照菌株的生长情况基本相同,在对数期重组菌株的菌体浓度略微低于对照菌株,且生长过程中2株菌株的环境pH基本相同。推测这可能是由于加入Nisin诱导培养后,重组菌株由于重组蛋白开始快速表达,给菌体细胞的代谢造成一定的代谢负担所导致[20]。
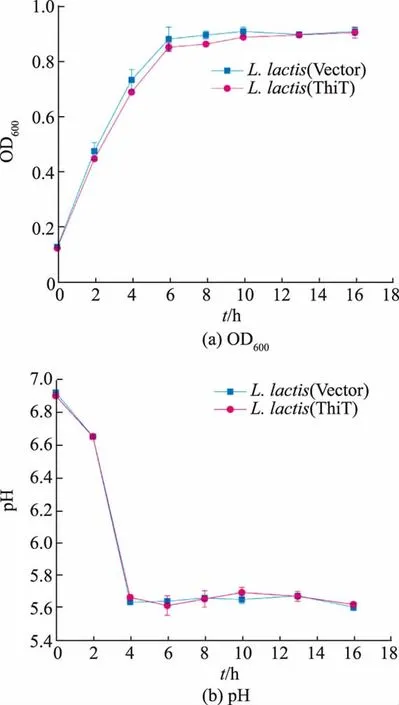
图2 L.lactis的生长分析Fig.2 Growth analysis of L.lactis
2.2 过表达ThiT提高L.lactis NZ9000的酸胁迫耐受性
基于重组菌株的生长情况,实验进一步考察了对照菌株和重组菌株在酸胁迫条件下的存活率。在乳酸乳球菌代谢过程中,随着主要代谢产物乳酸的不断积累,胞外pH也随之不断地下降,最低可降至pH 4.5~5.0,而在pH 4.0的条件下,乳酸乳球菌的存活率迅速下降。因此本研究中选择pH 4.0作为考察乳酸乳球菌存活率的实验pH[21-22]。
如图3所示,经过pH 4.0胁迫处理后,重组菌株的存活率明显高于对照菌株,且随着胁迫时间的延长,两者之间的差距逐渐增大,在胁迫2.5 h后,两者之间存活率差距达到最大,此时重组菌株的存活率是对照菌株的16.2倍。在胁迫3 h后,2株菌之间的存活率差距有所缩小,重组菌株的存活率是对照菌株的2.4倍。通过存活率实验,发现过表达ThiT转运蛋白可显著提高乳酸乳球菌的酸胁迫耐受性。

图3 酸胁迫条件下过表达ThiT对L.lactis NZ9000存活率的影响Fig.3 Effect of ThiT overexpression on the survival rates of L.lactis NZ9000 during acid stress
2.3 过表达ThiT对乳酸乳球菌转录组水平的影响
为进一步揭示ThiT转运蛋白帮助细胞耐受酸胁迫的具体作用机制,通过比较转录组分析研究了对照菌株和重组菌株在酸胁迫前后的转录水平变化。如图4所示,在正常培养条件下,与对照菌株相比,重组菌株差异表达基因有207个,其中有116个基因发生了显著上调,91个基因发生了显著下调。另外,在酸胁迫条件下,相比较对照菌株,重组菌株差异表达基因有201个,其中有99个基因发生了显著上调,102个基因发生了显著下调。两组比较情况下,共155个基因同时出现了显著上下调,初步分析这些显著差异表达的基因可能和乳酸菌细胞抵御酸胁迫有关。
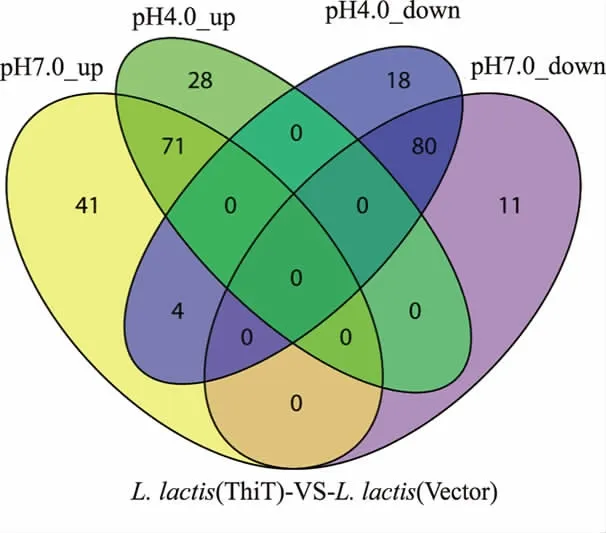
图4 2株菌在正常(pH 7.0)和酸胁迫(pH 4.0)条件下的差异基因分析Fig.4 Significant differentially expressed genes in the recombinant strain relative to the parent strain at pH 7.0 and pH 4.0
为进一步揭示这些差异表达基因参与的具体细胞生理功能和代谢途径,分别对两组比较情况下的差异基因进行GO和Pathway功能富集分析。由图5可知,GO功能显著性分析发现在正常培养条件下,重组菌株中差异表达的基因主要参与转运过程,尤其是营养物质如糖类物质的转运(图5(a))。同样地,在酸胁迫条件下,重组菌株中差异表达的基因主要参与碳水化合物的转运和转膜的过程(图5(b))。由此可以分析过表达ThiT转运蛋白可提高细胞对碳水化合物的转运能力,酸胁迫条件下碳水化合物转运的增强可为提高抵御酸胁迫提供更多的能量[23]。通过Pathway显著性富集发现在正常培养和酸胁迫条件下,差异表达基因主要参与PTS途径和糖代谢途径 (图5(c)、(d))。差异基因的Pathway富集结果和GO的富集分析结果成正相关性,进一步解释了GO富集分析的结果。
为深入解析在两组比较情况下,共有差异基因参与的细胞功能和代谢过程。进一步对共有的差异基因进行GO和Pathway富集分析发现,这些共有的差异基因主要参与细胞的胞内外物质的转运过程,尤其是对糖类等营养物质的转运(图6(a)(b))。为了应对酸胁迫的环境,细胞通过加强营养物质的转运,从而强化细胞的碳代谢途径,以提供更多的能量,提供的能量在细胞抵御酸胁迫的过程中被消耗掉,从而帮助细胞更好地抵御酸胁迫的环境[24]。
前期研究发现,酸胁迫条件下,过表达ThiT蛋白对胞内外物质的转运过程具有较大影响,因此本研究中对转运过程中的相关差异基因进行了具体分析。见图7(a),oppD(ABC家族的ATP结合的转运蛋白)、oppF(寡肽转运的ATP结合蛋白)、bioY(生物素转运蛋白)和busAA(甘氨酸、甜菜碱ABC转运ATP结合蛋白)等基因在正常以及酸胁迫条件下均发生了显著上调。OppD和OppF都属于ABC家族的寡肽转运蛋白,它们的显著上调可帮助细胞在酸胁迫条件下更高效地转运寡肽,而转运到胞内的寡肽可被分解成氨基酸,多种氨基酸已被证实可帮助细胞抵御酸胁迫的损伤。Wang等通过在唾液乳杆菌(Lactobacillus salivarius)中过表达寡肽转运底物结合蛋白OppA明显提高了重组菌株对多种胁迫的耐受性[25]。此外,busAA基因的显著上调,可帮助酸胁迫条件下的细胞更多地转运甘氨酸和甜菜碱等物质,而甜菜碱已被证实可提高细胞的酸胁迫耐受性[26]。作者继续考察了过表达ThiT蛋白对胞内硫胺素合成途径中关键基因的影响。如图7(b)所示,在正常条件和酸胁迫条件下,过表达ThiT蛋白,显著提高了thiT基因的转录水平,其转录水平分别提高了699和1 859倍,说明thiT基因在L.lactis NZ9000中成功转录,且其转录水平得到显著提高。另外,研究发现硫胺素合成途径中的基因thiDEM也发生了显著上调,酸胁迫条件下过表达ThiT转运蛋白同时提高了胞内硫胺素合成途径中关键基因的表达,进一步强化胞内硫胺素的合成,从而帮助细胞更高效地抵御酸胁迫的损伤。

图5 2株菌在正常(pH 7.0)和酸胁迫(pH 4.0)条件下的GO和Pathway富集分析Fig.5 Gene ontology and pathway classification analysis in the recombinant strain relative to the parent strain at pH 7.0 and pH 4.0

图6 2株菌在正常(pH 7.0)和酸胁迫(pH 4.0)条件下的共有差异基因表达分析Fig.6 Common genes of significant differentially expressed in the recombinant strain relative to the parent strain at pH 7.0 and pH 4.0
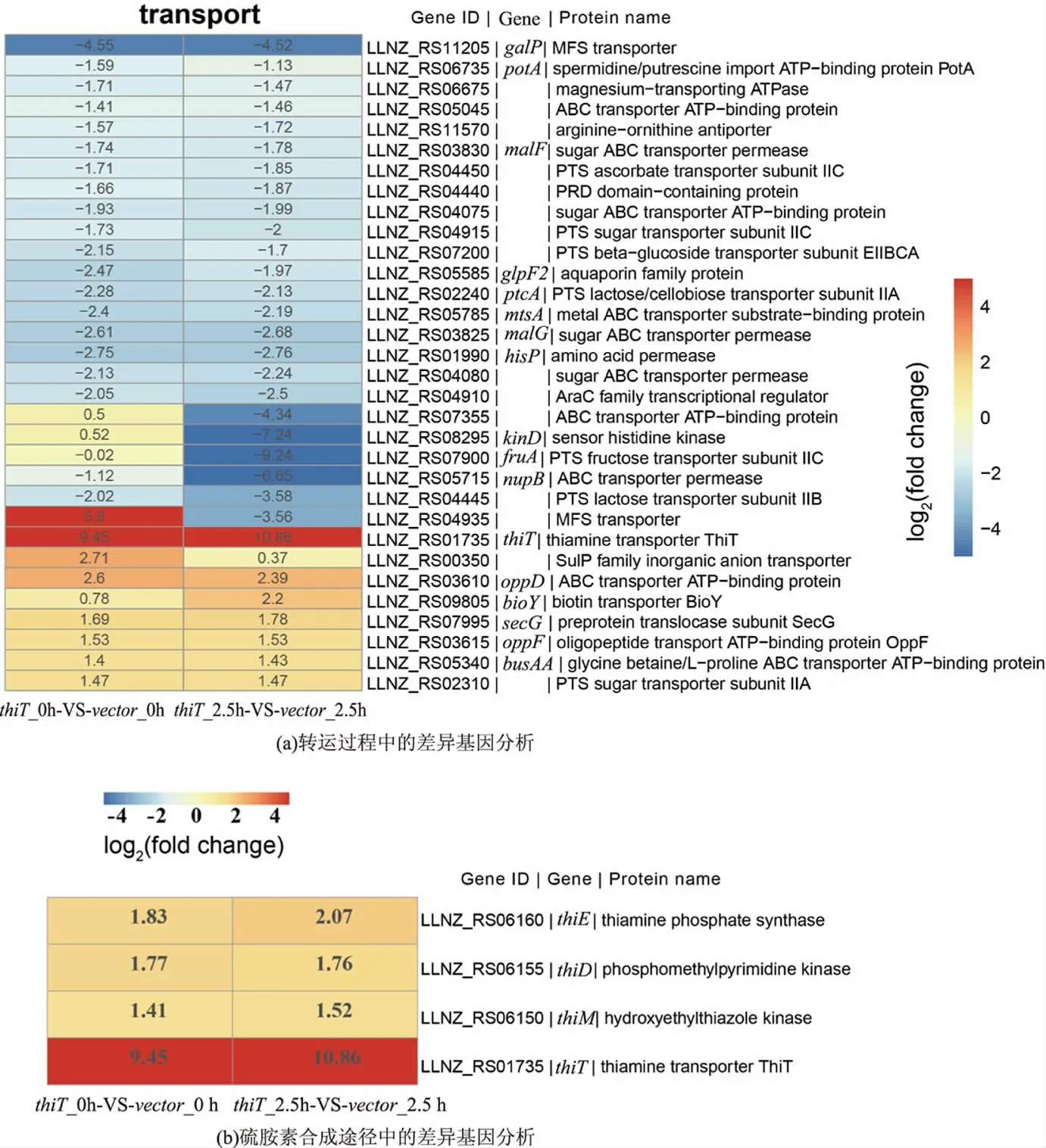
图7 2株菌在正常(pH 7.0)和酸胁迫(pH 4.0)条件下的关键差异基因表达分析Fig.7 Key genes of significant differentially expressed in the recombinant strain relative to the parent strain at pH 7.0 and pH 4.0
3 结语
本研究中通过过表达ThiT硫胺素转运蛋白,考察了其对乳酸乳球菌酸胁迫耐受性的影响,并在此基础上对重组菌株和对照菌株在正常和酸胁迫条件下进行转录组学分析。研究发现过表达ThiT硫胺素转运蛋白可显著提高细胞在酸胁迫条件下的存活率,接下来通过转录组学分析发现,过表达ThiT转运蛋白可提高细胞对碳水化合物的转运能力,从而为细胞抵御酸胁迫的耐受性提供更多的能量;此外寡肽、甜菜碱等相关转运基因的显著上调可帮助细胞抵御酸胁迫的损伤。作者首次报道了在乳酸菌中关于ThiT转运蛋白提高酸胁迫耐受性的作用效果,为进一步对硫胺素代谢改造提高细胞酸胁迫耐受性提供了新的思路。同时,上述研究结果也对关于ThiT转运蛋白在其他工业微生物中的应用提供了重要的参考意义。

