恒温蓄冷剂冻结对大黄鱼品质的影响
刘英丹,孟天宇,李勇勇,陈淑敏,龚芳芳,王 晔,张玉琦,娄永江
(宁波大学 食品与药学学院,浙江 宁波315800)
大黄鱼作为我国重要的海产经济鱼类,具有高脂肪、高蛋白质、低胆固醇等特点,深受广大消费者的青睐[1]。但因其营养丰富、水分含量高,为微生物的生长繁殖创造有利的条件,导致大黄鱼迅速腐败变质[2]。如何在一定时间内最大程度地保证鱼类的鲜度、防止腐败变质,成为人们研究的热点[3]。
目前我国大黄鱼除鲜销外多为冻藏销售,而冻结则是冻藏制品必不可少的工艺环节。不同的冻结方式对冻品的色泽、组织、营养、风味等影响显著[4]。目前的冻结方式基本为空气冻结,其冻结速度慢、品质劣变大,商品价值明显下降。少部分则以乙二醇与乙醇等混合液为冷媒进行液体冻结,但此类冷媒其函值较低,冻结时冷媒温升较快。为此,恒温冷媒冻结逐渐成为研究的热点。但恒温冷媒冻结对冻品品质的影响至今仍为空白。因此为了获得一种保持大黄鱼新鲜品质的方式,非常有必要研究恒温蓄冷剂冻结对大黄鱼的品质带来显著影响。本研究中以养殖大黄鱼为研究对象,分析恒温蓄冷剂冻结方式处理对大黄鱼品质的影响,为大黄鱼速冻技术提供理论支撑[5]。
1 材料与方法
1.1 实验材料
大黄鱼:购于浙江宁波象山某海水养殖场,选取质量为(0.5±0.05)kg的大黄鱼,起捕后加冰迅速运回实验室,立即进行不同方式的速冻研究。
蓄冷剂:将25 kg NaCl和0.5 g抗冻蛋白A溶液加入100 L水中,预冷至-25℃。
包装袋:厚度0.1 mm聚酰胺(PA)薄膜袋。
试剂:硫酸铜、磷酸二氢钠、硼酸、磷酸氢二钠、氢氧化钠、盐酸、酒石酸钾钠、三氯乙酸、三氯甲烷、乙醇、甲醇、叔丁醇、戊二醛、丙二醛、磷酸二氢钠、磷酸氢二钠等(均为分析纯AR),国药化学试剂有限公司产品。
1.2 实验仪器与设备
Bioprep-24型均质机:杭州奥盛仪器有限公司产品;DZ400/2D真空包装机:深圳市佳鑫包装机械有限公司产品;A96FS70TI型变频冰箱:德国Siemens股份有限公司产品;CR-400型色差仪:日本柯尼卡美能达公司产品;TMS-PRO质构仪:美国FTC公司产品;S-3400N型扫描电子显微镜:日本日立公司产品;UV-1800APC型紫外可见分光光度计:上海美析仪器有限公司产品;Sigma 3k15型冷冻离心机:德国希格玛公司产品。
1.3 实验方法
1.3.1 大黄鱼前处理将大黄鱼样品表面进行简单清洗,用滤纸吸去表面的水分,分成5组(新鲜组(CK)、无包装空气自然循环冻结(UAF-0)、PA薄膜袋真空包装空气自然循环冻结(PAF-1,真空度0.01 MPa,后同)、PA薄膜袋真空包装蓄冷剂自然循环冻结(PLF-1)、无包装蓄冷剂自然循环冻结(ULF-0)),放入冰水中预冷30 min,后置于-25℃的空气或蓄冷剂(温度波动为±0.10℃)中,待大黄鱼中心温度为-15℃后取出,置0~4℃冰箱自然解冻,立即取背部鱼肉进行检测。
1.3.2 测定方法
1)中心温度 取大黄鱼若干条,将插入式温度计放入经前处理的大黄鱼腹部中心位置后,放入预先制备的蓄冷剂中,开始冻结。每分钟记录一次样品中心温度,直到-15℃结束。
2)pH值 按GB 5009.237—236食品安全国家标准 食品pH的测定方法测定。
3)色差 取2组大黄鱼(5条/组),使用便携式色差仪(CR-10型)对鱼体进行色差测定,具体选点见图1。

图1 大黄鱼色差采样点Fig.1 Sampling points for chromatic aberration of large yellow croaker
4)质构 取大黄鱼背部肌肉去皮,每块切10 mm×10 mm×5 mm。选用直径为3 mm的圆柱形探头,压缩探针以1 mm/s速度进行测试,测试型变量为50%。
5)微观结构分析 取大黄鱼背部肌肉去皮,切成1 mm3的立方体。放入2 mL圆底离心管,体积分数为3%的戊二醛固定2 h以上,0.1 mol/L磷酸盐缓冲液(PBS)漂洗3次,15 min/次,再用体积分数为30%、50%、70%、80%、90%的乙醇漂洗15 min,然后用无水乙醇漂洗2次,10 min/次,叔丁醇体积分数为25%的乙醇溶液漂洗10 min,叔丁醇体积分数为50%的乙醇溶液漂洗10 min,叔丁醇体积分数75%的乙醇液漂洗10 min,最后分别用比例为3∶1、1∶1、1∶3(体积比)的乙醇溶液、叔丁醇混合溶液及纯叔丁醇依次漂洗10 min,吸出上层多余液体,-40℃冰箱保存24 h,再冷冻干燥48 h,喷金,电镜观察[6]。
6)盐溶性蛋白含量 在Eymard[7]方法的基础上,取2份鱼肉,分别加入10 mL高离子磷酸缓冲溶液(0.5 mol/L KCl、0.03 mol/L Na2HPO4、0.01 mol/L NaH2PO4)和10 mL低离子磷酸缓冲液(0.025 mol/L Na2HPO4、0.025 mol/L NaH2PO4),搅拌均匀;前者静置3 h,后者静置1 h;然后在4 000 r/min下离心10 min;在上清液中加入体积分数为15%的三氯乙酸10 mL,静置后加入10 mL 1 mol/L NaOH溶解蛋白质,再分别以高、低磷酸盐缓冲液定容至50 mL,最后用双缩脲试剂法测定蛋白质含量[7]。
7)挥发性盐基氮含量 按GB 5009.228水产品中挥发性盐基氮的测定方法测定。
1.4 数据处理
指标数据结果均以“平均值±标准差”的方式表示,使 用Origin 8、SPSS 19.0及Microsoft Office Excel 2013进行数据分析处理。
2 结果与分析
2.1 恒温蓄冷剂冻结方式对大黄鱼冻结速率的影响
冻结温度在-1~-5℃时形成的最大冰晶是影响大黄鱼冻结品质的重要因素[8]。从图2中可以看出,最大冰晶带依次为:PAF-1(425 min)>UAF-0(390 min)>PLF-1(100 min)>ULF-0(56 min)。冻结样品最大冰晶的生成带时间长短与样品的种类、大小以及冻结温度等因素有关[6]。史咏梅等[9]采用液体浸渍冻结南美白对虾,通过最大冰晶生成带的时间为0.617 min。谭明堂等[10]采用螺旋冻结鱿鱼,最大冰晶的生成带时间为18 min。空气冻结组(PAF-1、UAF-0)冻结速率慢于恒温蓄冷剂冻结组(PLF-1、ULF-0);即恒温蓄冷剂冻结与空气冻结相比具有明显优势,可大大缩短大黄鱼的冻结速率。恒温蓄冷剂冻结组对比可看出,无包装蓄冷剂冻结优于包装条件下的冻结速率,由于两者在同一恒温条件下,真空包装状态会阻碍能量的传递,导致大黄鱼中心温度下降相对缓慢[11]。

图2 不同方式冻结大黄鱼的冻结曲线图Fig.2 Freezing curve of large yellow croaker by different freezing methods
2.2 恒温蓄冷剂冻结方式对大黄鱼肌原纤维组织微观结构的影响
以上方式都会引起鱼肉的组织结构发生改变。由图3可知,大黄鱼肌肉纤维约30~50μm。其中空气冻结组(PAF-1、UAF-0)变化较大,纤维结构明显松散,间隙大,结构整体比较混乱。可能是由于鱼体表面没有外包装保护所致[12]。ULF-0组肌肉纤维松散情况不明显,鱼肉质口感变化较小,说明冻结速率过快,会引起大黄鱼肌肉组织撕裂[13]。PLF-1组相比其他冻结方式下的肌肉组织影响最小,因为恒温蓄冷剂冻结速率更快,冰晶颗粒较小,对细胞的破坏程度较小[14]。
2.3 恒温蓄冷剂冻结对大黄鱼色泽的影响
造成大黄鱼体色变化的主要因素是色素。由于类胡萝卜素有多种共轭双键容易被氧化,会直接导致大黄鱼金黄体色褪色[15]。由表1可知,不同冻结方式下大黄鱼的L*值均有不同程度的降低,恒温蓄冷剂冻结组(PLF-1、ULF-0)表现下降趋势较为缓慢,而空气组(PAF-1、UAF-0)下降趋势明显,即恒温蓄冷剂冻结组下降幅度略小于空气组;由表2可知,与CK组相比,a*值均增加,且空气组冻结上升幅度明显大于恒温蓄冷剂组;由表3可知,b*值均下降,空气冻结组的下降幅度明显大于恒温蓄冷剂组;原因可能是由于恒温液体条件下其冻结时间较快,PAF-1和UAF-0组冻结方式的冻结时间太长所导致[16]。张晓頔等[17]证明了冰温真空包装方式可以较好地保持羊肉的色泽。本结果与李立杰等[18]研究南美白对虾贮藏时色差的变化结果一致。

图3 不同冻结方式对大黄鱼肌原纤维组织微结构的影响Fig.3 Effects of freezing methods on the myofibril microstructure of large yellow croaker
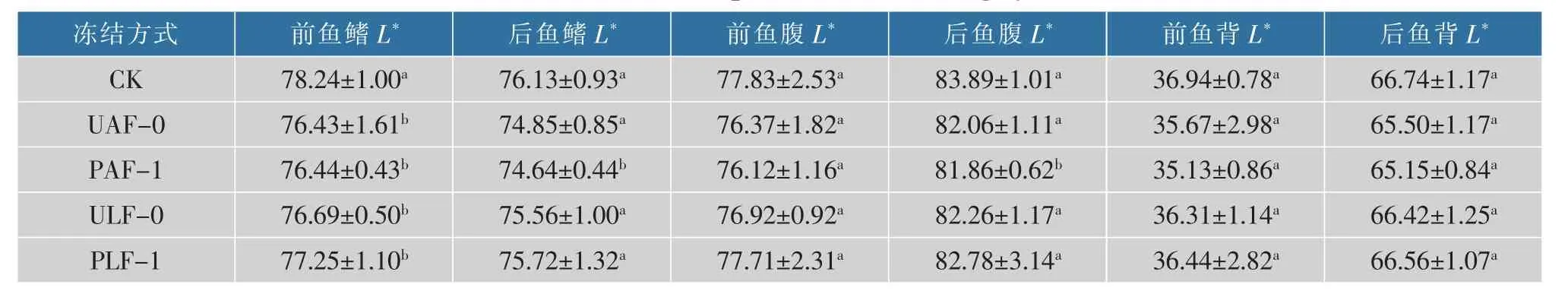
表1 养殖大黄鱼各部位L*值Table 1 L*values of various parts of cultured large yellow croaker

表2 养殖大黄鱼各部位a*值Table 2 a*values of various parts of cultured large yellow croaker

表3 养殖大黄鱼各部位b*值Table 3 b*values of various parts of cultured large yellow croaker
2.4 恒温蓄冷剂冻结对质构的影响
质构是判断大黄鱼鲜度的重要指标。其中,硬度和弹性作为检测大黄鱼品质重要测试指标[19]。不同冻结方式下的大黄鱼肉硬度不同程度的下降。PLF-1组下降6.8%,且差异性显著(P<0.05),最接近对照组。空气冻结组(PAF-1、UAF-0)分别下降26%及31.1%。此结果表明恒温蓄冷剂冻结结果优于空气冻结组,并且PLF-1组最接近新鲜组,这可能是由于真空包装恒温蓄冷剂状态下其冻结速度较快,冻结时形成的冰晶体较小,进而在解冻过程中水分流失较小,蛋白质冷冻变性比较小等,使得PLF-1硬度值下降最低[20-21],见图4。
经过不同方式处理下的大黄鱼咀嚼性均有不同程度的下降,且差异极显著(P<0.01)。PLF-1和PAF-1组分别下降1.2%和3.7%。UAF-0组下降幅度达到11.5%。有包装蓄冷剂冻结组优于单一蓄冷剂冻结组,表明真空包装冻结方式下鱼肉在抵抗硬物压入快速恢复变形能力很强[5]。另一方面说明鱼体在无包装情况下水分散失较快,造成了低温冻裂,使鱼肉的口感在逐渐降低[22]。
弹性中空气冻结组(PAF-1、UAF-0)下降幅度最大,差异极显著(P<0.01),恒温蓄冷剂冻结组(PLF-1、ULF-0)下降幅度较小。引起这种现象的原因可能是由于单一空气自然循环冻结中心温度下降较慢,整体冻结时间较长,大黄鱼体内的ATP酶活性较低,肌动球蛋白变性多,从而导致弹性下降程度较大[23]。
PLF-1组的恢复性最接近新鲜组,下降了1.9%。可能由于冻结时间较短,鱼肉的肌肉持水力较强,肌肉纤维较完整,从而恢复性下降缓慢。
综上所述,PLF-1组更有利于减缓养殖大黄鱼冻结质构特性发生劣变,较好地维持了口感。史咏梅等[9]也证明了真空包装联用液体冻结组效果较好。

图4 不同冻结方式对大黄鱼弹性的影响Fig.4 Effects of different freezing methods on the elasticity of large yellow croaker
2.5 恒温蓄冷剂冻结对大黄鱼pH值的影响
pH可以反映大黄鱼的新鲜度。由图5可知,新鲜组的大黄鱼pH值为6.72±0.01。大黄鱼处在僵硬期前,其体内糖类物质发生糖酵解反应产生乳酸等酸性物质,而使其体内的pH下降[11]。经不同冻结处理的大黄鱼pH均有不同程度下降,分别为:PLF-1<ULF-0<PAF-1<UAF-0,且差异极显著(P<0.01)。空气冻结组(PAF-1、UAF-0)pH下降明显大于恒温蓄冷剂组(ULF-0、PLF-1),PLF-1组最接近新鲜组,这是因为-25℃液态冻结的传冷速度快,使其快速冻结,从而抑制了ATP酶的代谢。并且经蓄冷剂冻结处理后,大黄鱼体内中心温度迅速下降,有效地减缓了体内乳酸的积累,缓解了pH的下降[24]。沈秋霞等[25]的研究也证明了真空包装可以有效减缓pH的降低。

图5 不同冻结方式对大黄鱼pH值的影响Fig.5 Effects of different freezing methods on pH of large yellow croaker
2.6 恒温蓄冷剂冻结大黄鱼盐溶性蛋白质量分数的变化
由图6可知,不同冻结方式下的大黄鱼的盐溶性蛋白质量分数整体下降。其中恒温蓄冷剂冻结组(ULF-0、PLF-1)下降较小,仅为2.9%和1.4%。空气冻结组(PAF-1、UAF-0)下降较显著,分别为6.5%和9.4%。在恒温蓄冷剂冻结条件下,有包装大黄鱼盐溶性蛋白质量分数高于无包装。以上结果表明蛋白质与水的相互作用减弱,而蛋白质分子内相互作用加强,导致蛋白质交联发生沉淀,最终导致盐溶性蛋白质含量降低[26]。这与刘书来等[27]对乌鳢的研究结论相似。

图6 不同冻结方式对大黄鱼盐溶性蛋白质量分数的影响Fig.6 Effects of different freezing methods on saltsoluble protein content of large yellow croaker
2.7 恒温蓄冷剂冻结方式下大黄鱼TVB-N质量分数的变化
大黄鱼中的TVB-N是由蛋白质的降解以及非蛋白氮化合物的生成而产生,主要由氨、次级产物和胺类组成[28]。不同冻结方式的大黄鱼TVB-N质量分数均增加。PAF-1组上升幅度最大,且差异极显著(P<0.01),上升55.3%,保鲜效果最差。PLF-1和ULF-0组分别上升了8.9%及13.5%,PLF-1组保鲜效果最好。恒温蓄冷剂冻结组(ULF-0、PLF-1)的TVB-N质量分数均小于空气冻结组(UAF-0、PAF-1)。吴迪迪等[29]研究发现冰藏联用ClO2保鲜方式可以有效抑制TVB-N的上升。唐智鹏等[30]采用聚乙烯醇/纳米二氧化钛/花青素薄膜包装处理组冻结处理大黄鱼,冻藏初始阶段这3种冻结方式下TVB-N值为13.97~14.17 mg/hg。PLF-1组最接近新鲜组,可能是由于将蓄冷剂提前预冷至-25℃冻结使鱼体温度迅速下降,有效减缓了微生物的生长繁殖,使蛋白质等物质的降解缓慢,从而抑制TVB-N的增长[31-32],见图7。

图7 不同冻结方式对大黄鱼TVB-N的影响Fig.7 Effects of different freezing methods on TVB-N of large yellow croaker
3 结语
不同冻结方式下,PLF-1组对大黄鱼的保鲜效果最好,最有利于品质的保持。其中冻结速率仅次于ULF-0组。pH、色差、肌肉组织的硬度、弹性、咀嚼性及恢复性效果均高于其他冻结组,盐溶性蛋白质量分数、TVB-N及扫描电镜观察对鱼肉组织的损伤性最小,优于其他方式的冻结组。

