多孔银-磁性甲壳素微球的制备及其抗菌性能
江承佳,余宁翔,熊 华
(食品科学与技术国家重点实验室,南昌大学,江西 南昌330047)
民以食为天,消费者对食品安全及品质的要求对食品的抑菌保藏性能提出更高的挑战。市场的需求推动了食品保藏技术的革新,近年来基于天然生物大分子如淀粉[1]、纤维素[2]、明胶[3]、甲壳素[4]等制备的抗菌材料用于食品包装及储藏材料备受关注。抗菌材料可以通过持续地释放抗菌剂防止食品腐败,延长食品货架期,实现包装食品内最少或无防腐剂添加,提升消费者对此类包装食品的可接受度。
甲壳素是由2-乙酰氨基-2-脱氧-D-吡喃葡萄糖和2-氨基-2-脱氧-D-吡喃葡萄聚糖以β-1,4糖苷键连接构成的线型聚合物,是地球上含量仅次于纤维素的第二大可再生多糖类资源[5],来源丰富,广泛存在于甲壳类动物的外壳、昆虫类动物的表皮以及藻类的细胞壁中[6],年生物合成量超过100亿吨。因其具有优良的生物安全性、可降解性以及抗菌性等性能,被广泛地应用于食品包装材料[7]、纳米材料[8-10]、抗菌材料[11-12]以及重金属吸附材料[13-14]等领域。甲壳素通过溶胶-凝胶法可制备三维多孔纳米纤维微球[15],其多孔结构为纳米级抗菌剂的加入提供了可能[16]。研究发现,纳米银具有抗菌谱广、细菌耐药性较低以及安全性高等特性,被认为是抑制细菌生长的良好抗菌剂[17-18]。近年来许多研究发现可以利用天然聚合物,例如淀粉[19]、葡聚糖[20]、纤维素[21]和甲壳素[22]等作为还原剂和稳定剂,通过原位合成法制备纳米银,制备过程更加绿色,使用更加安全。
本研究中通过溶胶-凝胶法制备磁性甲壳素纳米纤维微球,之后通过原位合成法将纳米银固定于甲壳素微球中。通过两步法合成银-磁性甲壳素微球,能够使小尺寸的纳米银与磁珠快速分散于甲壳素微球的三维多孔结构中。纳米纤维结构能够有效避免纳米银地聚集,并持续释放纳米银,达到长效抗菌活性。磁珠的加入赋予了甲壳素微球磁分离特性,可以实现对抗菌剂的回收再利用,避免过量的抗菌剂对人体、环境造成负担。结果表明银-磁性甲壳素微球可作为一种潜在的可回收型抗菌材料,有望在替代防腐剂降低食品中添加剂用量方面发挥重要作用。
1 材料与方法
1.1 材料与试剂
甲壳素:浙江金壳生物化学有限公司产品,使用前纯化[16];大肠杆菌(ATCC25922)、金黄色葡萄球菌(ATCC25923)、酵母提取物:广东环凯微生物科技有限公司;胰蛋白胨:上海盛思生化科技有限公司产品;琼脂:北京索莱宝科技有限公司产品;三氯化铁、柠檬酸三钠、乙酸钠、乙二醇、乙醇、氢氧化钠、尿素、异辛烷、硝酸银、柠檬酸钠、氯化钠等:均为国产分析纯。
1.2 仪器与设备
JSM 5600LV扫描电子显微镜(SEM-EDX)、
JEM-2010HR透射电子显微镜(TEM):日本电子株式会社产品;D8-FOCUS X射线衍射仪(XRD):德国Bruker公司产品;7407振动样品磁强计(VSM):美国LakeShore公司产品;ESCALAB X射线光电子能谱仪(XPS):德国Omicrometer公司产品;820电感耦合等离子体质谱仪(ICP-MS):美国瓦里安公司产品。
1.3 实验方法
1.3.1 磁珠的制备参照Ning等[23]的方法合成磁珠(Fe3O4NPs),略做修改。1.05 g三氯化铁,0.6 g柠檬酸三钠和3.6 g乙酸钠溶于60 mL乙二醇中,于室温下剧烈搅拌30 min。然后将所得混合物密封于内置聚四氟乙烯(100 mL)的高压釜中,在200℃下反应10 h。冷却至室温后通过磁铁收集黑色产物,通过乙醇和超纯水洗涤数次,并在60℃下干燥得到磁珠粉末。
1.3.2 磁性甲壳素微球的制备参照Duan等[16]的方法制备磁性甲壳素微球(Fe3O4-NMs)。将5 g纯化后的甲壳素粉末分散于含氢氧化钠、尿素和去离子水的混合溶液中(质量比8∶4∶88),通过反复冻融获得透明的甲壳素溶液。0.4 g磁珠经超声(5 min)分散于5 mL水中,与甲壳素溶液于0℃下混合。圆底烧瓶中加入1.1 g司班85和50 g异辛烷,0℃下1 000 r/min搅拌30 min后,加入磁珠-甲壳素混合物并继续搅拌1 h。随后加入0.6 g吐温85和3.5 g异辛烷继续搅拌1 h形成稳定的油包水型乳液滴,60℃水浴加热10 min。最后,通过磁铁分离产物,分别用水、乙醇、叔丁醇清洗3次,冻干后得到磁性甲壳素微球备用。
1.3.3 银-磁性甲壳素微球的制备参照Guo等[22]的方法略做修改,利用原位合成的方法制备银-磁性甲壳素微球(Ag-Fe3O4-NMs)。25 mg磁性甲壳素微球分散于12 mL硝酸银溶液(8 mmol/L)中,搅拌24 h后,加入0.8 mL柠檬酸钠溶液(50 mmol/L),并于80℃下搅拌约1.5 h直至悬浮液由黄色变为棕黑色。通过磁铁分离得到银-磁性甲壳素微球,水洗3次。
1.3.4 纳米银体外释放研究50 mg银-磁性甲壳素微球分散于10 mL水中,置于透析袋中(截留相对分子质量3.5×103)。采用磷酸盐缓冲液(PBS,pH 7.0)作为释放介质,将透析袋浸入1 000 mL PBS中,37℃、50 r/min振荡21 d。在特定时间点,移取10 mL释放介质并补充同体积新鲜介质,通过ICP-MS测定银质量浓度。
1.3.5 菌液的制备以大肠杆菌(ATCC25922)和金黄色葡萄球菌(ATCC25923)为模型菌。将2种模型菌接种至LB培养基(酵母提取物5 g,胰蛋白胨10 g,氯化钠5 g溶于1 L水;pH 7.0)中,37℃、180 r/min振荡培养24 h,当悬浮液细菌密度达到约108CFU/mL时,通过离心(4 000 r/min,10 min)收集细菌并用无菌去离子水洗涤3次,使用无菌磷酸盐缓冲液(PBS,0.01 mmol/L,pH 7.0)将细菌悬浮液稀释至105CFU/mL。
1.3.6 抗菌实验采用平板计数法评价银-磁性甲壳素微球的抗菌活性。分别向2 mL大肠杆菌和金黄色葡萄球菌悬浮液中加入50μL不同质量浓度的银-磁性甲壳素溶液,于37℃、180 r/min振荡下培养2 h。然后,移取所得混合物(50μL)涂布到LB琼脂平板中。在37℃培养24 h后,对培养板上的细菌菌落计数。对不同处理时间(15、60、120 min)以及不同银-磁性甲壳素微球质量浓度(6.25、12.5、25、50、100μg/mL)的抗菌效果进行评价。
1.3.7 细菌形态观察大肠杆菌经PBS,银-磁性甲壳素微球(50μg/mL)处理30 min后,加入预冷的戊二醛溶液(4%,体积分数)固定于盖玻片上(2.5 h,4℃),之后通过锇酸溶液(10 g/L)固定2 h。随后,在一系列乙醇溶液(体积分数30%、50%、70%、90%和100%)中分别脱水20 min。最后,经超薄切片,乙酸铀(20 g/L)染色后,置于铜网上用于透射电镜观察。
1.4 数据分析
每个实验3组平行,采用SPSS 17.0软件对实验数据进行分析,结果以平均值±标准偏差(X±SD)形式表示,通过Origin 2019软件进行作图。
2 结果与分析
2.1 磁珠的基本特性
利用乙二醇为还原剂,柠檬酸三钠为黏合剂,在高温环境下制备了Fe3O4NPs。通过TEM对磁珠形态外观进行观察,图1(a)和(b)可以看出Fe3O4NPs呈球形,大小均一,颗粒直径约在100~150 nm,表面粗糙,外部呈现较为疏松状态。图1(b)的插图为磁珠的晶体衍射图,由图可看出,Fe3O4NPs表现出良好的晶体特征。对磁珠进行EDX分析(见图1(c)),铁元素特征峰的出现进一步说明通过高温反应法成功制备了Fe3O4NPs。饱和磁化强度是磁性材料的重要磁性参数之一,通过VSM对Fe3O4NPs的磁性进行了测量,图1(d)结果表明Fe3O4NPs的饱和磁化强度值为(59.3±2.4)emu/g。此外,图1(d)插图结果表明,磁珠的磁化聚集时间约为30 s,表现出良好的磁化聚集特性。在撤去外加磁场后,由于轻微的剩磁性质,热扰动无法使磁珠重新分散,而当施加外力摇晃时,磁珠能够快速均匀分散。
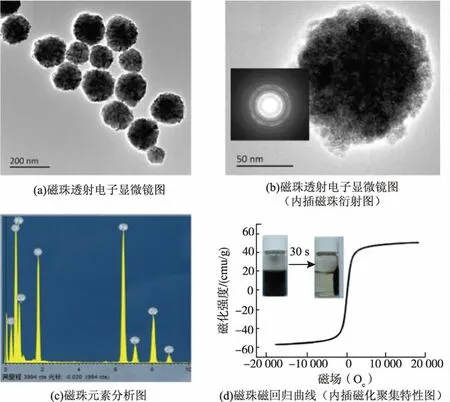
图1 磁珠基本特征分析Fig.1 Characterization of Fe3O4 NPs
2.2 磁性甲壳素微球的基本特性
通过SEM对Fe3O4-NMs进行外观形态观察(见图2(a)和(b)),可以看出Fe3O4-NMs呈球形,具有三维多孔纳米结构,且多孔之间相互连接。在甲壳素溶胶-凝胶过程中,凝胶时的相分离作用形成了微球的多孔结构[16]。多孔结构赋予了微球较大的运载能力,使得其能够成功地运载Fe3O4,并且为接下来原位合成运载纳米银提供了可能性。图2(b)显示Fe3O4-NMs内部呈纳米纤维状,且可观察到Fe3O4NPs嵌于纳米纤维结构中。从图2(c)的插图中可以看出,Fe3O4-NMs的粒径分布在10~50μm之间。EDX分析(见图2(c))中,铁元素峰的出现,进一步说明了微球中Fe3O4NPs的存在。图3(a)为Fe3O4-NMs的XRD图 谱,其 中,2θ=12.9°(021)、21.3°(110)、23.8°(101)和26.7°(130)为α-甲壳素的特征峰,衍射峰35.4°(311)和57.2°(511)为Fe3O4NPs的特征峰。Fe3O4NPs的成功运载赋予了微球磁分离能力,便于抗菌剂的回收,降低过量抗菌剂对环境造成的污染。
2.3 银-磁性甲壳素微球的基本特性
通过SEM对Ag-Fe3O4-NMs的外观形态进行观察(见图2(d)),与Fe3O4-NMs相比,银纳米粒子固定后,Ag-Fe3O4-NMs的外观形态以及粒径分布没有发生明显的变化(见图2(a)和(d)),这是由于纳米银是通过原位合成的方法固定在了Fe3O4-NMs的多孔结构[22]。但在固定纳米银后,Ag-Fe3O4-NMs呈现出相对较密的表面(见图2(e)),这可能是由于在甲壳素纳米纤维表面上形成了纳米银。同时,在Ag-Fe3O4-NMs的EDX分析中(见图2(f)),银元素峰的出现进一步表明了纳米银成功的固定在了Fe3O4-NMs上。据有关文献报道[24],甲壳素分子链上的酰胺键(N-C=O)能够与银原子形成配位键,使得银原子能够均匀地在甲壳素分子链上聚集。与Fe3O4-NMs相比较,Ag-Fe3O4-NMs的XRD图谱 中(见图3(a)),出现了4个新的衍射峰,分别位于38°(111)、44°(200)、64°(220)和77°(311),表明Ag晶体以面心立方(Face-centered cubic,Fcc)晶格形式存在于Fe3O4-NMs中[25-26]。有趣的是,在Ag-Fe3O4-NMs的XRD谱图中未出现Fe3O4NPs的特征峰,这可能是由于银的特征峰过强,掩盖住了Fe3O4NPs的特征峰,同时,α-甲壳素的特征峰也减弱了。为了进一步研究纳米银与甲壳素分子链之间的关系,对Ag-Fe3O4-NMs红外光谱进行了分析(见图3(b)),出现在3 470 cm-1为O-H的伸缩振动和甲壳素分子矩阵之间的氢键。在1 670 cm-1和1 580 cm-1的强烈振动分别归属于甲壳素分子中的酰胺I和酰胺II。1 070 cm-1为甲壳素分子中C-O-C的伸缩振动。对比Fe3O4-NMs和Ag-Fe3O4-NMs的红外光谱可以发现,在固定纳米银的过程中,甲壳素的主要结构没有发生改变。

图2 Fe3O4-NMs的SEM外形观察分析Fig.2 SEM images of Fe3O4-NMs
2.4 银-磁性甲壳素微球中纳米银的释放研究
银的释放速率是评价银基抗菌材料性能的重要指标之一[27]。研究报道,当银质量浓度达到0.1 μg/L时即能有效抑制细菌的生长[25]。本研究中分析了在中性pH环境下,Ag-Fe3O4-NMs中银的释放行为(见图3(c))。结果表明,第1天Ag释放质量浓度约为(10.3±1.4)μg/L,能有效地抑制细菌的生长。Ag-Fe3O4-NMs中Ag的释放量在5 d内急剧增加,在第5~21天时逐渐减缓,21 d Ag累计释放量约为(264±16)μg/L,低于毒性质量浓度(10 mg/L)[28]。表明Ag-Fe3O4-NMs具有长期且稳定的Ag释放活性,有助于在细菌表面快速达到并保持有效抗菌浓度,防止纳米银在凋亡细菌或者介质中发生聚集,从而增强抗菌效果。

图3 Fe3O4-NMs及Ag-Fe3O4-NMs XRD图谱、红外光谱;Ag-Fe3O4-NMs中Ag释放量Fig.3 XRD analysis and FT-IR spectrum of Fe3O4-NMs and Ag-Fe3O4-NMs,respectively;cumulative release amount of sliver from Ag-Fe3O4-NMs in PBS
2.5 银-磁性甲壳素微球的抗菌评价
为了研究Ag-Fe3O4-NMs的抗菌性能,通过测定细菌的生存能力(菌落计数)对Fe3O4NPs、Fe3O4-NMs和Ag-Fe3O4-NMs的抗菌能力进行了定性评估(25μg/mL,120 min)如图4(a)所示,对于Fe3O4NPs、Fe3O4-NMs处理组,培养基上仍长有大量菌落,与PBS处理组无明显区别,表明较低质量浓度的Fe3O4NPs、Fe3O4-NMs对大肠杆菌和金黄色葡萄球菌均无明显抗菌作用,同时反映出甲壳素微球在装载了Fe3O4NPs之后并不能提高其抗菌性能。而Ag-Fe3O4-NMs组大肠杆菌的生长受到了明显的抑制,同时绝大多数金黄色葡萄球菌的生长受到了抑制。
为了进一步评价其抗菌性能,对不同处理时间(15、60、120 min)和不同Ag-Fe3O4-NMs质量浓度(6.25、12.5、25、50、100μg/mL)的抗菌效果进行了测试。图4(b)和(c)分别为Ag-Fe3O4-NMs处理后大肠杆菌和金黄色葡萄球菌的存活率。对2种细菌,Ag-Fe3O4-NMs呈现出类似的抗菌效果,在开始阶段细菌存活率快速降低,随着处理时间的增加而趋于平稳。随着Ag-Fe3O4-NMs质量浓度的增加,2种菌的存活率逐渐降低,说明Ag-Fe3O4-NMs的抗菌效果具有质量浓度相关性。当Ag-Fe3O4-NMs质量浓度增加后,其抗菌效果由抑制转变为灭菌。在相同的Ag-Fe3O4-NMs质量浓度及处理时间下,大肠杆菌和金黄色葡萄球菌的存活率有所不同。大肠杆菌经12.5μg/mL的Ag-Fe3O4-NMs处理60 min后,其存活率为(54.0±4.7)%,而对于金黄色葡萄球菌,相同处理时间,需要约40μg/mL的Ag-Fe3O4-NMs才能达到相同的抑制效果。当Ag-Fe3O4-NMs质量浓度达到50μg/mL,经60 min处理后,大肠杆菌将完全丧失活力,金黄色葡萄球菌在50μg/mL和120 min处理条件下也将完全丧失活力。二者对抗菌剂敏感性的差异是由于革兰氏阴性菌在细胞质和外膜之间只有一层薄薄的肽聚糖层(约2~3 nm),而革兰氏阳性菌的肽聚糖层更厚(约30 nm),使得金黄色葡萄球菌有更强的耐抑制力[29-30]。
2.6 银-磁性甲壳素微球抗菌机理研究
利用TEM证实了细菌与抗菌材料的相互作用。如图4(d)所示,未经处理的大肠杆菌表面光滑完整,无任何破裂,且细胞内物质饱满无空缺。而经Ag-Fe3O4-NMs处理后(见图4(e)),大肠杆菌的杆状结构遭到破坏,细菌表面变的粗糙且有塌陷和起皱现象,细胞内的物质出现泄漏,细胞内物质密度急剧下降,部分杆菌出现菌体收缩。TEM的结果进一步说明Ag-Fe3O4-NMs能够破坏细菌表面结构,从而杀灭细菌。
通过上述抗菌实验,抗菌机理可能为:通过静电相互作用,Ag-Fe3O4-NMs能够轻松的识别并捕获带负电荷的细菌,并在细菌周围持续释放纳米银发挥抗菌活性。纳米银会造成细菌结构的破坏,并穿透细胞质,使得蛋白质与酶失活,实现抗菌作用。在本研究中,大部分的纳米银固定在Ag-Fe3O4-NMs的表面,使得纳米银能够从微球中快速释放,短时间内达到有效抗菌质量浓度,并能在后续很长一段时间内持续释放纳米银,维持有效抗菌质量浓度,在生物安全剂量内发挥抗菌活性。

图4银-磁性甲壳素微球抗菌机理示意Fig.4 Schematic diagram of antibacterial mechanism of Ag-Fe3O4-NMs
3 结语
通过甲壳素纳米纤维的自组装作用以及原位合成法成功制备了银-磁性甲壳素微球,通过扫描电子显微镜可观察到三维多孔纳米纤维结构,磁珠、纳米银嵌于纤维结构之中。微球中纳米银的突释以及持续释放使其具有快速、长效的抗菌活性,抗菌试验结果表明磁珠以及磁性甲壳素微球均不具有抗菌能力,而银-磁性甲壳素微球对大肠杆菌以及金黄色葡萄球菌均呈现质量浓度相关性抗菌作用,且抗大肠杆菌效果更佳。微球可通过静电相互作用识别捕获细菌,通过破坏细菌细胞结构完整性,使其内容物流出,生物活性大分子失活达到抗菌作用。天然的可再生资源以及绿色的制备条件赋予了银-磁性甲壳素微球良好的生物安全性以及生物相容性,磁珠的加入赋予了抗菌微球分离回收再利用的能力,降低对环境的污染,为减少食品中防腐剂的添加、延长货架期提供新思路。

