液相色谱-串联质谱法测定餐具洗涤产品中的姜酚和姜烯酚
陈意光 张沛林 谭焯针 王宏海 夏泽敏 谭建华
(广州质量监督检测研究院, 广州 511447)
生姜具有解毒止呕、镇痛消炎、营养保健、抗菌、抗氧化作用,在医药、保健、食品、化妆品等领域都具有较高的应用价值[1-5]。生姜的化学成分很复杂,目前已发现的成分就有140多种。研究表明,姜辣素是生姜的主要功效成分。姜辣素的分子式中均有3-甲氧基-4-羟基苯基的官能团,根据此官能团连有脂肪链的不同分为姜酚类(gingerols)、姜烯酚类 (shogaols)、姜酮 (zingerones) 、姜二酮类(zingerdiones)和姜二醇类(ginerdiols)等类型[3]。姜酚呈黄色油状液体,是一类6-姜酚、8-姜酚、10-姜酚等的混合物(图1)。姜烯酚在生姜中的含量较低。
目前针对姜酚和姜烯酚的检验方法主要是采用高效液相色谱法、高效液相色谱-串联质谱法。检测基质包括生姜、生姜提取物、食品等[5-11]。国内执行标准包括GB//T22293-2008《姜及油树脂主要刺激成分测定 HPLC法》[11]。在餐具洗涤剂产品质量比对项目调研中,可见部分产品标示添加姜成分,但是目前国内尚未有洗涤剂中姜酚和姜烯酚的检测方法,企业和消费者均无法得知餐具洗涤产品是否存在姜成分,含量有多少。因此建立餐具洗涤产品中姜酚,姜烯酚的检测方法,对维护消费者权益,开拓姜产品应用领域,并为企业把控产品质量,形成国际竞争力提供重要技术支撑,十分必要。
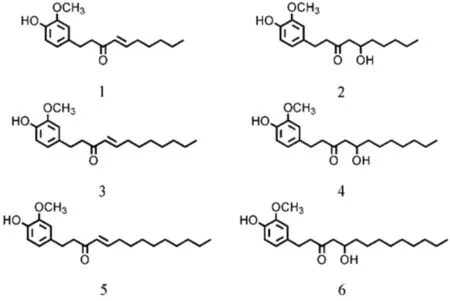
图1 6种化合物的化学结构
1 材料与方法
1.1 试剂,仪器和样品
1.1.1试剂和仪器
6-姜酚(6-Gingerol,CAS 23513-14-6,纯度98%);8-姜酚(8-Gingerol,CAS 77398-92-6,纯度99%);10-姜酚(10-Gingerol,CAS 107257-18-1,纯度99%):标准品,Stanford Chemicals; 6-姜烯酚(6-Shogaol,CAS 23513-13-5,纯度97%),8-姜烯酚(8-Shogaol,CAS 104186-07-4,纯度90%),10-姜烯酚(10-Shogaol,CAS 104186-05-2,纯度90%):标准品,Standard。
乙腈、甲醇、丙酮、二氯甲烷:色谱纯,美国Fisher;甲酸:色谱纯,德国CNW;无水硫酸钠、25%氨水、正丁醇:分析纯,广州化学试剂厂;硅胶小柱:2g, 6mL,德国CNW,使用前先用6mL酸化二氯甲烷活化;超纯水:实验室自制。
液相色谱-串联质谱仪:Ulti mate 3000-TSQ Quantiva,美国Thermo fisher Scientific公司;涡旋混合仪:MinishakerMS3 digital,德国IKA公司;超声波清洗仪:SK8200H,上海科导超声仪器公司;氮吹浓缩仪器:EFAA-DC24-RT,上海安谱公司;离心机:Mini Spin,德国Eppendorf公司;天平:CPA225D和BSA224S,瑞士Sartorius公司;超纯水仪:Mill-Q,美国Merck millipore公司。
1.1.2材料
共20份样品来源于不同品牌,购自广州本地商场。其中样品1到样品4用于加标实验。
1.2 实验方法
1.2.1标准溶液的配制
标准储备溶液:分别称取标准品于10mL容量瓶中,用甲醇定容到刻度,摇匀,配制成浓度为1.0 mg/mL的标准储备液,-20℃存放。
标准中间液1:移取1mL标准储备液于100mL容量瓶中,用甲醇定容到刻度,摇匀,配制成浓度为10mg/L的标准中间液,-20℃存放。
标准中间液2:移取1mL标准中间液1于10mL容量瓶中,用甲醇定容到刻度,摇匀,配制成浓度为1000 μg/L的标准中间液,使用前配制。
工作液:将标准中间液2用甲醇逐级稀释,配制成浓度分别为0、4.0、8.0、20.0、40.0、80.0、120.0、160.0μg/L的标准工作液,使用前配制。
1.2.2溶液配制
提取液:移取10mL甲酸,10mL甲醇溶液到1L容量瓶中,用二氯甲烷定容到刻度。
酸化二氯甲烷溶液:移取10mL甲酸溶液到1L容量瓶中,用二氯甲烷定容到刻度。
洗脱溶液:移取10mL甲酸溶液到1L容量瓶中,加入100mL丙酮,用二氯甲烷定容到刻度。
流动相A:移取10mL正丁醇,0.1mL氨水到1L容量瓶中,用水定容到刻度。
流动相B:移取10mL正丁醇,0.1mL氨水到1L容量瓶中,用乙腈定容到刻度。
1.2.3仪器条件
色谱柱: Waters Acquity BEH-C18 1.7μm,2.1 mm50 mm;流速:0.3 mL/min;柱温: 30℃;进样体积:3L。流动相梯度洗脱程序:0min,35%B,1min,35%B,5min,80%B,7min,80%B,7.5min,35%B,10min,35%B。
ESI离子源,负离子模式;喷雾电压:3000V;鞘气:50Arb,辅助气:10Arb;离子源温度:280℃,传输管温度300℃。选择反应监测(SRM),各化合物监测离子对信息见表1;离子对驻留时间:软件自动设定。
1.2.4样品前处理
称取1.0g样品于15mL塑料离心管中,加入10mL提取液,涡旋混匀,加入3g无水硫酸钠,再次涡旋混匀后,于离心机6000rpm离心5min。取2mL提取液于预先活化的硅胶小柱,待自然流干后,加入2mL洗脱溶液,自然流干。上柱液和淋洗液均弃去。再加入5mL洗脱溶液,完全收集于氮吹试管中。40℃氮气吹干后,用0.5mL甲醇溶解残渣,溶液过0.22μm有机滤膜后待测。
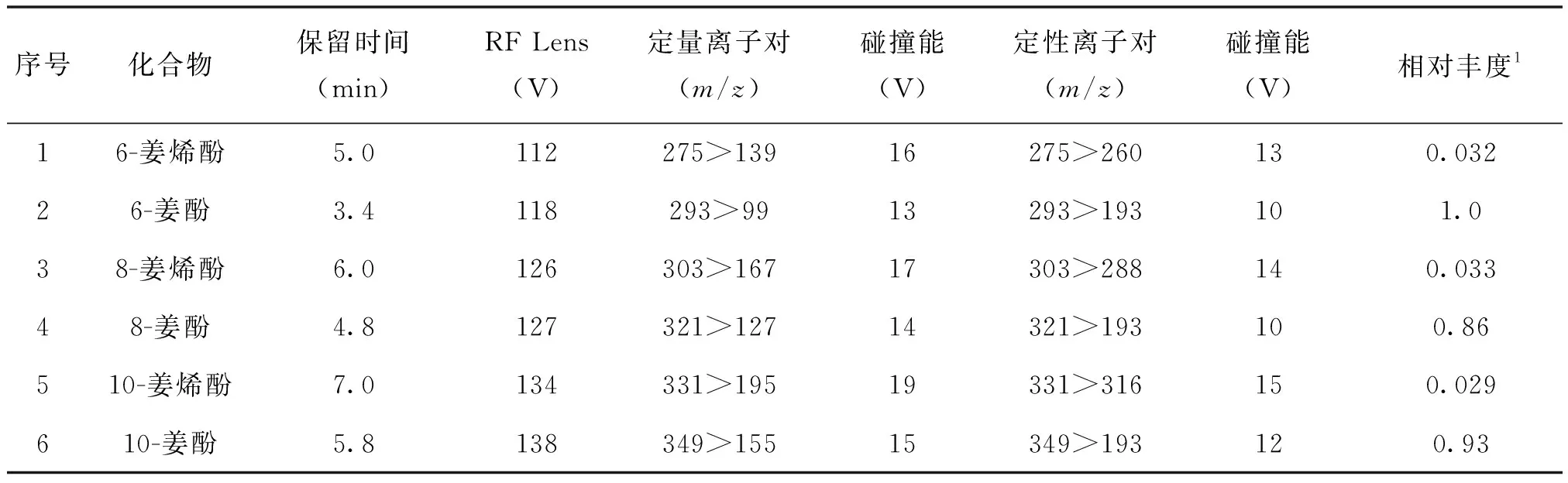
表1 6种化合物的保留时间和离子对参数
注1:定性离子峰高与定量离子峰高的比值
1.2.5实验结果计算
样品中含量按式(1)计算。
(1)
其中:c为样品上机溶液从工作曲线计算得到的浓度,μg/L;V为定容体积,mL;m为称样量,g;
1.2.6加标实验
对4种样品做标准添加实验,其中样品1添加10μg/kg、80μg/kg、400μg/kg 3个浓度,样品2、样品3、样品4添加80μg/kg 1个浓度。根据测定结果计算平均回收率和相对标准偏差。
2 结果与讨论
2.1 实验条件的优化
2.1.1前处理条件的优化
由于姜酚和姜烯酚在二氯甲烷中有较好的溶解性,方法采用添加少量甲酸和甲醇的二氯甲烷提取,可以增加二氯甲烷的萃取效率,并用硫酸钠脱水,经过离心处理后,可去除基质中的水、亲水性物质和部分表面活性剂。
由于表面活性剂具有极性基团,实验采用硅胶小柱吸附表面活性剂,并考察了丙酮、二氯甲烷+丙酮=9+1,二氯甲烷3种洗脱溶剂(洗脱体积为6mL)的净化效果。结果表明采用丙酮为洗脱溶剂,经净化后的样品仍然有较强的基质效应,未能实现净化效果。采用二氯甲烷作为洗脱液,姜酚和姜烯酚未能洗脱。采用二氯甲烷+丙酮=9+1可以将样品中的大部分基质效应去除,各化合物回收率接近100%。实验最终采用二氯甲烷+丙酮=9+1作为洗脱溶剂。采用丙酮和二氯甲烷+丙酮=9+1两种洗脱溶剂的基质效应见表2,基质效应以浓度为40μg/L空白基质标准溶液和标准溶液中化合物的峰面积百分比表示。ND表示受基质抑制,未出峰。
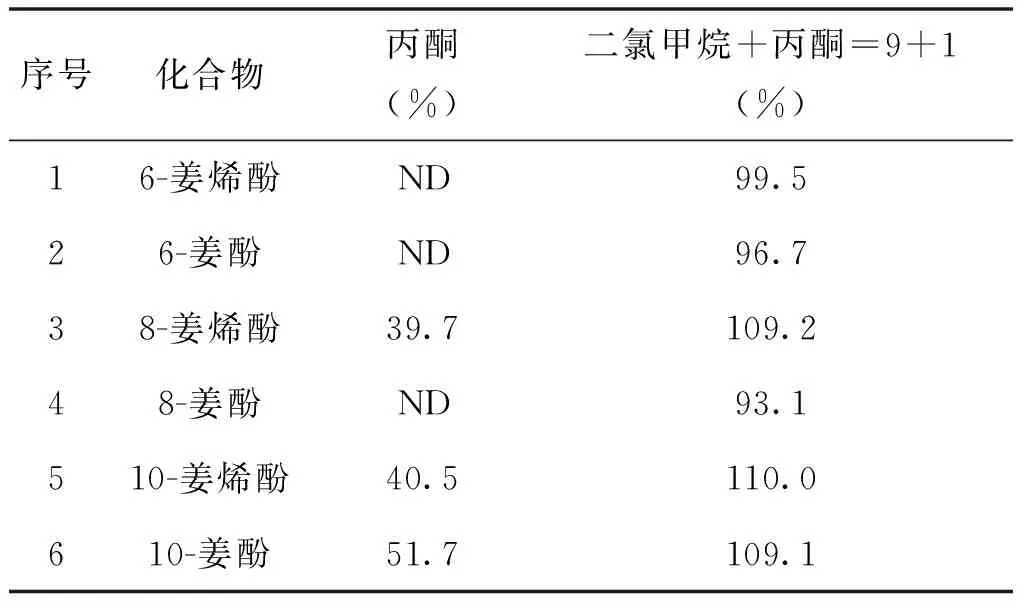
表2 6种化合物在两种洗脱溶液中的基质效应
实验进一步比较了3mL、4mL、5mL、6mL、7mL5种洗脱体积。洗脱体积在3mL时,姜酚和姜烯酚未洗脱;4mL开始有姜酚和姜烯酚被洗脱;至6mL,各化合物的响应不再增加。实验最终确定洗脱液接收体积为第3mL到第7mL,共收集5mL。
2.1.2仪器条件的优化
6种化合物在乙腈-水体系中可以实现分离。氨水的添加可以显著的提高化合物的离子化效率,各化合物响应可显著提高。正丁醇的加入可以在此基础上更进一步提高各化合物的响应。实验比较了0.2%、0.5%和1.0%的正丁醇添加量,结果表明1.0%的正丁醇响应最高。考虑到更高浓度的正丁醇会提高流动相的沸点和粘度等性质,未再提高正丁醇浓度。
采用超高效液相色谱柱,梯度洗脱条件经优化后,6个化合物在十分钟的色谱时间实现完全分离,各化合物峰型尖锐,峰宽约0.2min。
化合物母离子的离子源条件通过TSQ Quantiva 2.0 Tune软件人工优化得到,子离子选择和碰撞能通过TSQ Quantiva 2.0 Tune软件自动优化得到。
2.2 实验结果
2.3.1仪器检出限,方法检出限,工作曲线
在本实验条件下,工作曲线、仪器检出限(定性离子信噪比为S/N=3所对应的标准溶液浓度)及对应的方法检出限见表3,工作曲线见表3。6种成分在测定范围内与色谱峰峰面积均呈良好的线性关系,且该方法具有较高的灵敏度。标准溶液色谱图见图2。
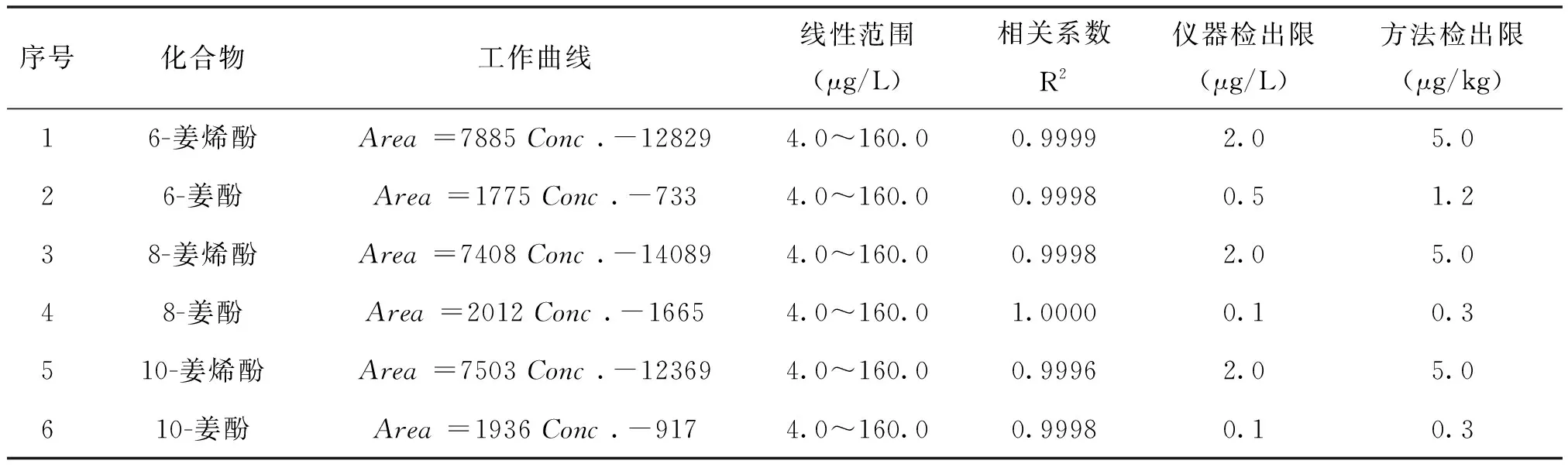
表3 6种化合物的工作曲线和检出限

图2 160 μg/L标准溶液定量离子对色谱图
2.3.3方法的准确性和精密度和检测限
在不同基质的加标回收实验中,方法回收率实验结果见表4。方法的平均回收率在86.6%到118.3%之间,相对标准偏差在0.7%到6.1%之间。方法的准确性和精密度好。阴性样品加标色谱图见图3。
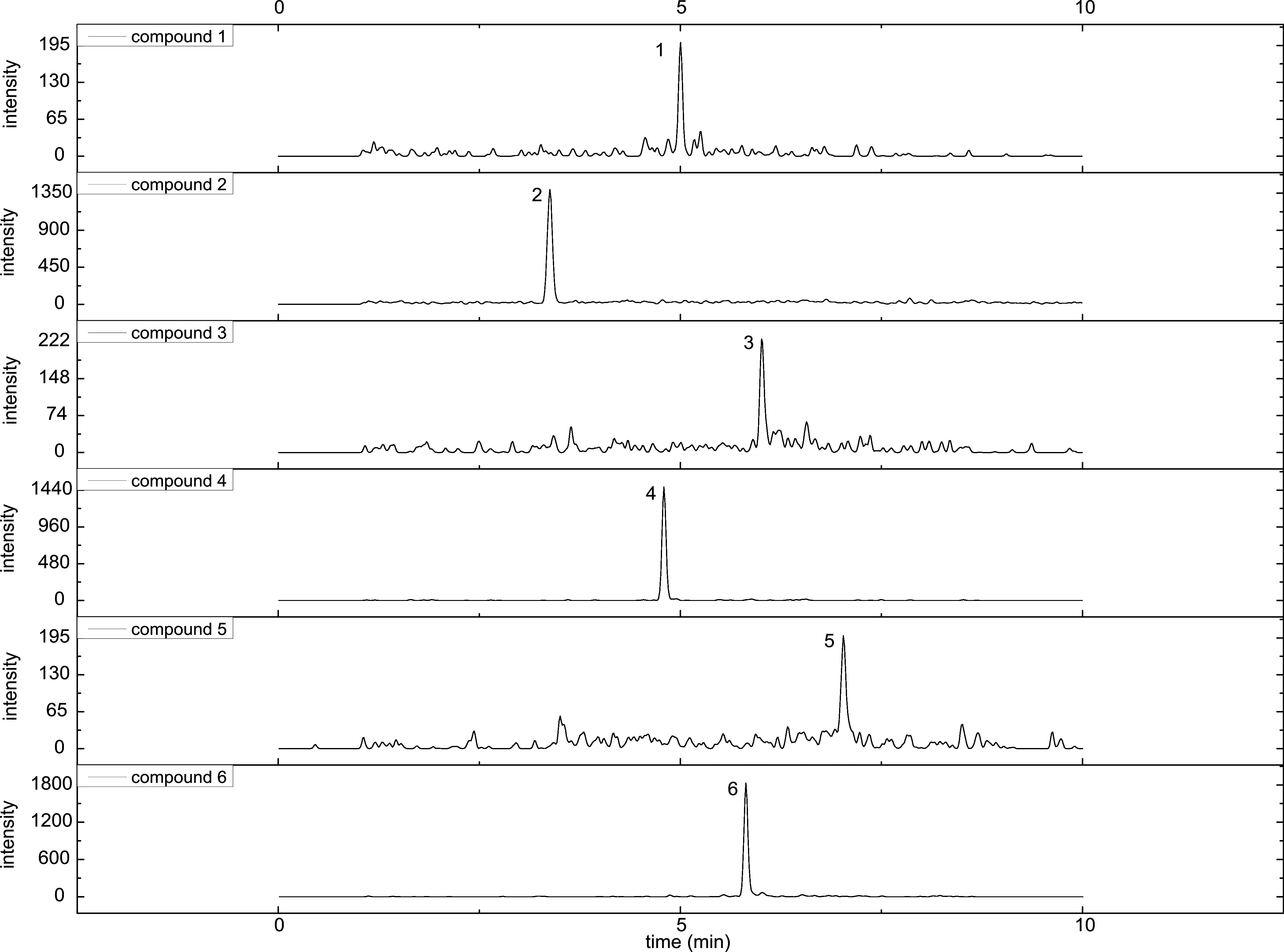
图3 10.0μg/kg加标样品定性离子对色谱图
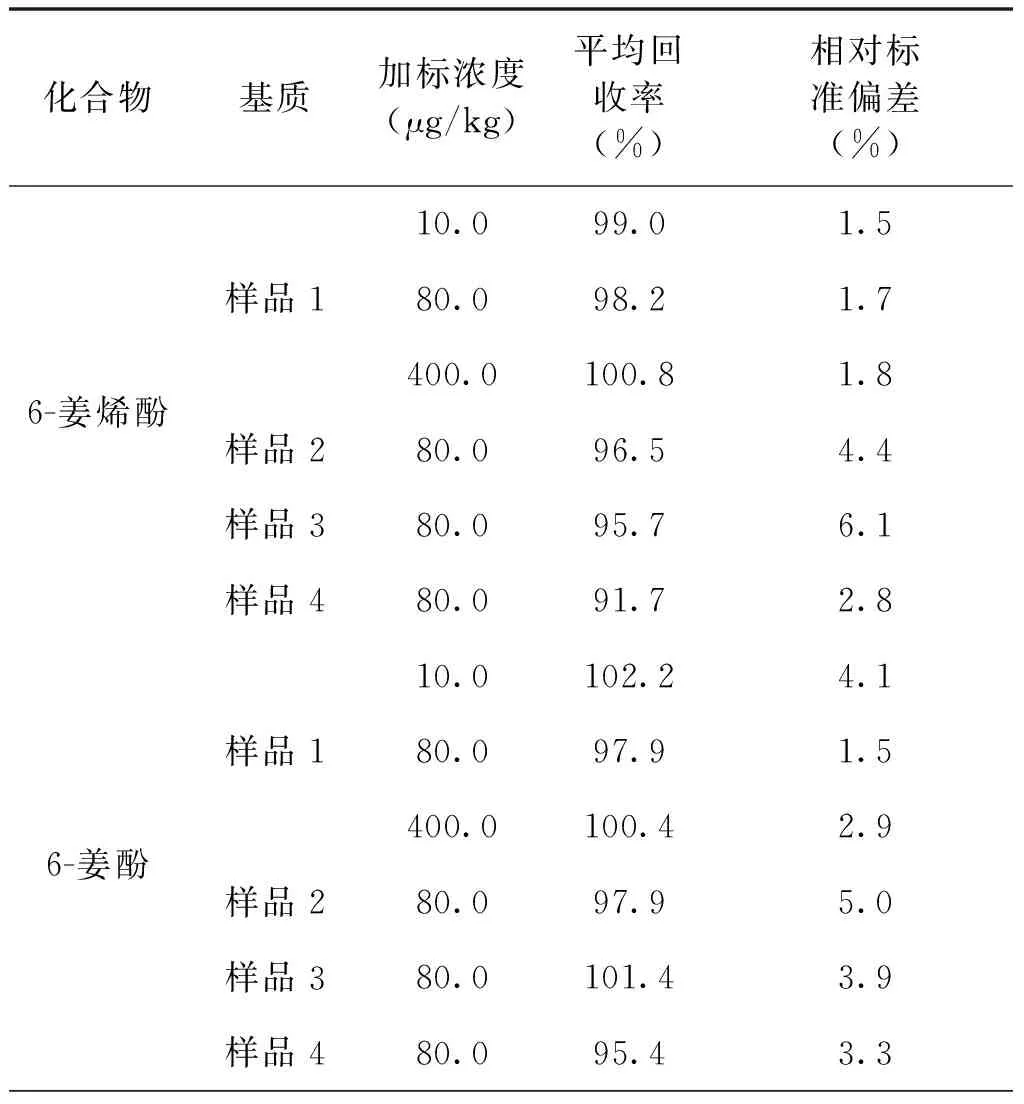
表4 在4个基质中的添加回收结果
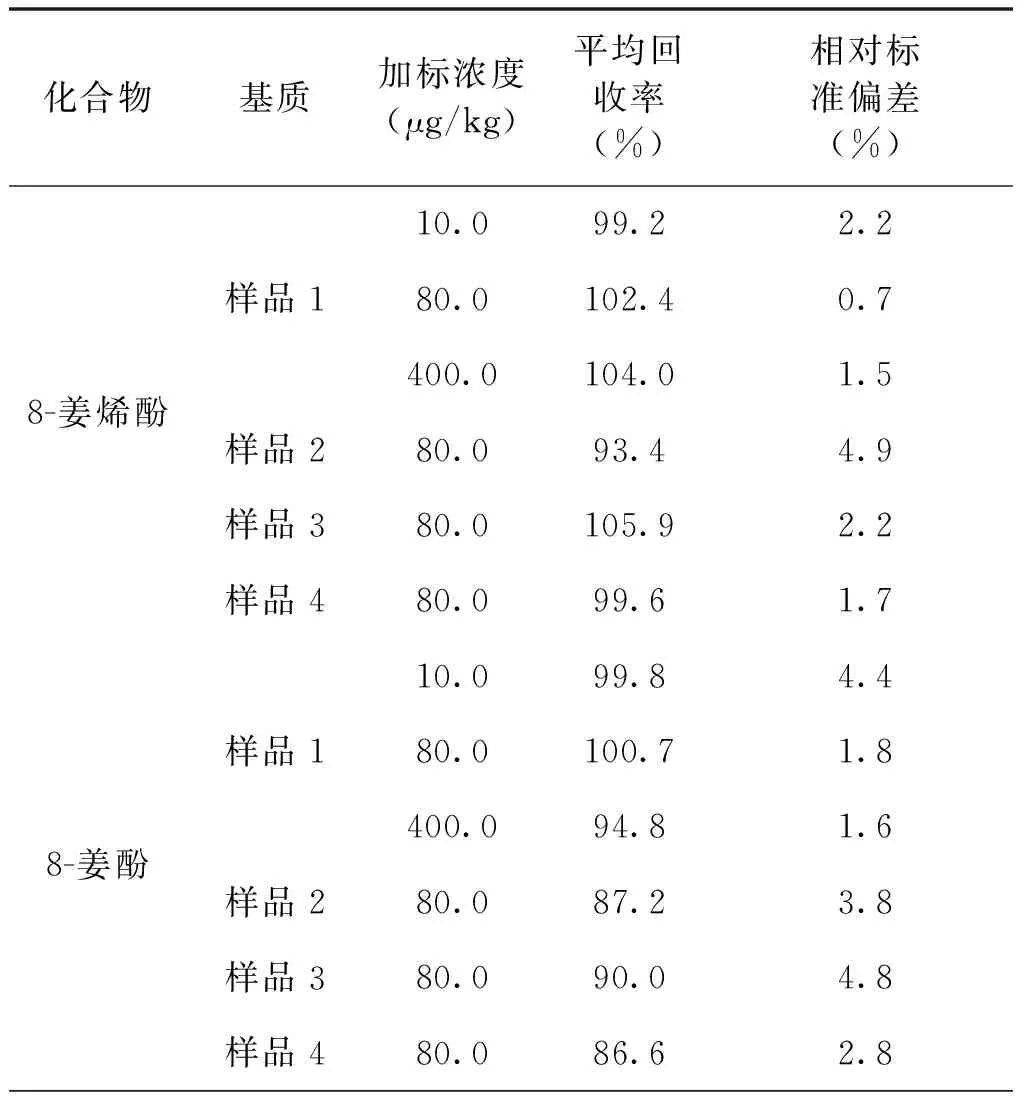
续表4

续表4
2.3.4洗洁精样品中姜酚和姜烯酚的检测
研究小组采用本方法对20批洗洁精样品中姜酚和姜烯酚含量进行测定。结果显示,1批次样品检出姜酚和姜烯酚,结果分别为6-姜烯酚65.2μg/kg,6姜酚100.7μg/kg,8-姜烯酚18.8μg/kg,8-姜酚20.1μg/kg,10-姜烯酚38.1μg/kg,10-姜酚38.5μg/kg。
3 结论
本实验首次采用硅胶小柱净化,液相色谱-串联质谱法测定洗洁精产品中的6种姜酚和姜烯酚。方法灵敏度高,准确性好,精密度高,通用性好。是检测洗洁精产品中姜特征成分的合适方法。对维护消费者权益,开拓姜产品应用领域,并为企业把控产品质量,形成国际竞争力提供重要技术支撑。对其他洗涤产品中姜酚、姜烯酚的检测有一定的参考意义,具有较好的应用前景。

