超声辅助提取紫贻贝加工下脚料抗菌肽工艺优化
张 玥 杨玉霞 时光宇 赵莘芷 潘渊博 徐琼怡
(浙江海洋大学东海科学技术学院,浙江 舟山 316000)
紫贻贝(MytilusedulisLinnaeus)俗称“海红”“淡菜”,广泛分布于中国黄海、渤海、东海和南海北部,是中国主要的海洋经济贝类。紫贻贝生产季节性强、产量大、鲜活易腐不耐贮藏,会产生大量的加工下脚料——含闭壳肌的熟贝壳、蒸煮液、受损的和小规格(<6 cm)的紫贻贝(蛋白含量为10%~23%)等[1]。目前,该下脚料的利用研究主要集中于贝壳和蒸煮液,如贝壳粉(CaCO3)/贝壳煅烧粉(CaO)作为聚丙烯塑料填充料[2]和食源性致病菌抑菌剂[3]等,蒸煮液制备海鲜调味品[4]等,而受损/小规格紫贻贝的利用研究相对较少,Beaulieu等[5]利用复合蛋白酶水解受损/小规格紫贻贝制备抗增殖活性多肽。
近年来,随着细菌对抗生素耐药性、抗生素残留等问题日益严重,亟需寻找新型抗菌活性物质。滤食性动物贻贝长期生活在富含各种微生物水环境中(菌落总数高达6 lg CFU/mL)[6],由于贻贝缺乏特异性的免疫系统,所以其免疫防御主要通过细胞(吞噬、包囊和呼吸爆发等)和体液(凝集素、溶酶体酶、抗菌因子等)进行免疫防御[7]。相对于其他双壳贝类而言,抗菌肽在贻贝抵御致病菌侵袭中发挥着重要作用[8]。抗菌肽具有抑菌活性强、抑菌谱广、不产生耐药性以及无有害残留等优点。目前,从贻贝的血细胞、鳃和消化腺中鉴定出多种抗菌肽,按其序列特征可分为6个家族[9],即defensins、myticins、mytilins、mytimycins、big defensins和mytimacins。常见的贻贝抗菌肽制备方法有:① 利用甲醇[10]、乙酸溶液[11]、三氟乙酸溶液[12]、Tris-HCl/磷酸盐缓冲液[13]等试剂浸渍提取贻贝抗菌肽,该方法可完全保持抗菌肽原有生物活性,但得率低且需大量原材料;② 采用化学合成法[14-15],该方法存在成本高以及溶剂残留等问题。
超声波辅助提取法因超声波机械效应和空化效应等特性具有得率高、提取时间短、溶剂使用量少等特点而被广泛应用于蛋白质及酶的提取[16]。黄占旺等[17]对鲤鱼鱼卵中鱼精蛋白的超声波辅助硫酸提取工艺进行了优化,结果表明,超声波辅助提取技术可使硫酸浓度和提取时间分别由7.5%、2 h减至5.0%、20 min,且获得的鱼精蛋白具有较高抑菌活性;Yuan等[18]研究解淀粉芽孢杆菌(B.amyloliquefaciensstrain NJN-6)发酵液中抗真菌脂肽(iturin A和fengycin)的超声波辅助正丁醇提取工艺,发现在超声波功率200 W、提取时间8 min、提取次数2次、正丁醇与发酵液体积比3∶25条件下抗真菌脂肽得率最高。而有关超声辅助提取贻贝抗菌肽的研究尚未见报道。试验拟采用超声辅助乙酸提取紫贻贝加工下脚料中的抗菌肽,并对其提取工艺进行优化,以期建立一种工艺操作便捷合理、得率高和抑菌活性好的提取工艺,为紫贻贝加工下脚料的开发利用提供依据。
1 材料与方法
1.1 材料与试剂
紫贻贝加工下脚料:受损的和小规格的紫贻贝,收集后速冻并装入碎冰泡沫箱,舟山市某水产公司;
金黄色葡萄球菌(GIM1.178):广东省微生物菌种保藏中心;
胰酪大豆胨液体培养基(Trypticase Soy Broth Medium,TSB)、胰酪大豆胨琼脂培养基(Trypticase Soy Agar Medium,TSA):杭州微生物试剂有限公司;
冰乙酸:分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
组织捣碎机:Waring-8010S型,美国Waring公司;
超声波清洗器:SK5210HP型,上海科导超声仪器有限公司;
冷冻干燥机:LGJ-10型,北京松原华兴科技发展有限公司;
立式压力蒸汽灭菌器:BXM-50M型,上海博迅医疗生物仪器股份有限公司;
生化培养箱:SPX-150B-Z型,上海博迅医疗生物仪器股份有限公司。
1.3 方法
1.3.1 抗菌肽的制备
(1) 超声辅助乙酸法:采用先煮沸,再匀浆,然后超声辅助提取工艺。紫贻贝加工下脚料(受损的和小规格的紫贻贝)半解冻后取肉、清洗、沥干。准确称取40 g紫贻贝肉加入至500 mL蓝盖螺口试剂瓶中,加入一定体积的预热至80 ℃的一定质量分数的乙酸溶液,沸水浴30 min,冰水浴中冷却至室温,混合物倒入匀浆器中,18 000 r/min 匀浆20 s,倒入烧杯中,置于冷却水循环的超声波清洗器内,超声提取抗菌肽,12 000 r/min离心30 min,上清液冻干后即为紫贻贝抗菌肽。
(2) 传统乙酸法:下脚料预处理同超声辅助乙酸法,准确称取40 g紫贻贝肉加入至500 mL蓝盖螺口试剂瓶中,加入一定体积的预热至80 ℃的一定质量分数的乙酸溶液,沸水浴30 min,冰水浴中冷却至室温,18 000 r/min匀浆20 s,倒入烧杯中,置于冷却水循环的超声波清洗器内,浸渍提取一定时间后,12 000 r/min离心30 min,上清液冻干后即为紫贻贝抗菌肽。其中,乙酸质量分数、液料比和提取时间均为相应超声辅助乙酸法的优化工艺条件。
1.3.2 超声辅助乙酸法提取工艺优化
(1) 单因素试验:考察不同乙酸质量分数、超声提取时间、液料比对抗菌肽得率的影响,其基本提取条件为超声功率200 W、乙酸质量分数1.0%、超声提取时间15 min、液料比(V乙酸∶m紫贻贝)6∶1 (mL/g),分别考察乙酸质量分数(0.2%,0.4%,0.8%,1.6%,2.0%)、超声提取时间(5,10,15,20,25 min)、液料比[V乙酸∶m紫贻贝分别为2∶1,4∶1,6∶1,8∶1,10∶1 (mL/g)]对多肽得率和抑菌活性的影响。
(2) 响应面优化试验:在单因素试验基础上,选取乙酸质量分数、超声提取时间、液料比为自变量,抗菌肽得率为响应值,采用Box-Benhnken中心组合原理,设计三因素三水平的响应面试验,优化超声辅助乙酸提取紫贻贝下脚料抗菌肽工艺。
1.3.3 抗菌肽得率测定 采用Bradford等[19]的方法测定上清液中总蛋白含量,以牛血清蛋白作为标准物,绘制标准曲线(y=0.003 6x+0.286,R2=0.995 1)。按式(1)计算抗菌肽得率。
(1)
式中:
Y——抗菌肽得率,%;
c——上清液中总蛋白浓度,mg/L;
v——上清液体积,mL;
m——紫贻贝肉质量,g。
1.3.4 抑菌试验 采用琼脂打孔法检测紫贻贝加工下脚料抗菌肽的抗菌活性。用0.02 mol/L pH为4.0的乙酸—乙酸钠缓冲液将冻干抗菌肽配制成10 mg/mL多肽溶液。活化的敏感菌接种于100 mL TSB培养基中,37 ℃ 振荡培养7~8 h(OD600 nm=0.6~0.8),取100 μL菌液加入45 ℃已灭菌TSA培养基中,混匀,倒平板。待凝固后用灭菌打孔器(Ø10 mm)打孔,每孔分别加入100 μL 抗菌肽溶液,4 ℃放置60 min,37 ℃培养16~18 h后,采用十字交叉法用游标卡尺测量抑菌圈直径。以0.02 mol/L pH为4.0的无菌乙酸—乙酸钠缓冲液为阴性对照,用抑菌圈直径(mm)表示抑菌活性。
1.4 数据处理
试验结果以平均值±SD表示,利用SPSS 19.0软件进行One-Way ANOVA分析,采用Duncan法检验多组数据间的差异显著性(P<0.05),利用OriginPro 9.1软件进行绘图,字母不同表示差异显著(P<0.05)。
2 结果与分析
2.1 单因素试验
预试验结果显示,紫贻贝加工下脚料抗菌肽对金黄色葡萄球菌和大肠杆菌均有抑菌效果,且对金黄色葡萄球菌的抑菌效果最好,而对枯草芽胞杆菌却无抑菌效果(抑菌圈直径<2 mm)。因此,后续试验中选择金黄色葡萄球菌为敏感菌。
2.1.1 乙酸质量分数 由图1可知,当乙酸质量分数为0.2%~0.8%时,抗菌肽得率随乙酸质量分数的增大显著提高(P<0.05),提高了61.36%;进一步增大乙酸质量分数,抗菌肽得率却无显著提高(P>0.05)。同时,随着乙酸质量分数的增大,抗菌肽的抑菌活性先升高后降低,但均无显著变化(P>0.05),其中,乙酸质量分数为0.8%时所获得的抗菌肽的抑菌活性最高,即抑菌圈直径为7.54 mm。这可能是贻贝抗菌肽多为带2~7个正电荷的碱性蛋白[20],且酸性条件下其溶解度高[21]。由于高浓度乙酸溶液具有较高渗透压,使细胞中非抗菌肽的蛋白等物质溶出,与抗菌肽得率的结果一致。综合考虑,选取质量分数为0.8%左右的乙酸溶液为宜。
2.1.2 液料比 由图2可知,当液料比(V乙酸∶m紫贻贝)为2∶1~6∶1 (mL/g) 时,抗菌肽得率随液料比的提高显著增加(P<0.05),增加了83.33%;进一步提高液料比,抗菌肽得率却无显著变化。同时,抗菌肽的抑菌活性随液料比的提高先升高后降低,但均无显著变化(P>0.05)。高液料比可降低体系黏度,加快传质过程,促进胞内抗菌肽的释放,因而提高得率[18]。当大部分目标肽已释放时,进一步提高液料比,得率缓慢增长。因此液料比(V乙酸∶m紫贻贝)选择6∶1 (mL/g)左右较合理。
2.1.3 超声提取时间 由图3可知,当超声提取时间为5~15 min时,抗菌肽得率随超声提取时间的延长显著增加(P<0.05),提高了70.59%,而抗菌肽的抑菌活性却无显著变化(P>0.05);当超声提取时间>15 min时,抗菌肽得率随超声提取时间的延长逐渐下降,但无显著变化,而抗菌肽的抑菌活性却显著降低(P<0.05)。超声波产生的空化效应破坏细胞组织,从而促使胞内抗菌肽释放并扩散至胞外溶剂中[16],破碎细胞内大部分抗菌肽在最初的15 min左右释放并扩散至提取溶剂中,因此抗菌肽得率显著增加。而超声时间过长会引起局部过热,导致部分蛋白结构与贻贝抗菌肽二级结构被破坏[22],使得抗菌肽得率和抑菌活性随之下降。因此,初步确定较适宜的超声提取时间为15 min左右。

图1 乙酸质量分数对抗菌肽得率与抑菌活性的影响
2.2 响应面优化
2.2.1 回归方程的建立 利用Design-Expert 10.0.7软件进行响应面Box-Benhnken中心组合试验设计,试验因素与水平见表1,试验方案及结果见表2。通过Design-Expert软件对试验结果进行最小二乘法拟合回归,得二次多元回归方程为:
Y=1.518+0.011 25A+0.036 25B+0.112 5C+0.025AB+0.022 5AC-0.002 5BC-0.111 5A2-0.116 5B2-0.099C2。
(2)

图2 液料比对抗菌肽得率与抑菌活性的影响
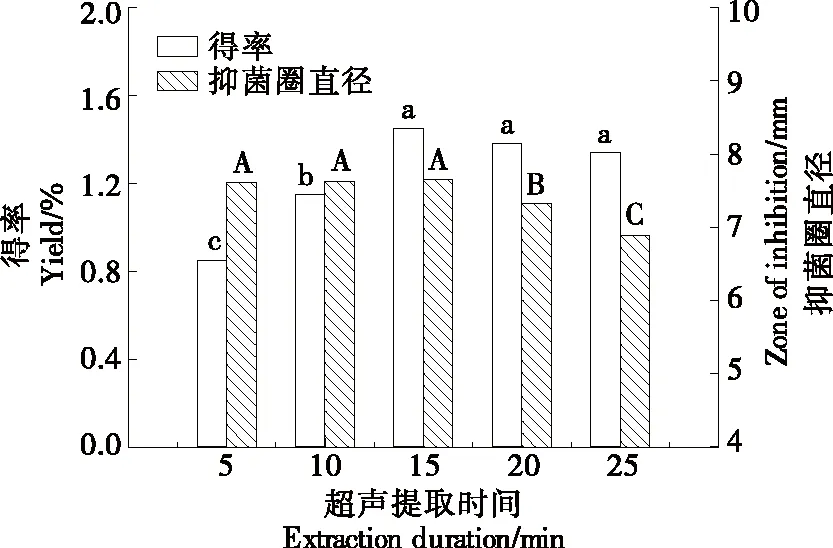
图3 超声提取时间对抗菌肽得率与抑菌活性的影响
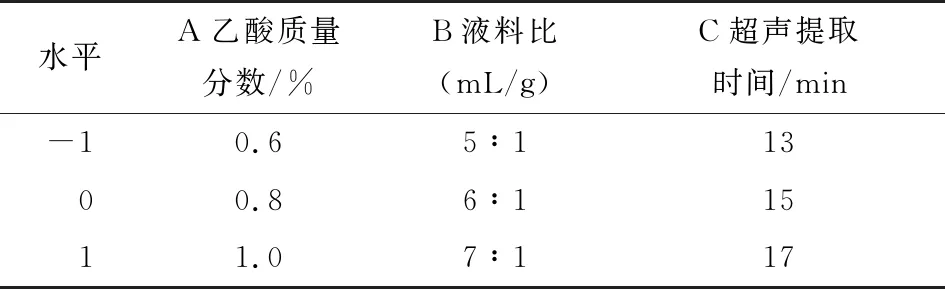
表1 响应面试验因素与水平表

表2 响应面试验方案及结果
2.2.3 因素间交互作用 由图4~6可知,乙酸质量分数与液料比和乙酸质量分数与超声提取时间对抗菌肽得率的影响显著,其响应曲面坡度陡峭,等高线宽度大;液料比与超声提取时间的交互作用对抗菌肽得率的影响不显著(P>0.05),其响应曲面弯曲不明显,等高线宽度较小[25-26],与方差分析结果一致。
2.2.4 工艺确定及验证实验 由响应面法获得抗菌肽的最佳提取工艺为乙酸质量分数0.825%、液料比(V乙酸∶m紫贻贝)6.163∶1 (mL/g)、超声提取时间16.138 min,预测抗菌肽得率为1.553%。为便于实际操作,将抗菌肽提取工艺修正为乙酸质量分数0.8%、液料比(V乙酸∶m紫贻贝)6∶1 (mL/g)、超声提取时间16 min,此条件下的抗菌肽得率为(1.549±0.036)%(n=3),与预测值相对误差<0.3%,说明利用响应面法优化获得的抗菌肽提取工艺具有一定的可靠性。此外,传统乙酸法提取抗菌肽得率为(0.982±0.041)%,表明超声辅助提取可使抗菌肽得率提高57.74%(P<0.05)。
2.3 抑菌性质
由图7可知,超声辅助乙酸法提取的抗菌肽的抑菌圈直径为(7.52±0.08) mm,而传统乙酸法提取的抗菌肽的抑菌圈直径为(6.48±0.05) mm,表明超声辅助提取可显著提高抗菌肽的抑菌活性(P<0.05)[27]。进一步表明超声辅助乙酸提取紫贻贝下脚料抗菌肽的工艺是可行的。
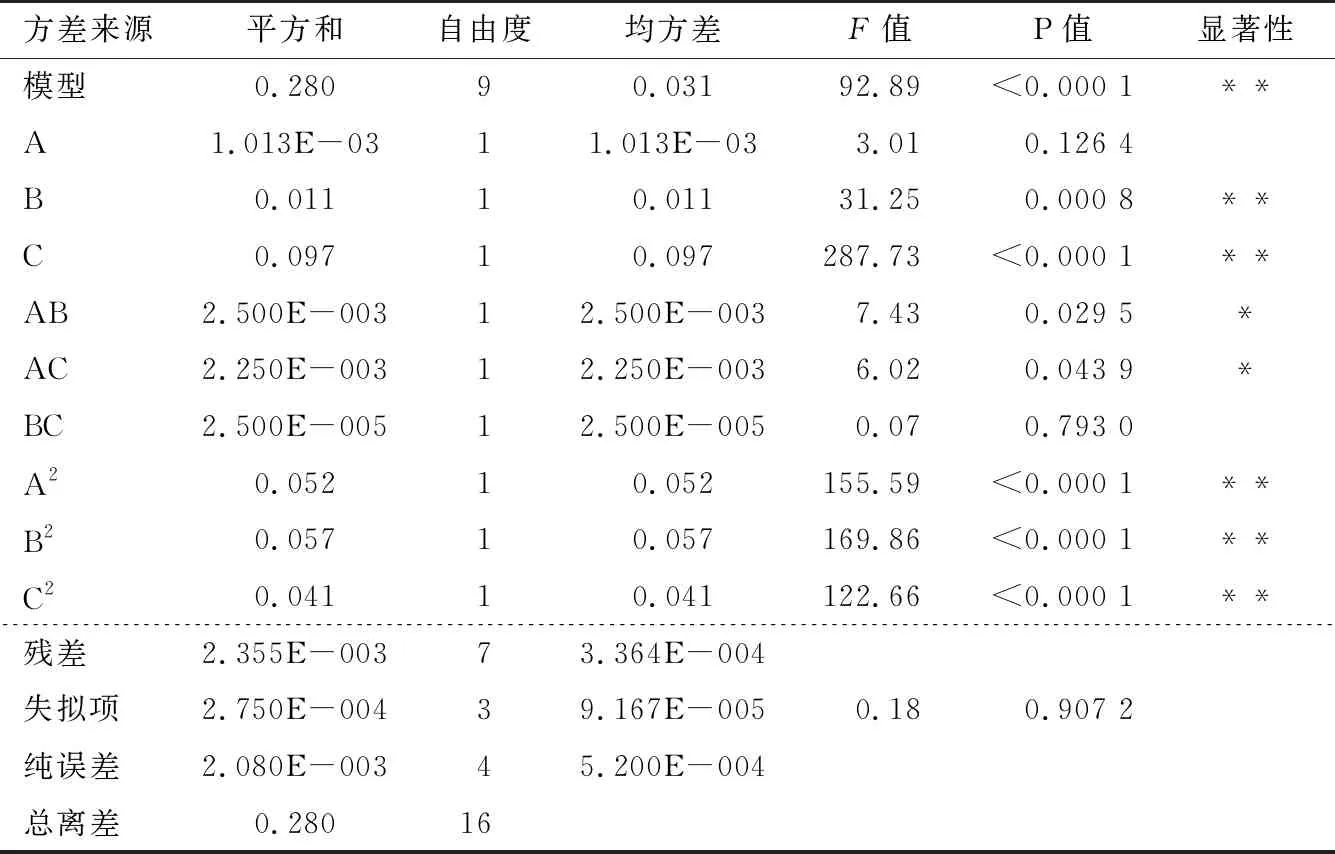
表3 回归模型方差分析†
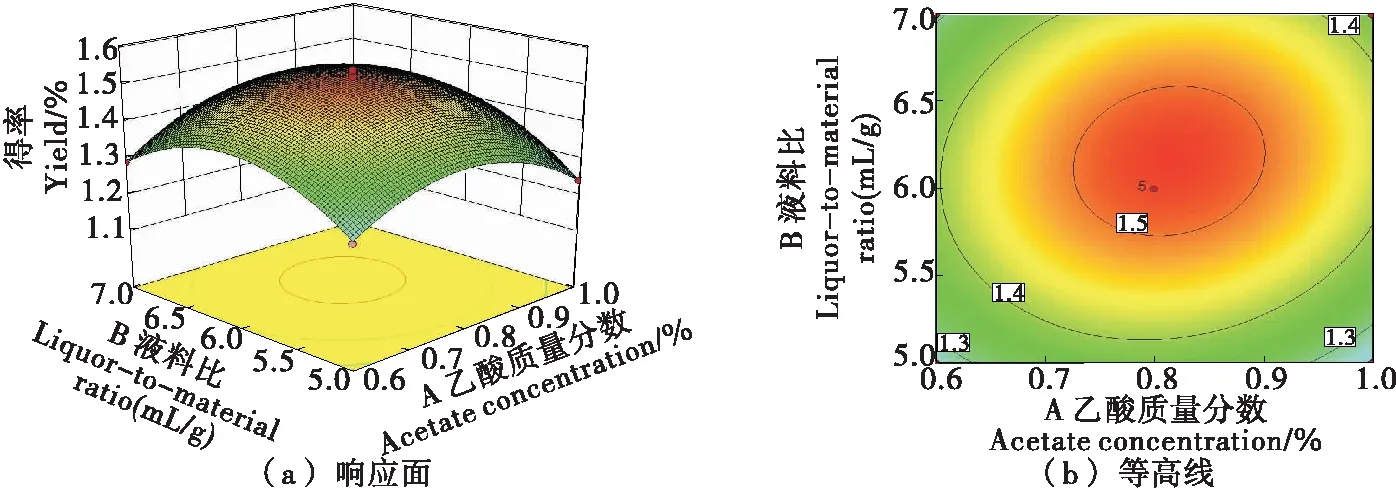
图4 乙酸质量分数与液料比的交互作用
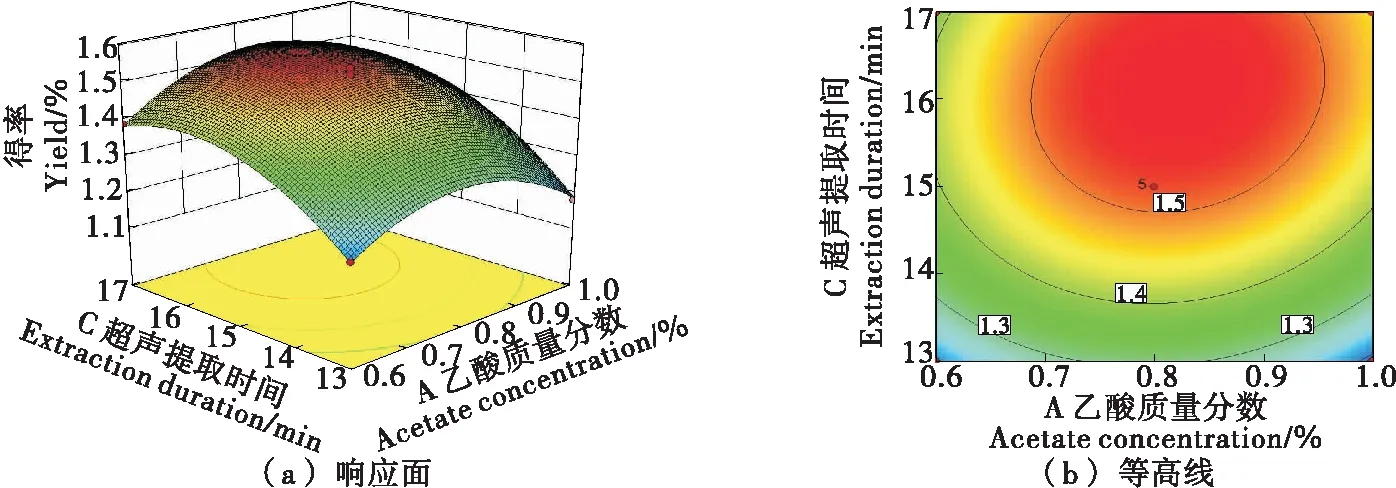
图5 乙酸质量分数与超声提取时间的交互作用
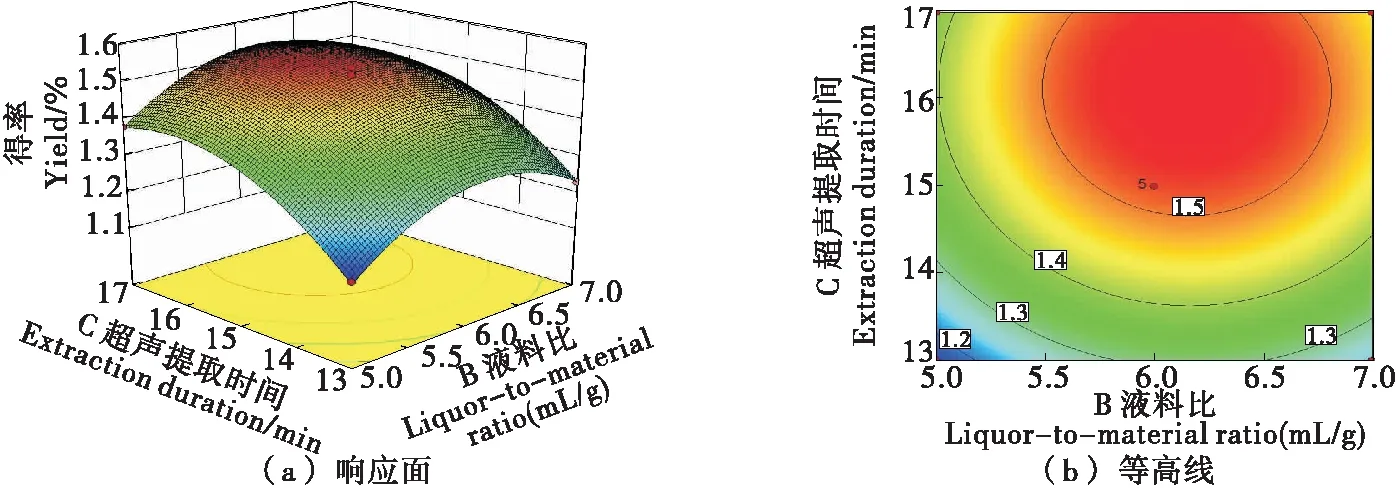
图6 液料比和超声提取时间的交互作用
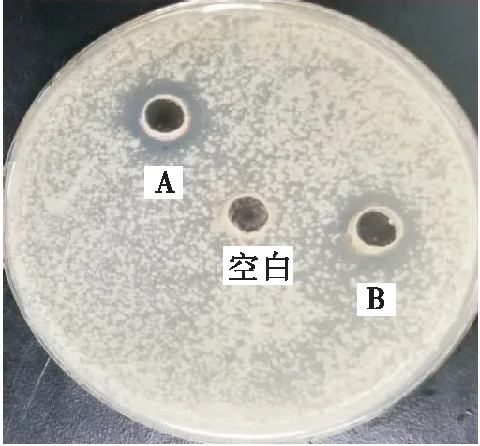
A. 超声辅助乙酸法 B. 传统乙酸法
3 结论
采用超声辅助提取的方法,以乙酸溶液为提取液,通过响应面试验优化获得紫贻贝加工下脚料抗菌肽的最适提取工艺条件为超声功率200 W、乙酸质量分数0.8%、液料比(V乙酸∶m紫贻贝)6∶1 (mL/g)、超声提取时间16 min,该条件下抗菌肽得率和抑菌圈直径分别为1.55% 和7.52 mm,均显著高于传统乙酸法(P<0.05),表明该超声辅助乙酸提取紫贻贝下脚料抗菌肽的工艺是可行的。后续将考察原料贮藏条件(温度、时间)、提取剂类型和超声波功率,以提高抗菌肽得率,同时对抗菌肽稳定性(热、酸碱、冻融次数、蛋白酶)进行考察。

