替莫唑胺酯纳米粒的制备及抗脑胶质瘤活性研究
韩俊萍,王良霄,沙春洁,王爱萍,楚留香,孙考祥
(1. 烟台大学药学院,烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心,分子药理和药物评价教育部重点实验室(烟台大学),山东 烟台264005;2. 山东绿叶制药有限公司长效和靶向制剂国家重点实验室,山东 烟台264003)
脑胶质瘤(glioblastoma, GBM)是一种常见的并有强侵袭性的脑肿瘤,具有复发率高、死亡率高等特点[1-2].替莫唑胺(temozolomide, TMZ)是一种DNA烷化剂类抗肿瘤药物,酸性条件下稳定,在生理环境下,可不经酶代谢自发水解产生甲基重氮阳离子,该离子可诱导肿瘤细胞凋亡发挥抗肿瘤作用[3].TMZ是治疗GBM的一线用药[4],然而,剂量限制性外周毒副作用限制了其应用[5].SVEC R L等[3]研究证明TMZ-C8酰胺基团不是药物发挥抗肿瘤活性所必需的,已有研究在TMZ-C8位进行酯化改造[6-9],所得衍生物脂溶性增加,透膜性提高且对多种GBM细胞的抗肿瘤活性增强,可实现低浓度抗肿瘤的治疗效果.替莫唑胺辛酯(temozolomide octyl ester, TOE)为TMZ-C8位酯化改造得到的衍生物,脂溶性改善,与TMZ相似,TOE在中性与碱性条件下易开环水解释放甲基重氮阳离子发挥抗肿瘤作用.聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)纳米粒作为抗肿瘤药物的载体[10-12],具有生物相容性好,可提高药物稳定性,易于靶向修饰等优点[13-15].
基于此,本研究拟合成替莫唑胺辛酯,为制备高效治疗脑胶质瘤的制剂,将其包载于PLGA纳米粒中,研究采用乳化-溶剂挥发法制备替莫唑胺辛酯纳米粒(temozolomide octyl ester nanoparticles, TOE-NPs),通过Box-Behnken响应面法优化处方,以制备出药物包载率高、粒径合适的纳米粒,并探究其体外抗胶质瘤活性,为后续替莫唑胺酯纳米粒经鼻递送用于GBM的治疗研究奠定基础.
1 实验部分
1.1 仪器
Avane Ⅱ 600 MHz核磁共振仪(瑞士布鲁克公司);API 3000 LC-MS/MS型质谱仪(McKinley Scientific公司);超声波细胞粉碎机(宁波新芝生物科技有限公司);Agilent高效液相色谱仪(安捷伦科技有限公司);DelsaNano C Zeta电位及纳米粒度分析仪(Beckman Coulter公司);ZD-88B恒温摇床(江苏省太仓市博莱特实验仪器厂);Biofuge Primo-R离心机(赛默飞世尔科技公司);BioTek Synergy4酶标仪(美国伯腾仪器有限公司).
1.2 试药与试剂
TMZ(湖北兴银河化工有限公司);PLGA((LA∶GA=50∶50,Mw=18 000 U),山东绿叶制药有限公司);正辛醇(阿拉丁试剂);MTT(Sigma公司);胎牛血清(上海玉博生物科技有限公司);乙腈、甲醇为色谱纯,其余所有试剂均为分析纯.
1.3 细胞
大鼠胶质瘤C6细胞(中国科学院上海细胞库).
1.4 TOE的化学合成
本研究参考文献[15]合成方法,将TMZ水解为替莫唑胺酸(temozolomide acid, TMA),再与正辛醇酯化生成TOE,合成路线见图1.

图1 替莫唑胺辛酯的合成路线
将TMZ(10.00 g,51.50 mmol)溶于浓硫酸中,冰水浴条件下,滴加亚硝酸钠饱和水溶液(0.25 g/mL, 28.50 mL),室温搅拌过夜,反应混合物中加入适量碎冰,冰浴冷却,过滤,真空干燥即得TMA.将TMA(3.90 g, 20.00 mmol)溶于二氯亚砜中加DMF(0.073 g, 1.00 mmol),体系升温至回流状态,搅拌反应2 h,减压蒸除二氯亚砜.适量二氯甲烷溶解产物,冰水浴条件下,加入正辛醇(2.60 g, 20.00 mmol),三乙胺(1.01 g, 10.00 mmol),升至室温搅拌反应2 h.加入饱和碳酸氢钠溶液,分液,无水硫酸钠干燥有机相,减压浓缩,柱层析纯化(石油醚∶乙酸乙酯=3∶1),得TOE(15.61 g,白色固体粉末),通过1H-NMR、13C-NMR、MS对目标化合物的结构进行表征,显微熔点仪测定熔程,HPLC测定药物纯度和含量.
1.5 HPLC色谱条件
色谱柱:Phenomenex C18柱(250 mm×4.6 mm, 5 μm),流动相:乙腈-0.1%乙酸水(40∶60,V/V),流速:1 mL/min,检测波长:327 nm,柱温:40 ℃,进样量:20 μL.该色谱条件下TMZ和TOE的保留时间分别为2.2 min和10.8 min.
1.6 纳米粒的制备
采用乳化-溶剂挥发法制备TMZ-NPs和TOE-NPs.制备工艺如下:称取处方量的药物(TMZ或TOE)和PLGA溶于二氯甲烷和丙酮的混合溶剂(二氯甲烷∶丙酮=3∶2,V/V)中,超声溶解,形成油相;另取处方量的1%和0.3%(W/V)的聚乙烯醇溶液分别作为内水相和外水相,在冰水浴条件下,将油相逐滴滴入内水相中,超声功率为300 W,超声3 min,形成初乳;搅拌条件下将初乳逐滴分散于外水相中,挥干有机溶剂,0.45 μm微孔滤膜滤过,即得TMZ-NPs和TOE-NPs.
1.7 载药纳米粒的表征
1.7.1 粒径分布和Zeta电位的测定 取制备的载药纳米粒溶液,适量蒸馏水均匀分散,采用DelsaNano C Zeta电位及纳米粒度分析仪测定纳米粒的粒径分布、多分散指数(polydispersity index, PDI)和Zeta电位.
1.7.2 透射电子显微镜观察形态 采用磷钨酸复染法制备TMZ-NPs和TOE-NPs透射电镜样品,室温下将纳米粒分散液滴于铜网上,均匀平铺成薄膜,2%磷钨酸溶液复染10 min,滤纸吸尽多余液体,透射电子显微镜观察纳米粒形态.
1.7.3 包封率和载药量的测定 采用超速离心法测定纳米粒的包封率与载药量.精密量取1.0 mL TMZ-NPs或TOE-NPs于超速离心管(Mw=100 kU)4 000 r/min离心30 min,收集下层滤液,乙腈稀释,0.22 μm微孔滤膜滤过,按“1.5”项下HPLC条件测定并计算游离TMZ或TOE质量(m游);另取1.0 mL TMZ-NPs或TOE-NPs加适量乙腈超声破乳,涡旋萃取,12 000 r/min离心10 min,按“1.5”项下HPLC条件测定TMZ或TOE总质量(m总).纳米粒的包封率和载药量计算公式为
包封率=(m总-m游)/m总×100%,
(1)

(2)
1.7.4 体外释放 采用透析法考察纳米粒的体外释药特性.分别量取适量TOE溶液(temozolomide octyl ester solution, TOE-Sol)、TMZ-NPs、TOE-NPs装入预先处理好的透析袋(Mw=3 500)中,平行3份,透析袋置于40 mL释放介质(含1%聚山梨酯80的磷酸盐缓冲液(W/V),pH=5.5)中,37±1 ℃、100 r/min条件下振荡释放.分别于0.083、0.25、1、2、4、8、12、24、48、72、96、120 h时间点取出 1.0 mL释放介质,同时补加同温同体积的释放介质,样品经0.22 μm微孔滤膜滤过,续滤液按“1.5”项下HPLC条件测量药物含量,以时间为横坐标,TMZ或TOE累积释放率为纵坐标绘制释放曲线.
1.8 Box-Behnken响应面法优化纳米粒处方
采用乳化-溶剂挥发法制备载药纳米粒,通过预实验的考察结果,选择影响纳米粒包封率(Y1)、粒径(Y2)比较显著的3个因素:油水比(A)、PLGA质量浓度(B)、理论载药量(C)为自变量,根据预实验结果选择各因素的3个水平,以包封率(Y1)、粒径(Y2)为评价指标进行实验,采用Box-Behnken响应面法对纳米粒的处方进行优化,考察的因素和水平如表1所示.
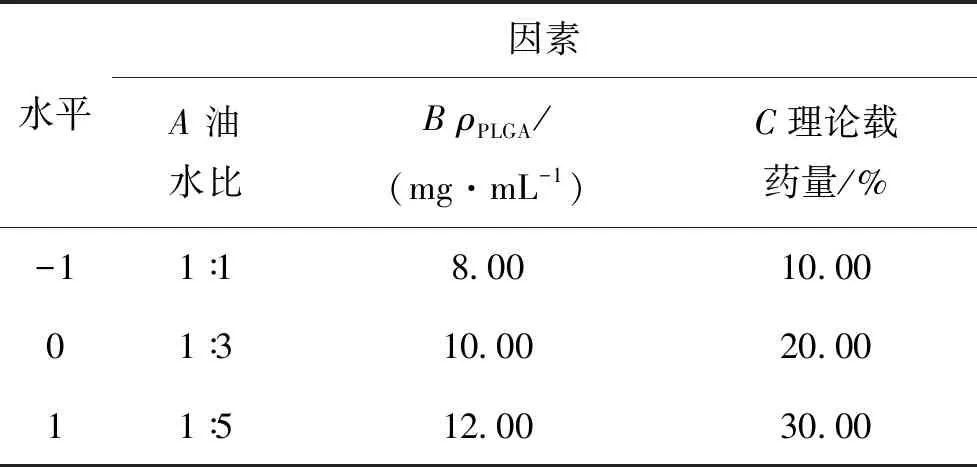
表1 响应面因素水平编码
1.9 体外抗脑胶质瘤活性
以大鼠胶质瘤C6细胞为模型细胞,采用MTT法考察TMZ、TOE、TMZ-NPs和TOE-NPs 4组不同药物的细胞生长抑制作用.将对数生长期的C6细胞以5×103个/mL的密度接种于96孔培养板中,于37 ℃、5% CO2细胞培养箱中培养24 h后,分别加入4组含有梯度浓度的药物培养液,药物浓度设置为:5、40、80、160、240 μmol/L,各组药物每个浓度设置6个复孔,同时建立空白组(只加培养液,不含细胞,不加药物)和对照组(只加培养液,不加药物),培养48 h后,每孔加入20 μL MTT(5 mg/mL)继续培养4 h,弃去孔内液体后,每孔加入150 μL DMSO,微型振荡器振荡混匀,酶标仪检测490 nm处吸光度(absorbance,A),根据A值及公式(3)计算细胞存活率.MTT实验进行3次,并考察相应浓度的空白载体对C6细胞生长抑制的影响.

(3)
1.10 统计学方法
2 实验结果与讨论
2.1 替莫唑胺辛酯的合成与表征
合成的替莫唑胺辛酯外观为白色固体粉末,产率为78.2%,mp: 89.1~90.3 ℃,1H NMR结果见图2,1H NMR(600 MHz, CDCl3)δ: 8.44(s, 1H), 4.47~4.43(t, 2H), 4.03(s, 3H), 1.86~1.77(m, 2H), 1.48~1.40(m, 2H), 1.33~1.23(m, 8H), 0.86~0.83(t, 3H);13C NMR结果见图3,13C NMR(150 MHz, CDCl3)δ: 160.6, 138.7, 135.8, 129.6, 128.6, 66.2, 36.7, 29.8, 29.2, 28.7, 25.9, 22.7, 14.2;MS结果见图4,MS-ESI(m/z): 307.8 [M+1].
2.2 纳米粒处方优化设计及结果
纳米粒处方的Box-Behnken响应面设计及结果如表2所示,采用Design-Expert 8.0.6软件对实验结果进行拟合分析,选择有较大相关系数(R2)的拟合方程,P<0.05作为具有统计学意义标准进行优化.A为油水比;B为PLGA质量浓度(mg/mL);C为理论载药量(%),均是编码值,响应值包封率(Y1)、粒径(Y2)对A、B、C3因素的数学回归模型如下:Y1=90.26+1.39A-1.09B-3.61C+1.24AB-0.023AC+9.90BC-7.36A2-3.48B2-23.22C2(R2=0.964 5);Y2=141.78-18.34A+12.83B-2.56C+0.76AB+9.22AC+0.65BC+51.60A2+8.47B2-7.84C2(R2=0.981 5).

图2 替莫唑胺辛酯核磁共振氢谱

图3 替莫唑胺辛酯核磁共振碳谱
对模型进行方差分析如表3、表4所示,结果显示,对替莫唑胺辛酯Y1与Y2建立的上述回归模型P<0.05,所建模型具有统计学意义;模型失拟项不具有统计学意义(P>0.05),表明模型与实际情况吻合好,能较好地描述响应值与各因素之间的关系.Y1、Y2模型相关系数R2分别为0.964 5和0.981 5,R2>0.900 0,模型相关性良好.
根据上述二项式拟合方程绘制各因素对指标影响趋势的三维响应面,见图5、图6,响应面的最高点为响应值的极值.通过三维响应面图评价各因素与响应值之间的关系,保持第3个变量为常数,分析2个独自的因素对响应值的响应情况.
对包封率的影响:各因素对包封率影响的响应面结果见图5.由图5可以看出理论载药量(C)对包封率影响显著(P<0.05).该因素的轴向响应面最陡峭,随着理论载药量的增加,包封率呈现出逐渐增大后下降的趋势.各因素对包封率的影响大小依次为:理论载药量(C)>油水比(A)>PLGA质量浓度(B).
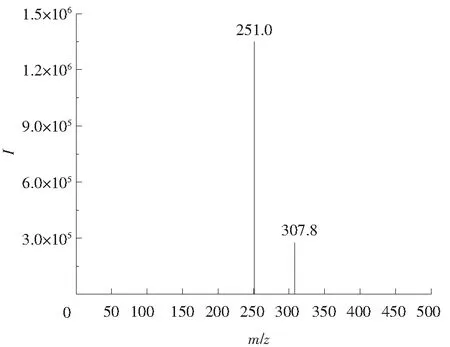
图4 替莫唑胺辛酯质谱图

表2 响应面试验设计及结果
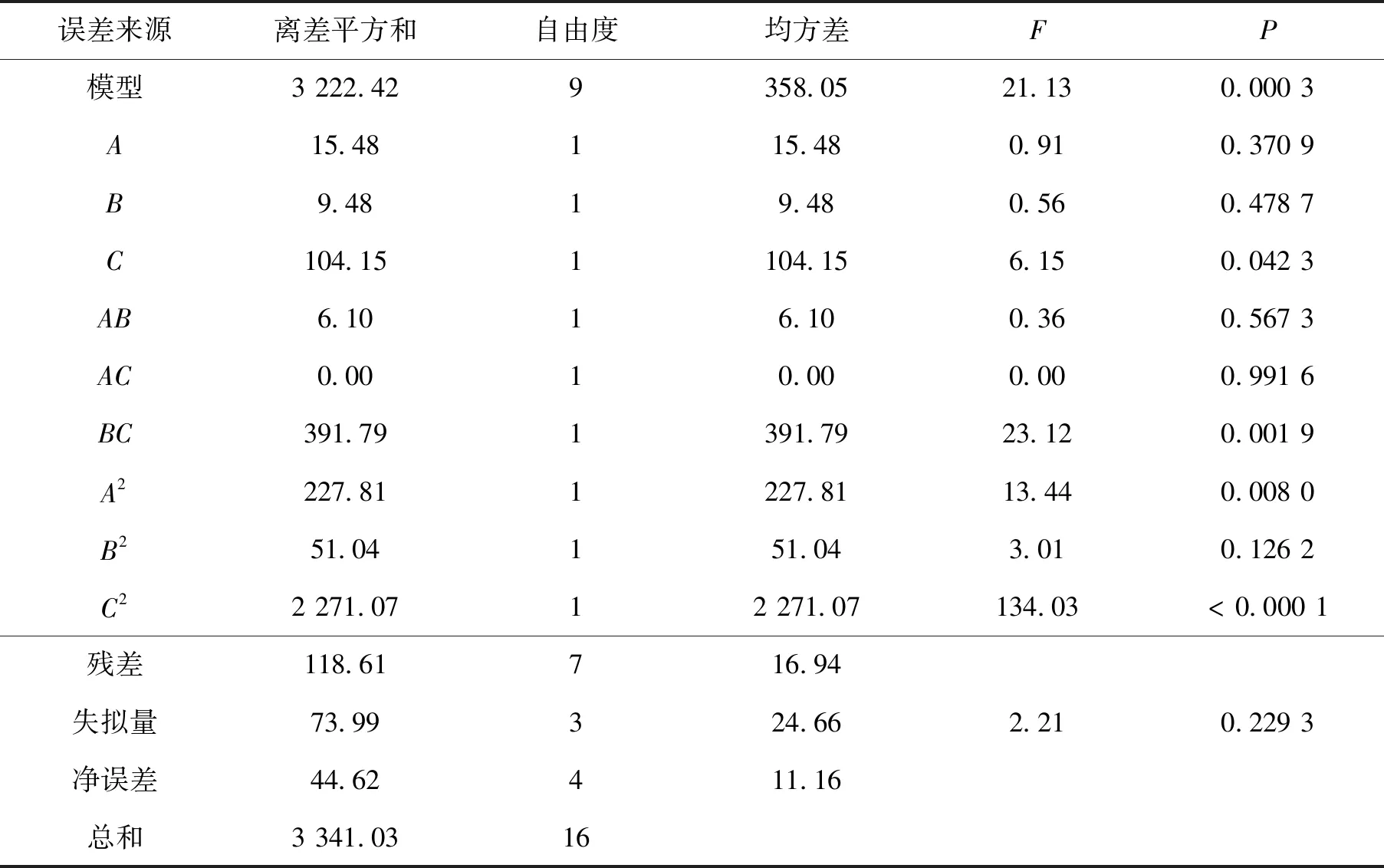
表3 包封率方差分析表
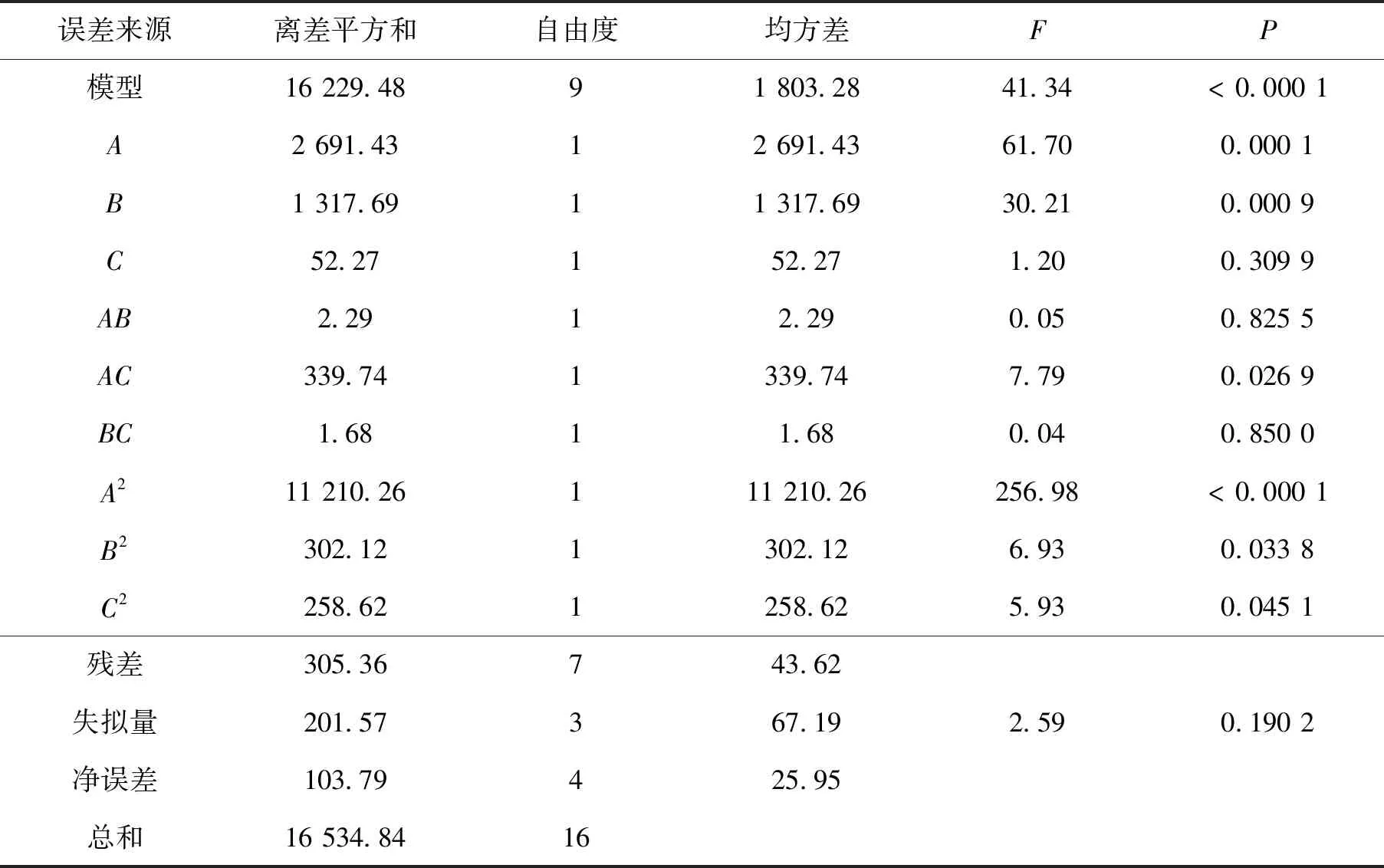
表4 粒径方差分析表

图5 各因素对TOE-NPs包封率影响的响应面图
对粒径的影响:各因素对粒径影响的响应面结果见图6,由图可以看出油水比(A)、PLGA质量浓度(B)对粒径的影响显著(P<0.05),随着油水比的增大,粒径呈现出逐渐减小后增加的趋势;随着PLGA质量浓度的增大,粒径逐渐增大.各因素对粒径的影响大小依次为:油水比(A)>PLGA质量浓度(B)>理论载药量(C).
载药纳米粒最优处方应具备纳米粒包封率“最大”,平均粒径分布“最小”,通过回归模型预测的最佳处方组成为:油水比为1∶3.3,PLGA质量浓度为8.80 mg/mL,理论载药量为17.77%.包封率预测值为90.55%,平均粒径为135.4 nm,按最优处方组成,制备3批载药纳米粒,经测定包封率为(93.29±1.93) %,平均粒径为136.2±1.8 nm,预测值和实测值的包封率和粒径分布偏差分别为-0.61%和-3.03%偏差,结果表明两者的实验值与预测值吻合程度高.
偏差=(预测值-实测值)/预测值×100%. (4)

图6 各因素对TOE-NPs粒径影响的响应面图
2.3 载药纳米粒的表征
按最佳处方组成制备的TMZ-NPs和TOE-NPs外观为带有淡蓝色乳光的溶液,见图7(a);TMZ-NPs和TOE-NPs透射电镜结果分别见图7(b)和图7(c),从电镜结果可以看出,所制备的纳米粒形态近似于球形,没有黏连团聚,结构紧密.TMZ-NPs和TOE-NPs的粒径分布、PDI、Zeta电位、包封率和载药量结果如表5所示,纳米粒粒径呈正态分布,平均粒径在130~140 nm之间,PDI<0.1,粒径分布均匀,Zeta电位值在-24~-20 mV之间,体系稳定性良好.TMZ-NPs载药量仅为0.62%,将TMZ酯化修饰为TOE后,纳米粒对药物的包载率显著提高,TOE-NPs载药量(以TMZ计)达8.13%,包封率为93.29%,分别为TMZ-NPs的13.11倍和16.66倍.这可能是由于TMZ水溶性、脂溶性均较差,将TMZ酯化修饰为TOE后,药物脂溶性增强,改善了与PLGA的生物相容性,因此提高药物的包载量.由实验结果可得出TOE-NPs可以明显改善TMZ纳米粒载药量低的问题,为临床有效治疗GBM提供了可行性.

图7 TMZ-NPs与TOE-NPs外观及透射电镜照片

表5 TMZ-NPs与TOE-NPs的体外表征
由于TMZ及TOE在体内pH=7.4生理环境下自发水解产生甲基重氮阳离子发挥其抗肿瘤作用,为准确测定药物的释放行为,选择pH=5.5释放条件测定各组药物的释放,TOE-Sol、TMZ-NPs、TOE-NPs体外累积释放结果见图8.由释放曲线可知,TOE-Sol释放迅速,8 h累计释放率为(99.10±3.86) %,而将TOE制备成纳米粒后,药物包载于纳米粒,可实现药物的缓慢释放,缓释效果优于TMZ-NPs,120 h时药物累计释放率为(88.13±2.39) %.

图8 TMZ-NPs、TOE-NPs、TOE-Sol体外累积释放曲线
2.4 抗脑胶质瘤研究
不同浓度的游离药物和载药纳米粒与C6细胞共孵育48 h后,细胞存活率结果见图9.由图9可以看出,空白纳米粒处理细胞48 h后,各组细胞存活率均大于90%,表明制备纳米粒的载体材料具有较好的生物相容性和安全性.TMZ和TOE对C6细胞的生长抑制作用均呈剂量依赖性,TOE溶液对C6细胞的生长抑制作用强于TMZ溶液(IC50, 34.89 μmol/L vs 231.29 μmol/L,P<0.01), 将二者制备成纳米粒后,仍是如上的细胞生长抑制趋势,在药物浓度高于40 μmol/L时,TOE-NPs对C6细胞的生长抑制作用与TMZ-NPs相比具有统计学意义(P<0.01).TMZ-NPs和TOE-NPs的IC50值分别为169.12 μmol/L和28.16 μmol/L,TOE-NPs较 TMZ-NPs有更佳的体外抗肿瘤效果.

与TMZ-Sol相比,*P<0.05,**P<0.01;
3 结 论
本研究合成了TOE模型药物,体外C6细胞生长抑制作用比TMZ更高.采用Box-Behnken响应面法筛选出制备纳米粒的最佳处方.按最佳处方制备的TOE-NPs的包封率、载药量分别为TMZ-NPs的16.66和13.11倍,具有较高的包封率与载药量,粒径分布均匀且小于200 nm,制剂适合经鼻给药方式,TOE-NPs体外释放平稳,相同浓度给药剂量下对胶质瘤C6细胞的生长抑制作用显著强于TMZ-NPs,具有较高的胶质瘤治疗潜力,有望成为经鼻递送治疗脑胶质瘤的良好候选药物制剂.

