PTAR联合Child-Pugh及MELD评分对肝硬化患者发生慢加急性肝衰竭预测价值研究
康 宁, 齐丽翠, 袁 岳, 刘 丽, 白 云, 郑吉敏, 崔子瑾, 张 建, 王存凯, 王玉珍
1.河北医科大学研究生院, 河北 石家庄 050000; 2.河北北方学院研究生院; 3.河北省人民医院消化内科
肝硬化是一种由肝炎病毒感染、酒精等因素长期作用于肝脏引起的慢性、进行性、弥漫性肝病的终末阶段[1]。随着疾病逐步进展,晚期可出现门静脉高压、肝功能减退相关的一系列临床表现,甚至出现肝衰竭。慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是在慢性肝病基础上,由各种诱因引起的以急性黄疸加深、凝血功能障碍为表现的综合征[2]。HBV感染与酒精性肝病占ACLF病因的90%[3],ACLF死亡率为50%~70%[4-5]。ACLF以其发病快、预后差、死亡率高,而备受临床医师重视。目前对于ACLF的治疗效果仅肝移植较确切,但由于肝源紧缺及手术费用昂贵等因素并不能被广泛运用,因此,建立ACLF的预测系统具有非常重要的临床意义[6]。
目前对于ACLF的预测研究尚少,且大多使用单一指标,如淋巴细胞比值(NLR)、CXC型趋化因子配体10(CXCL10)等。上述研究难以对ACLF进行全面、系统、准确的预测。本实验旨在探讨Child-Pugh、终末期肝病模型(MELD)、MELD-Na、年龄-胆红素-INR-肌酐(ABIC)、白蛋白-胆红素(ALBI)及PTAR评分系统对肝硬化患者发生ACLF的预测能力。并且,由于单一评分系统存在一定的局限性,本文将通过综合各评分系统,建立一种更准确的预测模型。本研究还将肝硬化患者分为乙肝肝硬化和酒精性肝硬化两组进行研究,以期找到分别适用于两种病因的预测模型,提高预测的针对性。筛选出肝硬化中进展为ACLF的高危患者,指导临床医师早期干预,积极采取治疗方案,延缓甚至避免ACLF的发生。
1 资料与方法
1.1 研究对象收集河北省人民医院消化内科2016年9月至2019年9月收治的肝硬化患者。乙肝肝硬化及酒精性肝硬化诊断依据《慢性乙型肝炎防治指南2010版》及《酒精性肝病诊断标准》[7-8]。纳入标准:(1)符合肝硬化诊断标准;(2)均为单一因素所致肝硬化;(3)均进行规范化治疗。排除标准:(1)合并患有循环、呼吸、造血、免疫、代谢等系统疾病者;(2)丙型肝炎病毒、非酒精性脂肪性肝病、药物、自身免疫及遗传、代谢等因素引起的肝硬化患者;(3)排除发生原发性或继发性肝癌的患者;(4)住院前已出现过ACLF或慢性肝衰竭等表现的患者;(5)排除经肝移植等手术、激素、免疫抑制剂等治疗的患者。(6)未能根据医嘱进行密切随访者。共纳入患者261例,男192例,女69例,年龄(59.51±13.34)岁,其中乙肝肝硬化148例,酒精性肝硬化113例。代偿期肝硬化96例,失代偿期肝硬化165例。ACLF的诊断标准依据《肝衰竭诊治指南(2018年版)》[9]。通过随访(随访6个月),随访时间为(2.61±1.77)个月,以患者出现ACLF或死亡作为随访终点。共发生ACLF 24例,发病率为9.2%,其中乙肝肝硬化13例,酒精性肝硬化11例。共死亡31例,其中11例死于ACLF,ACLF的死亡率为45.8%(11/24)。首先依据病因分为乙肝肝硬化组和酒精性肝硬化组。依据随访结果,从肝硬化进展为ACLF者分为ACLF组,未进展为ACLF者分为非ACLF组。综上,以乙肝肝硬化为病因的分为非ACLF组、ACLF组,以酒精性肝硬化为病因的分为非ACLF组、ACLF组。本研究经由河北省人民医院伦理委员会审批(批号:201927)。
1.2 临床资料收集患者第1次入院时生化、凝血功能等指标,依据上述指标计算:(1)PTAR=INR/血清白蛋白(g/dl)[10];(2)ALBI=-0.085×ALB(g/L)+0.66×lgTBil(μmol/L)[11];(3)ABIC=0.1×年龄+0.08×胆红素(mg/dl)+0.3×肌酐(mg/dl)+0.8×INR[12];(4)Child-Pugh涉及ALB、TBil、INR、腹水及肝性脑病[13];(5)MELD=11.2×InINR+3.8×In胆红素(mmol/L)+9.6×In肌酐(mmol/L)+6.4×病因(胆汁性及酒精性为0,其余为1)[14];(6)MELD-Na=MELD-Na+-[0.025×MELD×(140-Na+)]+140[15]。
1.3 统计学方法采用SPSS 21.0统计软件及MedCalc18.2.1.0进行分析。正态分布的计量资料以均数±标准差表示,组间比较采用t检验分析,偏态分布的计量资料以中位数(四分位数间距)表示,组间比较采用Mann WhitneyU检验分析,计数资料以例数/%表示,组间比较采用χ2检验分析。单因素和多因素分析使用Logistic回归分析;P<0.05为差异有统计学意义。采用受试者工作特征曲线(receiver operating characteristic curve,ROC)及曲线下面积(area under the curve,AUC)比较各评分模型对是否发生ACLF的预测价值的准确性。AUC>0.7时,提示有临床应用价值,AUC为0.8~0.9则被认为预测准确性较高。
2 结果
2.1 一般资料比较
2.1.1 乙肝肝硬化组:ACLF组ALB、血清Na+低于非ACLF组,而TBil、血肌酐、尿素氮、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、国际标准化比值(INR)、发生腹水比例均高于非ACLF组,差异有统计学意义(P<0.05)。评分模型:ACLF组Child-Pugh、ALBI、PTAR、MELD、MELD-Na评分均高于非ACLF组,且差异有统计学意义(P<0.05);两组ABIC评分比较,差异无统计学意义(P=0.224)(见表1)。Child-Pugh、PTAR及MELD评分箱线图见图1。
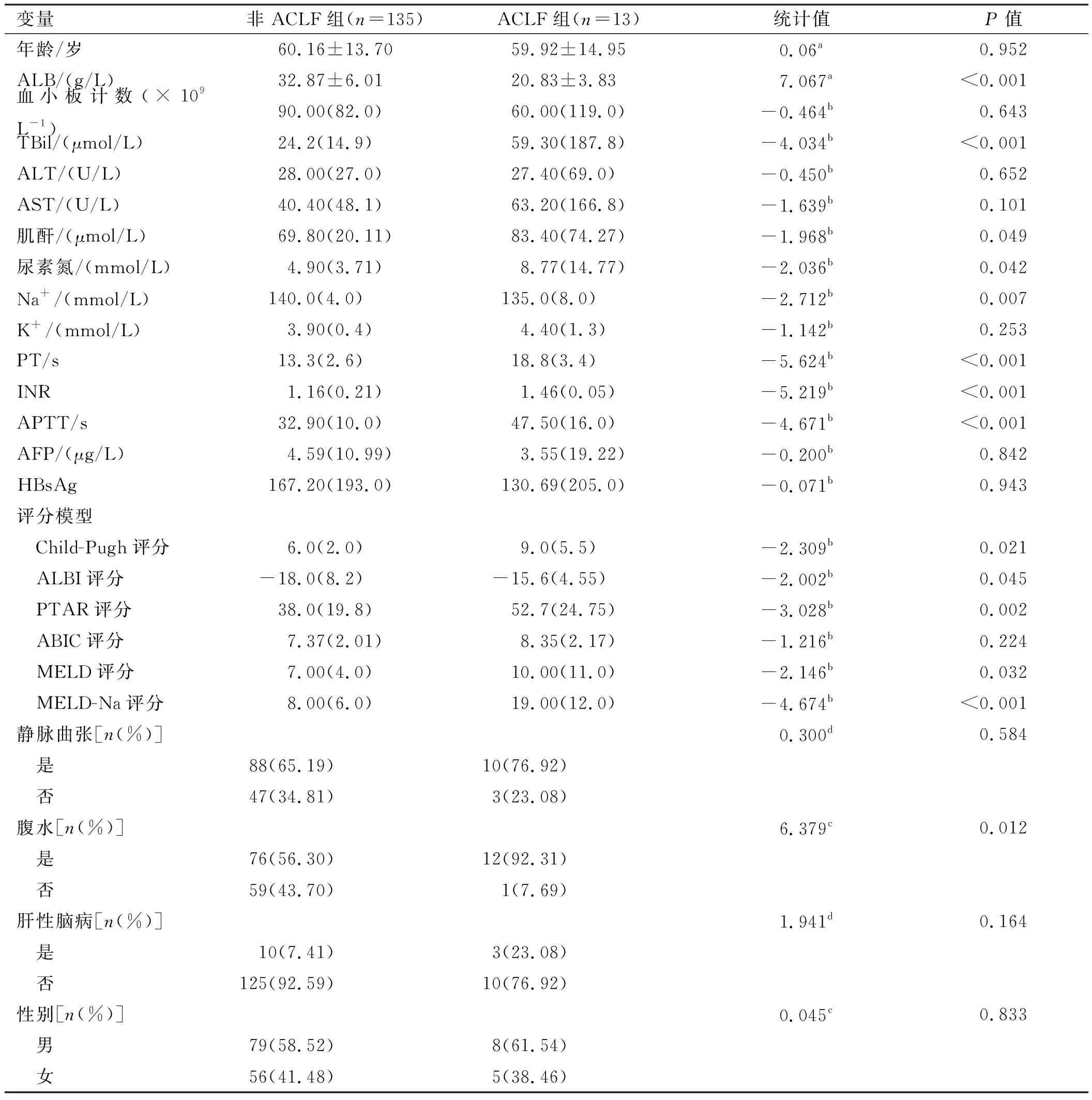
表1 乙肝肝硬化患者基线资料分析Tab 1 The general data of hepatitis B cirrhosis patients
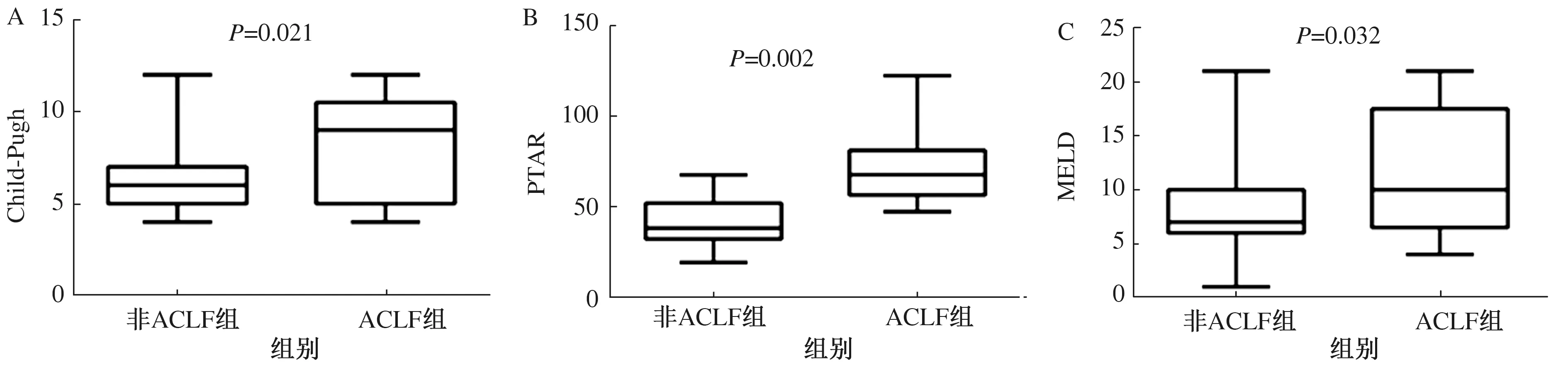
注:A:Child-Pugh评分; B:PTAR评分; C:MELD评分。
2.1.2 酒精性肝硬化组:ACLF组ALB、血清Na+低于非ACLF组,而TBil、AST、血肌酐、PT、APTT、INR、发生肝性脑病比例均高于非ACLF组,差异有统计学意义(P<0.05)。评分模型:ACLF组Child-Pugh、ALBI、PTAR、MELD、MELD-Na评分均高于非ACLF组,且差异有统计学意义(P<0.05);两组ABIC评分比较,差异无统计学意义(P=0.465)(见表2)。Child-Pugh、PTAR及MELD评分箱线图(见图2)。
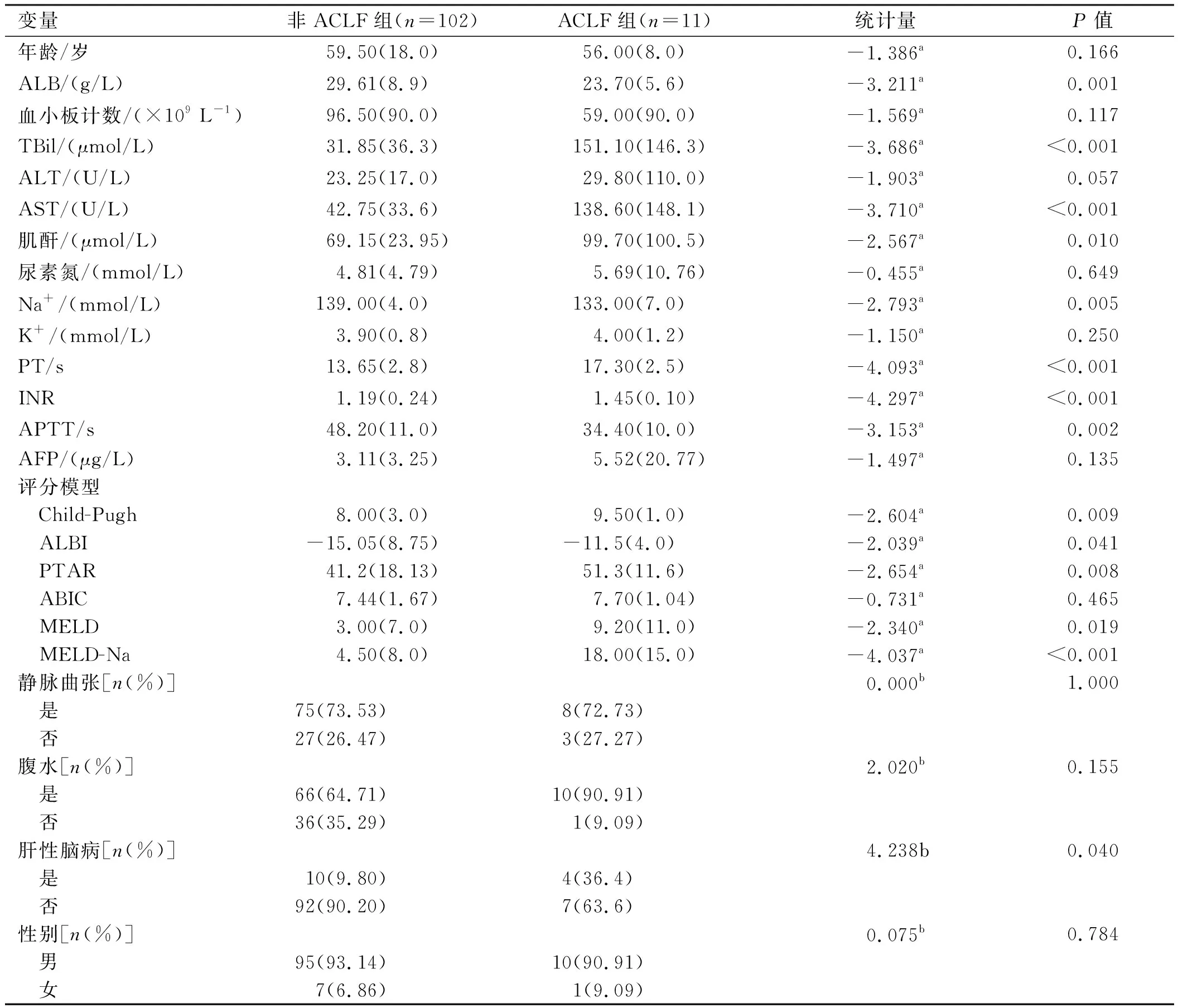
表2 酒精性肝硬化患者基线资料分析Tab 2 The general data of alcoholic cirrhosis patients

注:A:Child-Pugh; B:PTAK; C: MELD。
2.2 影响ACLF发生的单因素及多因素回归分析
2.2.1 乙肝肝硬化组:单因素Logistic回归分析纳入Child-Pugh、ALBI、PTAR、ABIC、MELD评分,是否发生食管胃底静脉曲张、腹水、肝性脑病。结果显示:Child-Pugh评分、PTAR评分、MELD评分及有无腹水是影响乙肝肝硬化患者进展为ACLF的影响因素(见表3)。对单因素回归分析具有统计学意义的指标进行Logistic多因素回归分析,结果显示,Child-Pugh评分及PTAR评分是影响ACLF发生的独立危险因素(见表4)。通过系数法合成为联合模型,联合模型的计算公式为0.360×Child-Pugh+0.07×PTAR×100-8.932。
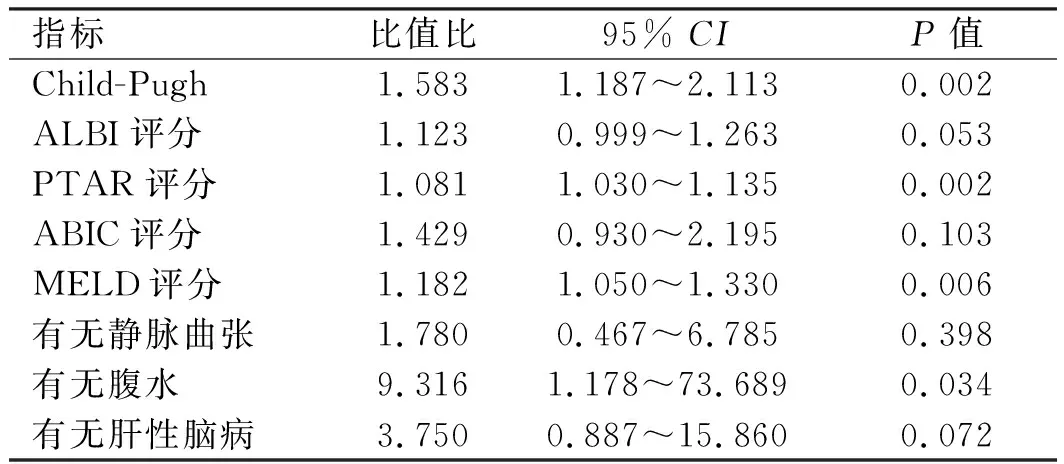
表3 乙肝肝硬化单因素分析Tab 3 Logistic univariate regression analysis of
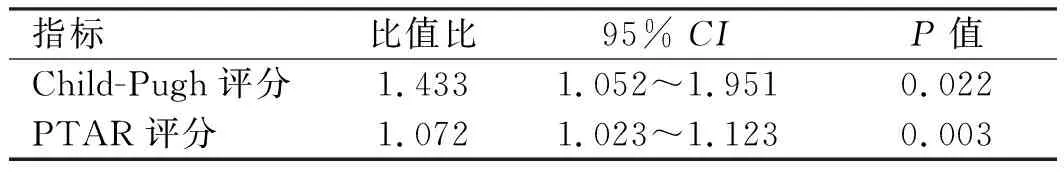
表4 乙肝肝硬化多因素分析Tab 4 Logistic multivariate regression analysis of
2.2.2 酒精性肝硬化组:纳入指标同乙肝组。结果显示:Child-Pugh评分、PTAR评分、MELD评分及有无肝性脑病是酒精性肝硬化患者发展为ACLF的影响因素(见表5)。对单因素回归分析具有统计学意义的指标进行Logistic多因素回归分析显示,PTAR评分及MELD评分为影响ACLF发生的独立危险因素(见表6)。通过系数法合成为联合模型,联合模型的计算公式为0.06×PTAR×100+0.125×MELD-5.72。
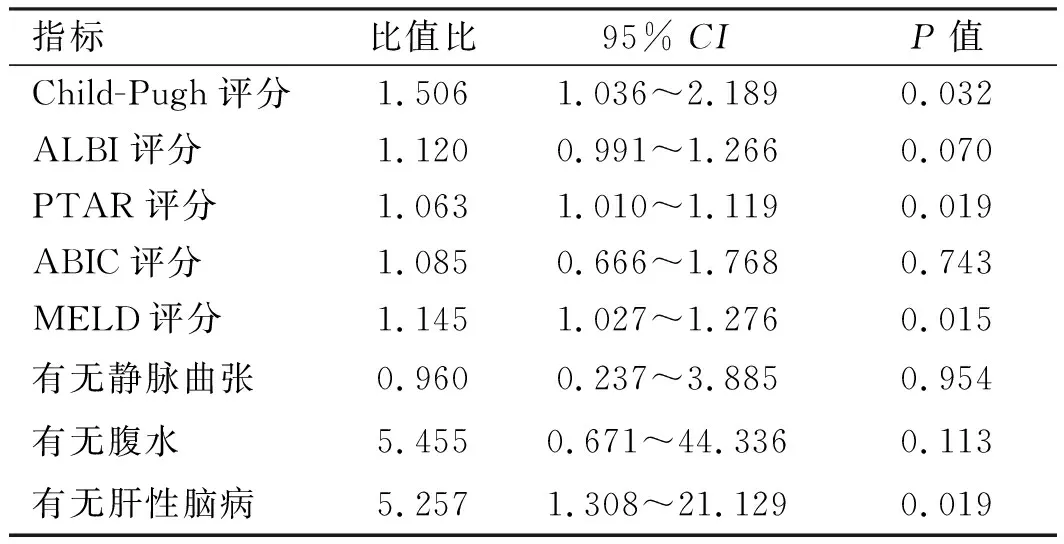
表5 酒精肝硬化单因素分析Tab 5 Logistic univariate regression analysis of
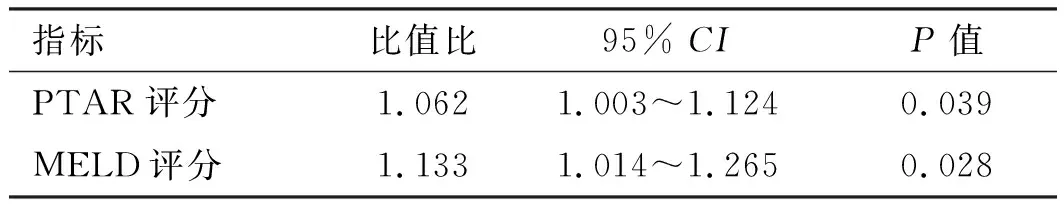
表6 酒精肝硬化多因素分析Tab 6 Logistic multivariate regression analysis of
2.3 评分模型对ACLF的预测价值
2.3.1 乙肝肝硬化组:Child-Pugh评分、PTAR评分及PTAR-CP联合模型三者的AUC分别为0.691、0.755、0.805。PTAR-CP较单一评分系统的AUC大,预测价值更高。PTAR与Child-Pugh联合模型约登指数为0.533,最佳临界点为-3.93(见表7、图3)。

表7 乙肝肝硬化组ROC曲线数据Tab 7 The ROC curve of hepatitis B cirrhosis patients
2.3.2 酒精性肝硬化组:MELD评分、PTAR评分及PTAR-MELD联合模型三者的AUC分别为0.715、0.744、0.773。PTAR-MELD较单一评分系统AUC大,预测价值更高。PTAR与MELD联合模型约登指数为0.534,最佳临界点为-2.15(见表8、图4)。

表8 酒精组性肝硬化ROC曲线数据Tab 8 The ROC curve of alcoholic cirrhosis patients
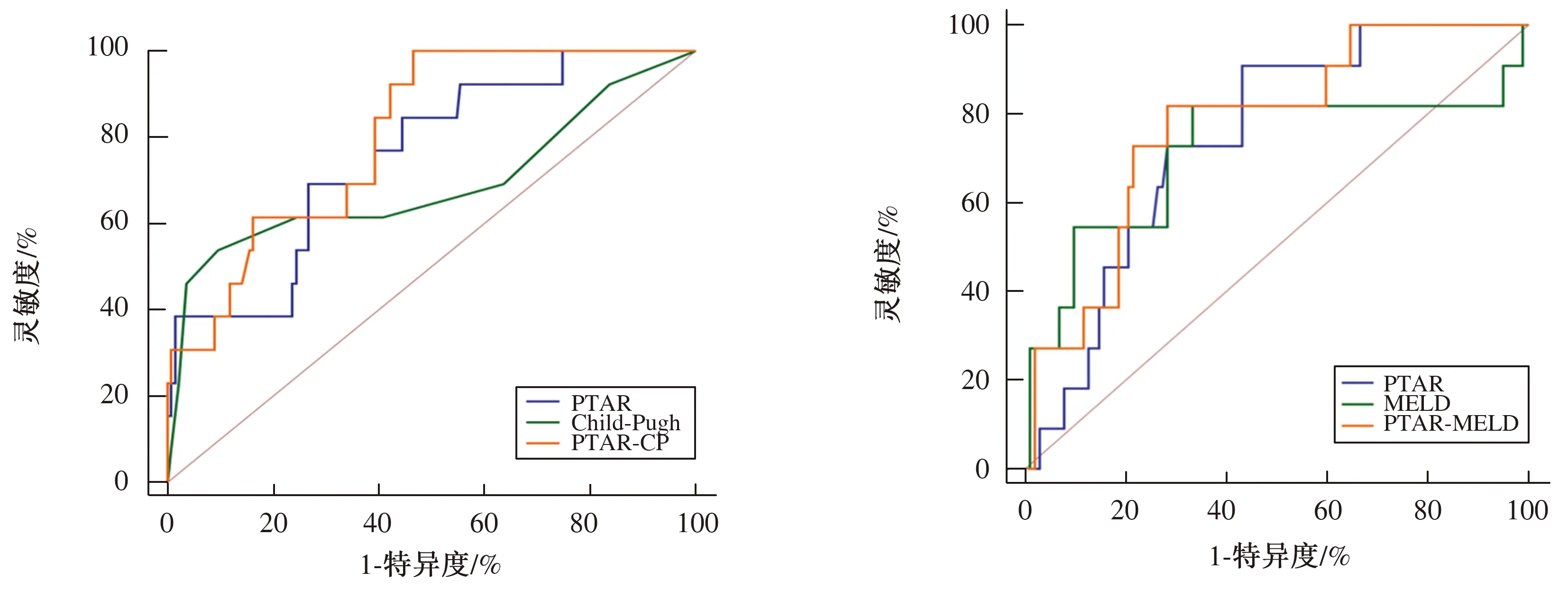
图3 乙肝肝硬化组PTAR、Child-Pugh、PTAR-CP评分模型对ACLF发生预测价值的ROC曲线;图4 酒精性肝硬化组模型PTAR、MELD、PTAR-MELD评分模型对ACLF发生预测价值的ROC曲线 Fig 3 The ROC curve of PTAR, Child-Pugh and PTAR-CP in hepatits B cirrhosis; Fig 4 The ROC curve of PTAR,
3 讨论
ACLF是终末期肝病的一种,由于大量肝细胞坏死,肝脏合成、解毒、排泄及生物转化等功能障碍,发病迅速,预后差,死亡率为50%~70%。Hernaez等[16]研究显示,在美国约25%的肝硬化患者进展为ACLF,且ACLF的1个月内死亡率为25%,3个月内死亡率可达40%,我们的数据显示,9.2%的肝硬化患者进展为ACLF,ACLF的6个月内死亡率为45.8%,发病率低于Hernaez等的研究,考虑与随访时间短有关。死亡率与其研究接近,提示ACLF是一种具有高死亡率、预后差的疾病。对于ACLF治疗,有较好治疗效果的肝移植,但由于肝源短缺、费用昂贵等因素,不能广泛应用于临床。所以ACLF的早期识别及对此积极管理的启动非常重要。
目前仅有少数学者对肝硬化患者ACLF发生的预测进行研究。Lehmann等[17]对CXCL10进行研究,Ruiz-Margin等[18]对纤维母细胞生长因子21(fibroblast growth factor 21,FGF21)进行研究发现,两者均为ACLF发生的预测因子。范玥等[19]使用中性粒细胞(NLR)对慢性乙型病毒性肝炎患者发生ACLF进行预测,发现其对于ACLF的发生具有较好的预测价值。这些研究均对于ACLF发生的预测起到了重要作用,但单一指标对于ACLF的预测存在着明显的局限性,难以对其进行全面、准确的评估。目前研究显示,Child-Pugh、MELD、MELD-Na、ABIC、ALBI及PTAR评分均包含多种反映肝功能状态的指标,均可对肝功能进行评估,并较为准确的预测患者预后。本试验纳入这些评分对肝硬化患者进展为ACLF进行预测研究,旨在为临床实践找到更为全面、准确预测ACLF发生的方法,减少医疗资源浪费,提高肝病患者的生存率。
乙肝肝硬化组研究显示,ACLF组与非ACLF组Child-Pugh、MELD、MELD-Na、ALBI、PTAR评分相比,差异有统计学意义。酒精性肝硬化组ACLF组与非ACLF组Child-Pugh、MELD、MELD-Na、ALBI、PTAR评分相比,差异有统计学意义。而ABIC评分,在乙肝肝硬化患者及酒精性肝硬化患者中ACLF组与非ACLF组差异均无统计学意义。乙肝肝硬化中Logistic单因素回归分析结果显示,Child-Pugh、MELD、PTAR、有无腹水是影响ACLF发生的影响因素。酒精性肝硬化中Child-Pugh、MELD、PTAR、有无肝性脑病是影响ACLF发生的影响因素。ALBI评分,在乙肝肝硬化及酒精性肝硬化患者中均非影响ACLF发生的因素。Rana等[20]研究显示,ABIC评分对于酒精性肝病及其基础上发生的ACLF预后具有预测价值。Chen等[21]研究显示,ABIC评分对于乙肝肝硬化基础上发生的ACLF短期死亡率评估也均有较好效果。ABIC虽对于肝病患者的预后评估具有作用,但根据本研究结果,其对于ACLF发生的预测价值不高。大量研究表明,ALBI对于肝功能的评估及预后预测具有很好的评估作用[22],本研究显示,ALBI并非影响ACLF发生的因素,表明其对于ACLF发生的预测价值不高。大量研究显示,Child-Pugh、MELD、PTAR评分,对于肝硬化患者的肝功能评估、肝癌术后肝衰竭发生及肝病患者的近远期预后均有评估作用[23-24],根据我们的研究数据显示,这些评分对于ACLF的发生也具有影响作用。
乙肝肝硬化组经多因素Logistic回归分析发现,Child-Pugh、PTAR评分是影响乙肝肝硬化患者发展为ACLF的独立危险因素。酒精性肝硬化组经相同统计学方法得出PTAR及MELD评分是影响酒精性肝硬化发展为ACLF的独立危险因素。以往研究表明,PTAR可作为肝癌患者术后肝衰竭发生的预测指标,其预测价值高于传统Child-Pugh、MELD、ALBI评分,甚至比目前所公认评估肝功能较准确的吲哚菁绿清除试验准确性高[10]。这与本研究得出的结论相似,无论是乙肝肝硬化组,还是酒精性肝硬化组,PTAR评分均为影响ACLF发生的独立危险因素。根据箱型图显示,PTAR评分无论在乙肝肝硬化组还是酒精性肝硬化组四分位间距均较小,提示其离散度小,具有准确评估作用。这均体现了PTAR对于预测ACLF具有较高价值。另外,乙肝肝硬化组经多因素回归分析筛选出了Child-Pugh评分,而酒精肝硬化组则筛选出了MELD评分。结合以往研究结论,影响这一结论的原因是MELD评分的研发是基于以酒精性肝病为主的研究群体而形成的评分系统,因此其对于酒精性肝硬化的评估更具有优越性[25]。而在乙肝肝硬化组则Child-Pugh更为适合。
乙肝肝硬化组将PTAR、Child-Pugh及PTAR-CP新型模型制作ROC曲线,结果显示:Child-Pugh、PTAR的AUC分别为0.691、0.755,均具有预测价值,而PTAR-CP的AUC为0.805。ROC曲线的AUC越大,提示预测准确性越高,因此PTAR-CP评分具有更好的预测价值。PTAR-CP的约登指数为0.533,高于单一评分,也提示该联合指标具有较好的预测价值。PTAR-CP的最佳临界点为-3.93,提示经PTAR-CP计算数值若≥-3.93,后期进展为ACLF的几率大大增加,而<-3.93则较低。酒精性肝硬化组结果显示:PTAR及MELD的AUC分别为0.744、0.715,PTAR-MELD的AUC为0.773,提示三者均对ACLF发生具有预测价值,相比而言,PTAR-MELD联合模型的AUC更大,预测价值更好,更能指导临床评估。PTAR-MELD联合模型的约登指数计算为0.534,均高于单一指标,证明了PTAR-MELD预测ACLF的准确性。PTAR-MELD的最佳临界点为-2.15,若≥-2.15提示后期进展为ACLF的可能性高。
PTAR-CP评分包含胆红素、PT、ALB,还包含了腹水、肝性脑病指标,反映了肝脏的损伤程度、合成能力及肝病的并发症情况。PTAR-MELD评分包含胆红素、ALB、INR、血肌酐,不仅全方位反映了肝脏的损伤、合成能力,也将反映肾功能的指标(肌酐)纳入,更全面的体现了肝功能状态。且两个新型评分经过联合模型计算,将两种单一模型取长补短,形成了更有预测价值的联合模型,为预防ACLF发生提供了积极的指导作用。
本研究存在一定的不足之处。首先,本研究为回顾性研究,在数据收集及随访过程中,难免具有混杂因素,影响数据准确性。其次,本研究为单中心,样本量较小,可能对研究结果具有影响。未对各个评分进行动态研究,未形成科学的分级标准。因此,Child-Pugh、MELD、PTAR等评分对于肝硬化患者ACLF发生预测的研究尚待多中心、大样本、前瞻性、动态性的研究加以证实。
总之,PTAR-CP联合评分对于乙肝肝硬化基础上ACLF发生的预测价值较高。当联合模型计算数值若>-3.93,提示后期进展为ACLF的几率大大增加。PTAR-MELD联合模型对于预测酒精性肝硬化基础上ACLF发生的预测价值较高。经联合评分计算数值>-2.15提示后期进展为ACLF的可能性高。ABIC、ALBI对于肝硬化患者进展为ACLF的预测价值有限。结合以上结果对进展为ACLF风险高的患者的治疗应更为积极。在抗病毒、戒酒等病因治疗的基础上,要更积极地进行保肝、退黄、改善并发症等治疗。目前也有对肝衰竭前期或肝衰竭患者进行激素治疗的研究,但安全性及可行性仍需大量研究验证[26]。对于风险很高的患者,也应早期积极使用人工肝及肝移植等治疗,预防ACLF的发生,改善患者的预后,提高肝病患者的存活率。不仅如此,还可以为肝源的分配管理、肝癌手术方式的选择提供指导。

