光致电化学生物传感器中信号放大技术的应用进展
邓寒梅, 刘圣星
(1. 海南医学院,急救与创伤研究教育部重点实验室,海南海口 570102)
(2. 海南医学院第二附属医院,海南海口 570102)
0 引言
光致电化学(PEC)是一种将光能转化为电能的现象,在光照下,光电活性物质的基态电子吸收能量后跃迁到激发态。 激发态电子通过电子调节机制发生电荷转移,最终形成光电流。 光致电化学生物传感器是基于光电化学理论发展起来的分析检测平台, 能对某种物质进行信号响应,以实现对离子、小分子、蛋白质、酶、核酸、微生物和细胞等物质的检测, 可应用于物质的定量分析、食品的检测、环境的监测和生物事件的记录,在太阳能电池、光能转化相关器件、光电催化、水质分析、大气监测、生物识别、基础医学研究、临床诊疗和生物医药相关的领域具有重要的指导意义[1-5]。 光致电化学生物传感器结合了电化学与光学的特点,具有易集成化、微型化、操作简便、稳定性强、分析成本低等优势,引起了研究者们的广泛关注。 传感器主要由光源、识别系统、信号转换器和信号接收元件组成,根据信号转化方式的不同可以分为半导体生物传感器、测光型生物传感器、压电晶生物传感器、测热型生物传感器和光电化学生物传感器等[6-8]。 依据信号输出方式则可分为阴极光电流和阳极光电流型传感器。 其中目标物浓度变化引起识别前后的信号变化,这些因素导致的信号变化形成了信号衰减型(signal off)、信号增强型(signal on)、信号增强-衰减-增强型(signal on-off-on)、信号增强-衰减-超级增强型(signal on-off-super on)等模式光致电化学生物传感器。 通过检测目标物的类型不同,可以称为DNA 传感器、 免疫传感器、 酶传感器和细胞相关的传感器等[9]。 原理上,光致电化学(PEC)可以看作是电致化学发光(ECL)的逆过程,电致化学发光是通过施加电压,体系中的物质进行电子转移发光以达到检测光强度。 光致电化学则是利用光激发物质产生电子转移记录光电流信号,从而实现目标物的检测。 在整个分析中,研究者们将更多的目光投入到灵敏分析相关的研究。 信号放大策略能直接影响检测的灵敏度,其放大效率与传感器的检测效果息息相关。 为了提高检测的灵敏度,在PEC 传感器的构建过程中开发各类信号放大技术来提高信号输出倍数,增大了目标物检测范围的同时还降低了检测限。 此外,信号放大策略还极大地增强了生物传感器的抗干扰能力,并有利于对假阳性信号的筛查。 因此,设计有效且与分析物相匹配的信号放大策略尤为重要。
1 纳米材料信号放大技术
纳米材料是一种催化性能较好﹑比表面积较大和生物相容性较强的材料, 具有小尺寸效应﹑量子尺寸效应﹑表面效应﹑宏观量子隧道效应和介电限域效应。 在光学、热学、电学、磁学、力学等方面会有独特的性质,在光致电化学生物传感器中得到广泛的应用。 纳米材料在光致电化学生物传感器中可以作为基底材料,由于其比表面积大可用于固载大量生物探针,与生物分子之间有较好的生物相容性和强烈吸附力。 此外,还可通过化学键连接生物分子作为桥梁将生物分子连接在电极上。 还可作为生物分子的载体,用来固载抗体﹑核酸﹑酶和光电活性物质等。 纳米材料本身可以作为光电活性材料产生增强的信号,主要分为有机光电活性材料﹑无机光电活性材料和复合型光电活性材料,某些贵金属金(Au)、银(Ag)、铂(Pt)、钯(Pd)等或者其他的一些无机纳米材料具有很好的催化活性,能通过催化反应在电解质溶液中产生电子供受体或沉淀来有效地放大信号。
张春阳课题组[10]首次利用锰模拟酶(MnME)和硫化铋(Bi2S3)纳米棒构建了一种用于检测多核苷酸激酶(PNK)的传感器(如图1)。 利用纳米棒和金纳米粒子作为基底,电极上的捕获探针能与金纳米粒子与锰模拟酶(MnME@AuNPs)复合材料标记的信号探针进行杂交形成双链DNA。在没有PNK 的情况下, 锰模拟酶能够刺激催化反应在电极表面生成大量的沉淀物质,阻碍电极上的电子转移,得到信号较小的初始信号。 当PNK存在的情况下, 双链DNA 被磷酸化可以被外切酶剪切, 使电极上的MnME@AuNPs 被释放,产生增强的PEC 信号, 从而实现信号放大检测目标物。
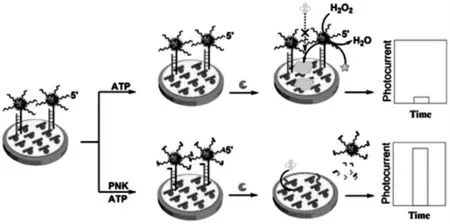
图1 基于纳米材料放大策略的PEC 生物传感器示意图Fig.1 Schematic diagram of PEC biosensor based on the amplification strategy of nanomaterials
2 酶催化放大技术
酶是一类极为重要的生物催化剂,在生物体中参与各种代谢反应。 在光致电化学生物传感器中,酶通过催化底物发生反应,产生电子供受体促进电子传递增强光电流信号,或催化产生沉淀来阻碍电子的传递使光电流信号显著降低,从而实现信号放大。常见的酶有葡萄糖氧化酶(GOx)、乙酰胆碱酯酶(AChE)、辣根过氧化物酶(HRP)和碱性磷酸酯酶(ALP)等。 罗细亮课题组[11]利用GOx 和HRP 为生物催化剂构建了一种将光阳极与光阴极集成的选择性增强型PEC 传感器。如图2 所示, 过氧化氢通过GOx 催化葡萄糖而产生,在HRP 存在下,能将4-氯-1-萘酚(4-CN)催化氧化生成沉淀物,光电流信号能显著降低从而达到目标物的灵敏检测。
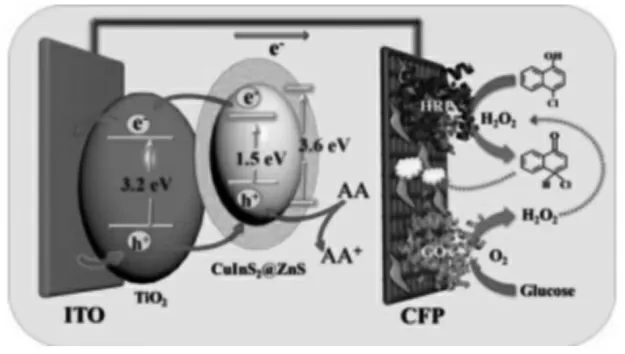
图2 基于GOx 和HRP 生物酶催化放大的PEC 生物传感器示意图Fig.2 Schematic diagram of PEC biosensor based on the bio-enzymatic catalyzed amplification of GOx and HRP
梅丽萍团队[12]合成了AgI/Ag/BiOI 异质结阵列材料, 并在电极上固载HRP 修饰的氯霉素(CAP)适体(HRP-CAP 适体),能原位催化产生沉淀(BPC)(如图3)。通过引入CAP,适体从电极上释放出来,同时终止了BCP 反应,光电流信号能得到进一步的恢复从而实现对氯霉素的检测。这项工作为设计PEC 适体传感器开辟了一条新的途径,对环境样品的检测具有较大的意义。
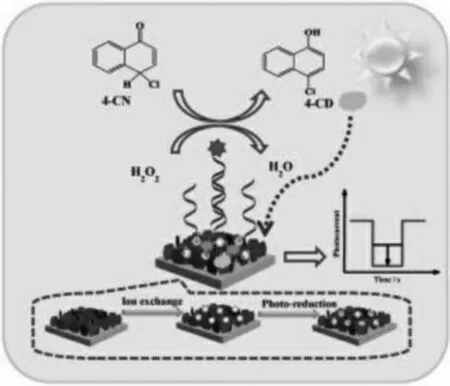
图3 基于HRP 生物酶催化放大的PEC 生物传感器示意图Fig.3 Schematic diagram of PEC biosensor based on the HRP bio-enzyme catalytic amplification
李念兵课题组[13]基于ALP 催化的磷酸化反应构建了“signal on”型光电化学(PEC)生物传感器用于灵敏地检测催化活性(如图4)。 在此实验中,ALP 可催化L-抗坏血酸2-磷酸三钠盐原位产生抗坏血酸,为二氧化钛(TiO2)和石墨氮化碳(g-C3N4) 纳米复合光敏材料提供了电子供体,有效地抑制了电子-空穴复合, 提高了光电转换效率。ALP 活性的检测限低至0.03 U/L,为血清蛋白的ALP 活性测定提供了新途径。
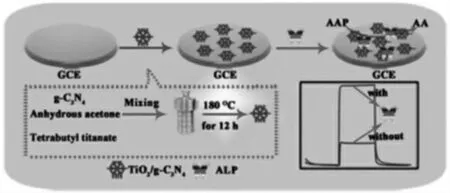
图4 基于ALP 催化的磷酸化反应的PEC 生物传感器示意图Fig.4 Schematic diagram of PEC biosensor based on the ALP catalyzed phosphorylation
3 核酸信号放大技术
核酸放大因能够将微量目标物转化为大量输出物,显著提高传感器灵敏度而受到广泛的关注。 核酸放大策略主要包括滚环扩增 (RCA)放大、链置换反应(SDR)、杂交链式反应(HCR)、催化发夹组装(CHA)放大和剪切循环放大策略。 一个目标物分子就可以输出放大N 倍的信号,进而达到高灵敏的检测目标物分子。 这些放大策略又可分为凭借聚合酶、 内切酶、 外切酶、 连接酶、DNA 模拟酶和无酶参与的信号放大策略。
3.1 滚环扩增
滚环扩增是一种可以直接扩增DNA 和RNA的典型恒温扩增技术。 在酶的催化作用下,能将引物DNA 短链复制成环状DNA 模版互补的成百上千个重复单元组成的DNA 长链。 例如,周云雷课题组[14]利用滚环扩增技术提出了一个目标物指数级放大的策略。 如图5, 目标物miRNA-319a 作为引物与挂锁探针杂交,在T4-DNA 连接酶的作用下,形成环状模板。 随后,在DNA 聚合酶以dNTP 为原料的催化作用下启动RCA 反应,从而得到重复核苷酸序列的DNA 长链。 在限制性内切酶Nb.BsmI 的辅助剪切下,新一代引物能触发新的RCA 反应,得到指数级扩增的DNA 用于固载大量标记有亲和素的碱性磷酸脂酶(avidin-ALP),光电流信号因此明显增强,灵敏度得到提高。 所设计的检测系统具有良好的特异性和灵敏性,为生物分析提供了检测模型并具有广泛应用的巨大潜力。
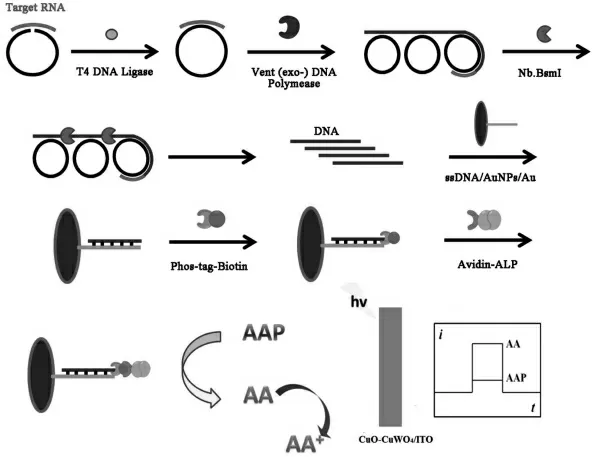
图5 基于指数级放大的滚环扩增策略的PEC 生物传感器示意图Fig.5 Schematic diagram of PEC biosensor based on the rolling circle amplification strategy
唐点平团队[15]设计了一种基于硫代胆碱(TCh) 溶解的核壳MnO2复合的CdS 纳米花(MnO2NF@CdS)和滚环扩增反应的光电化学传感平台用于检测有机磷农药(如图6)。 体系中引入目标物马拉硫磷(malathion)后,适体从磁珠上分离,捕获的cDNA(带有引物片段)留在磁珠上,引物片段能触发RCA 反应, 形成长链DNA(ssDNA)。 通过与S2-Au-BChE 探针杂交,大量的丁酰胆碱酯酶(BChE)被固载在ssDNA 上。 组装上的BChE 能水解ATCh, 产生大量的TCh,核壳中的MnO2则被还原成Mn2+。与此同时,CdS 纳米粒子从核壳中释放出来,PEC 信号能够显著增强。 在最佳条件下,适体传感器对马拉硫磷的检测限低至0.68 pg/mL。 该传感器平台表现出良好的特异性、重现性和稳定性,且该传感平台为农药的检测提供了新的思路。
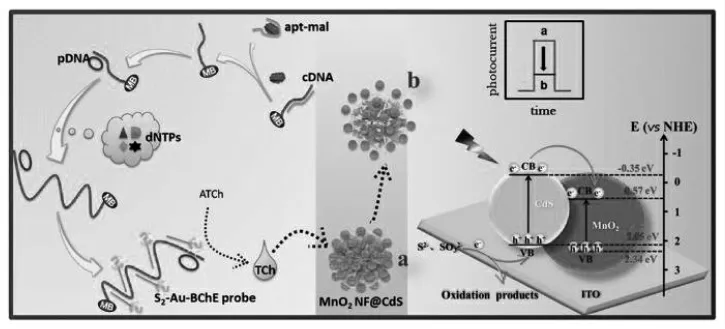
图6 基于MnO2NF@CdS 和滚环扩增放大策略的PEC 生物传感器示意图Fig.6 Schematic diagram of PEC biosensor based on the rolling circle amplification strategy and MnO2NF@CdS nanomaterials
3.2 链置换反应
在外源物质(如:DNA、金属离子、酶、生物小分子等)作用下,DNA 双链解旋成两条单链,其中的单链DNA 与另外一条单链DNA 结合形成更稳定的双链DNA 过程为链置换反应(SDA)。 链置换反应不仅能程序化自组装,还能建立动力学体系,用于固定轨道行走的DNA 步行器、自组装的分子齿轮、运动的分子机器人和无外驱的分子马达等DNA 器件的构建。 最近,陈洪渊团队[16]报道了一种基于商驱动裸露端介导的DNA 链置换反应, 构建了检测前列腺癌 (PCa) 生物标记物miRNA-141 的PEC 生物传感器。 如图7 所示,目标物miRNA-141 通过与三元体的边缘裸露端互补,进行置换杂交反应,形成中心段裸露的中间体。 磁性分离后,在反应体系中加入足够的燃料链(F),导致标记金纳米粒子(AuNPs)的DNA 链被释放出来并被光敏聚合物点(Pdots)标记链所捕获。 近距离的AuNPs 与Pdots 之间发生能量转移,促使信号降低用以目标物的检测。 这种熵驱动裸露端介导的DNA 链置换反应为PEC 生物传感器的无酶检测开辟了新的方向。
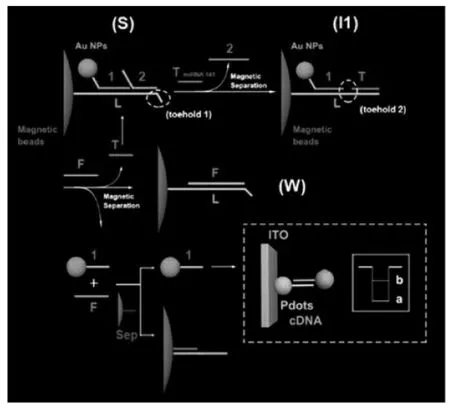
图7 基于熵驱动裸露端介导的DNA 链置换反应构建的PEC 生物传感器示意图Fig.7 Schematic diagram of PEC biosensor based on entropy-driven toehold-mediated DNA strand displacement reaction
江婧婧课题组[17]利用β-环糊精功能化CdS纳米棒(β-CD@CdS NR)/WS-2 纳米片(NS)异质结构作为光电活性材料基底,然后在其表面负载生物素标记的发夹DNA(Bio-H2)。 如图8 所示,当目标物microRNA-21 存在下,金刚烷标记的发夹DNA(ADA-H1)能够被打开,在DNA 发夹H2的辅助下能触发链置换循环反应(SDR),产生大量的杂交体裸露出标记的生物素。 通过结合标记有亲和素的CuO 猝灭剂,光电流信号显著降低。该生物传感器的线性范围为0.1 fmol/L 至10 pmol/L,检测限低至25.1 amol/L,对某些癌症的早期诊断具有非常大的潜力。
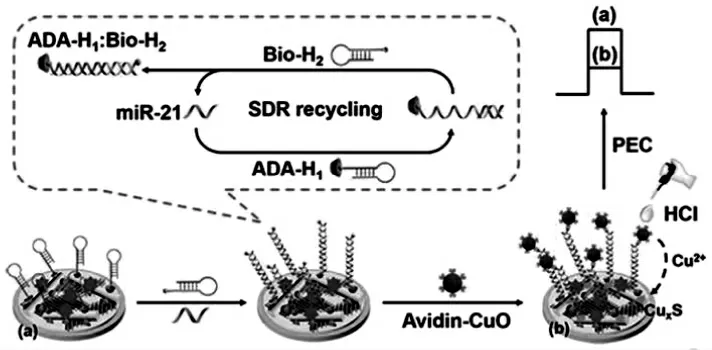
图8 基于(β-CD@CdS NR)/WS-2 纳米片(NS)异质结构和链置换循环反应(SDR)构建的PEC生物传感器示意图Fig.8 Schematic diagram of the fabricated PEC biosensor based on the strand displacement reaction(SDR)and(β-CD@CdS NR)/WS-2 nanosheets
俞锦华团队[18]报道了一种tohold 端介导的链置换反应 (TSDR) 用来检测let-7a, 共轭的ALP@AuNPs-H2 (ALP 和AuNPs-H2 的结合物)与DNA 单链H1 相互杂交,ALP 能够将抗坏血酸2-磷酸酯(AAP)转化为抗坏血酸(AA),催化氧化提供电子,导致Bi2S3材料的光电流信号增强(如图9 所示)。 引入let-7a 目标物,进行链置换反应(SDR), 经过fual DNA 链的辅助, 释放的let-7a能够参与下一个SDR 循环过程, 导致AAP 离开电极表面,用于目标物的超灵敏检测。 传感器表现出良好的线性度范围 (0.01 nmol/L~1000 nmol/L),检测限为6.7 pmol/L。
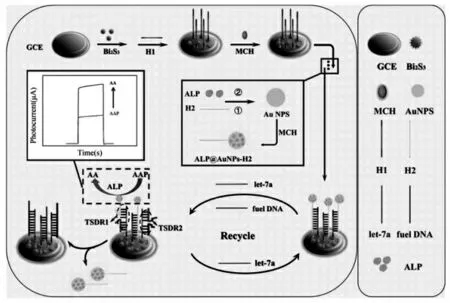
图9 基于tohold 端介导的链置换反应(TSDR)用来检测let-7a 的PEC 生物传感器示意图Fig.9 Schematic diagram of PEC biosensor based on tohold-medidate strand displacement reaction(TSDR)for the sensitive detection of let-7a
3.3 杂交链式反应
稳定的发夹探针通过诱导,交替开环杂交形成自组装线性长链DNA 的过程称为杂交链式反应。 杂交链式反应是一种自助装的等温扩增技术,避免了额外辅助酶的需求,也无需复杂的变温环境。 具有易控制、操作简单、非特异性扩增少等优势,能广泛应用于各种生物分析。 朱俊杰课题组[19]提出了一种基于超支化杂交链式反应的新型光致电化学生物传感器。 如图10,当目标物存在时,会触发一个催化发夹自组装反应并释放trigger1 链,能进一步引发后续两个超支化杂交链式反应(HCR1 和HCR2), 最终形成树枝状DNA结构用于结合hemin/G-四链体酶。hemin/G-四链体酶催化4-氯-1-萘酚(4-CN)产生沉淀,有效地抑制了光电流信号,可实现目标物RNA 的检测。这项工作具有背景信号低、稳定性好、重复性高、特异性强等优点,在生物分析中有巨大的潜力。
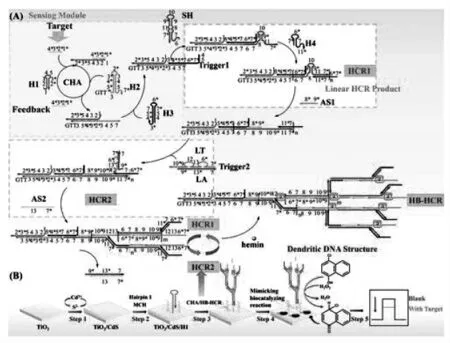
图10 基于超支化杂交链式反应的PEC 生物传感器示意图Fig.10 Schematic diagram of PEC biosensor based on hyperbranched hybridization chain reaction
3.4 催化发夹组装
催化发夹组装反应是一种低背景的无酶信号放大技术。 通过发夹之间的杂交反应来驱动DNA 的自组装, 能启动数百倍的催化放大反应。由于可编程性,基于催化发夹组装反应构建的传感器在方便、快捷、灵敏的检测方面具有极大的优势。 此外,催化发夹组装可用于特定的信号转换器。如图11 所示,混旭团队[20]结合碱基错配的催化发夹组装循环反应,以二硒化钨-半胱氨酸-多巴胺(WSe2/Cys/DA)为纳米探针,提出了一种背景信号低的PEC 检测方法, 实现了检测限为3.3 amol/L 的超灵敏miRNA-221 分析。
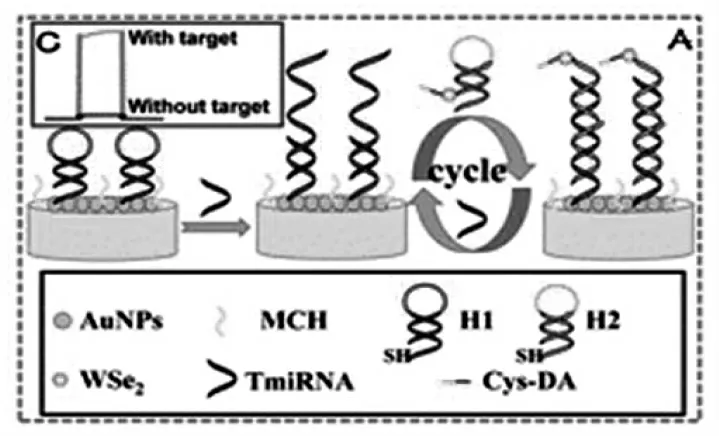
图11 基于催化发夹组装反应的PEC 生物传感器示意图Fig.11 Schematic diagram of PEC biosensor based on catalytic hairpin assembly reaction
鞠熀先课题组[21]设计了一种催化发夹自主装(CHA)程序化的卟啉DNA 复合物来触发化学发光作为光致电化学引发剂(如图12)。 首先,两个发夹H1 和H2 在目标DNA 的引发下自组装形成杂交双链H1:H2,然后,固定在修饰有CdS 量子点的捕获DNA 链(C-DNA/CdS)上。 接下来,在DNA 双链的沟壑中嵌入卟啉(FeTMPyP)组装在双链DNA 支架上形成配合物, 对鲁米诺具有很强的催化活性,在不同温度和碱性条件下氧化生成高稳定性的化学发光。 结合CHA 的信号放大策略和FeTMPyP 介导的原位化学发光作为激发光, 提出了一种用于DNA 检测的放大光电化学传感平台。 在优化条件下,该传感器的线性范围为5 fmol/L~1000 fmol/L,检测限为2.2 fmol/L。 此外, 构建的光电化学传感器具有优良的选择性、高稳定性和重现性, 不仅拓展了光电化学的应用,而且为生物分析提供了一种新的方法。
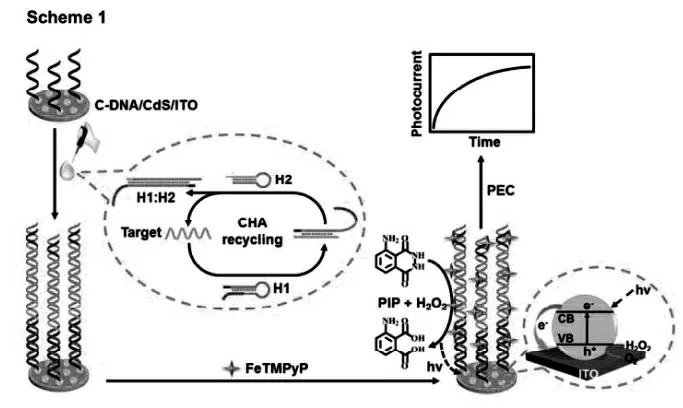
图12 基于催化发夹自主装(CHA)程序化的卟啉DNA复合物的PEC 生物传感器示意图Fig.12 Schematic diagram of PEC biosensor based on catalytic hairpin assembly(CHA)programmed porphyrin DNA complex
3.5 剪切循环放大
剪切循环放大是一种依赖于剪切反应释放出核酸链的循环过程,通过剪切反应,单链核酸从杂交体中分离出来用于后续的操作。 随着反复剪切的进行,源源不断地产生单链核酸,最终实现信号放大。 剪切循环放大主要包括酶剪切循环放大和无酶剪切循环放大方法。
3.5.1 酶剪切循环放大
典型的切割酶有限制性内切酶、外切酶和双链特异性核酸酶(DSN)等。其中,限制性内切酶能识别特定核酸序列,对特异性位点进行切割。 外切酶是一类从核酸链末端开始进行水解消化的酶。 双链特异性核酸酶(DSN) 则能选择性消化DNA 双链或DNA 与RNA 杂交体中的DNA 链。
殷焕顺团队[22]以双链特异核酸酶(DSN)辅助的剪切循环放大技术为基础, 耦合碳量子点(CQDs)与金纳米粒子(AuNPs)之间的能量转移(ET), 研制了一种用于miRNA 超灵敏检测的新型PEC 生物传感器。 如图13 所示,首先,通过发夹探针 H1的固载,AuNPs 被带到靠近CQDs@Mo2C 修饰的电极上。 此时,由于CQDs 和AuNPs 之间的能量转移,PEC 信号被猝灭。 在miRNA-159b 存在下, 形成DNA-RNA 双链并解开H1的茎,使AuNPs 远离电极表面,生物传感器则切换到“信号开启”模式。 随后,只切割DNARNA 双链中DNA 的DSN 酶诱发剪切循环,发夹H1部分碱基被切割, 导致miRNA-159b 的释放。于此同时,溶液中的miRNA-166a 与发夹探针H2杂交形成DNA-RNA 双链,经过DSN 切割循环,产生AuNPs 标记的探针。 它能与CQDs@Mo2C 修饰电极上H1剩余的部分序列互补, 将AuNPs 标记的探针连接到电极上, 由于CQDs 和AuNPs之间存在能量转移,PEC 信号再次被猝灭,能够对miRNA-159b 和miRNA-166a 进行高灵敏度检测。
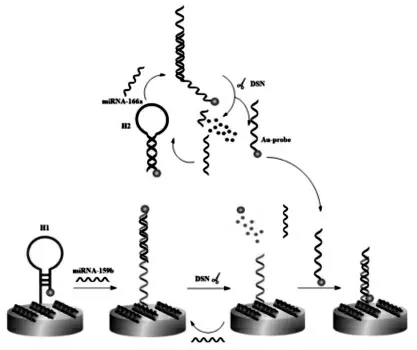
图13 基于剪切循环放大的PEC 生物传感器示意图Fig.13 Schematic diagram of PEC biosensor based on cleavge cycle amplification
3.5.2 非酶剪切循环放大
某些金属离子或特异性小分子具有与酶类似的功能,能够特异性剪切核酸序列且比蛋白酶具有更强的稳定性和耐热性。林璋课题[23]组利用花状氧化锌(ZnO)纳米材料,研制了一种基于离子剪切循环放大的光致电化学传感器。 如图14所示,采用水热分解方法在氧化铟锡(ITO)电极上制备了ZnO 纳米花, 然后, 用静电吸附法在ITO/ZnO 电极上组装DNAzyme。 在Pb2+存在下,DNAzyme 的切割活性被激活, 底物链被切割,导致DNA 上的光活性离子Ru(bpy)2(dppz)2+释放出来,使光电流信号降低达到检测目的。 结果表明该传感器具有灵敏度高、选择性好等优点。
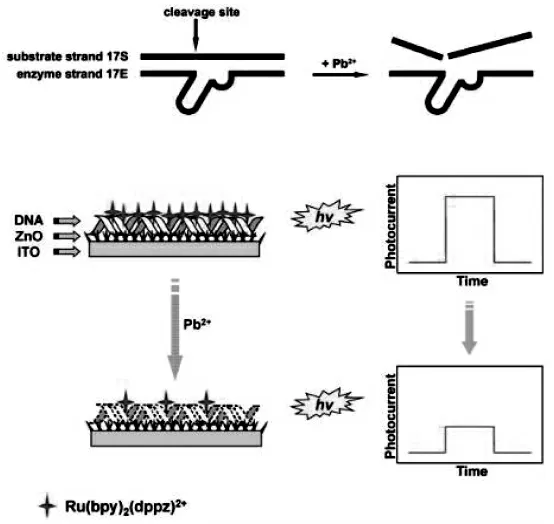
图14 基于金属离子剪切循环放大的PEC 生物传感器示意图Fig.14 Schematic diagram of PEC biosensor based on metal ion-cleavge cycle amplification
4 总结与展望
目前,PEC 生物传感器已应用于蛋白质、核酸、细胞和微生物等相关检测,对疾病的发现、预防和治疗都有很大的帮助。 各种各样的信号放大策略被引入到生物传感器中,拓展了光致电化学检测方法,同时也推动了高灵敏度的传感器的发展。 尽管这些年光致电化学得到了蓬勃的发展,但检测的灵敏度与准确性仍然是一个巨大的挑战。 大多数情况下,信号得到放大的同时,传感器的背景信号会增加。 因此,进一步开发新型的、稳定的、灵敏度高的、准确性好的光致电化学传感器吸引了研究者的广泛关注。

