DNA 步行器的构建及其在生物分析中的应用
廖 妮, 杨 芳, 潘美辰, 刘 伟, 卓 颖*
(1. 西南大学化学化工学院, 重庆 400715)
(2. 攀枝花学院生物与化学工程学院, 四川攀枝花 617000)
0 引言
分子机器在生物体中无处不在,执行各种生理功能,包括机械驱动、细胞内运输和信号转导。DNA 以其精确的碱基配对、序列可编程性、结构可控性、易合成和修饰,被认为是构建人工分子机器理想的元件。 到目前为止,研究人员已经设计出多种性能优良的DNA 分子机器, 它可以在纳米尺度上执行特定的功能, 如:DNA 纳米机器人[1-2]、DNA 镊子[3-4]和DNA 步行器[5-6]等。 DNA步行器作为一种新型的人工纳米机器,它是对自然产生的分子步行器(如动力蛋白、肌球蛋白和驱动蛋白)的人工模拟。 组成它的核酸能够部分或全部地沿着精心设计的DNA 轨道自主地、渐进地运动并整合运动过程中信号。该文将从DNA步行器的组成及其在生物传感分析方面的应用进行概述。
1 DNA 纳米步行器的构建
从结构上讲,DNA 步行器由三个基本部件组成,包括行走链、轨道链和燃料分子或其他形式的驱动行走的能量输入(也称为驱动力)。 驱动力打破初始平衡, 促进光能或化学能转化为机械能,使行走链沿着轨道链运动。 然后,通过消耗燃料分子,恢复反应平衡,从而产生信号。 平衡不断地被打破和恢复,最后输出放大的信号。 在驱动力的刺激下,目标物直接或者间接的参与导致反应的热力学和动力学平衡破坏而倾斜,然后其他的能量转化为机械能, 这样预先设计的DNA 链(行走链)就可以沿着轨道链行走。
1.1 行走链
根据DNA 步行器中行走链的数量,DNA 步行器可以分为 (1) 单足DNA 步行器、(2) 双足DNA 步行器和(3)多足DNA 步行器。只有一条行走链可自由活动的单足DNA 步行器是最简单的形式。 目前有两种典型的单足DNA 步行器,分别如图1 和图2 所示。 图1 中的单足DNA 步行器有一条长长的步行链, 其一端固定在刚性基质(金纳米颗粒)上,另一端由目标物驱动激活并沿着轨道链行走[7]。图2 中的单足DNA 步行器的行走链是一条两端可自由移动的短链,该行走链由目标物驱动激活并在外切酶的辅助下,完成在轨道链上的行走[8]。
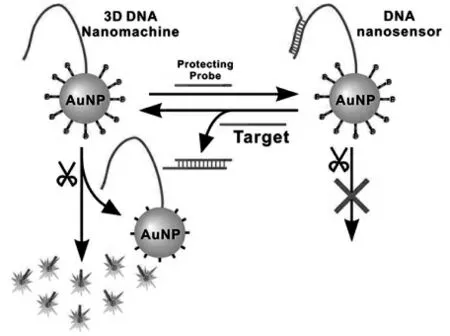
图1 DNA 行走链和DNA 轨道链共同组装在的单个AuNP 的三维DNA 纳米机器Fig.1 Schematic illustrating the principle of the 3-D DNA nanomachine constructed by co-conjugating DNA walker and DNA track(substrate)components on a single AuNP.Copyright 2016 ACS
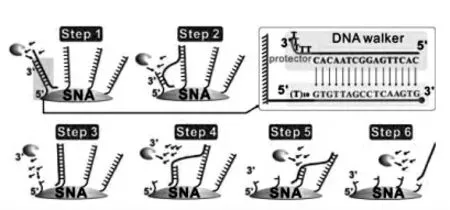
图2 Exo Ⅲ驱使的DNA 步行器在球型核酸上的行走示意图Fig.2 Schematics for Exo III-powered stochastic DNA walkers that move on the SNA surfaces.Copyright 2017 Wiley
单足DNA 步行器在实际应用上存在一定的不足,步行链太短会导致行走速度较慢,行走空间范围有限。 而行走链太长,则行走轨迹难以控制并可能会脱离轨道,使得反应暂时中止,只有等到行走链结合在另一条DNA 轨道上, 反应才能继续进行, 从而导致行走过程中的步数减少,信号放大效率较低。
双足DNA 步行器的行走链两端相对自由,其行走链的两端都可以沿着轨道链行走。 由于双足DNA 步行器的行走链可以在轨道链上有更多作用位点, 与单足DNA 步行器相比, 双足DNA步行器表现出更强的稳定性和更高的反应效率。如图3 所示,Chai 等[9]设计了一种目标物触发的双足DNA 步行器并应用于目标物的灵敏检测。此外,Chen 等[10]采用核酸等温扩增反应引发的一个无酶双足DNA 步行器,构建了一个灵敏、快速检测microRNA 的电化学发光(ECL)生物传感器。虽然双足DNA 步行器的行走范围比单足DNA 步行器宽,但是它们对运动轨迹的可控性相对较差。
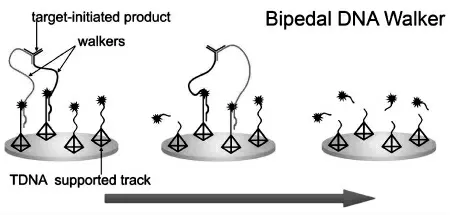
图3 基于双足DNA 步行器的电化学基因传感器的构建示意图Fig.3 Illustration of the bipedal DNA walker based electrochemical genosensor.Copyright 2019 ACS
当DNA 步行器的行走链增加时, 可以增加与轨道链的作用位点,提高反应速率。 因此,多足DNA 步行器的研究成为趋势。 目前,已经报道的多足DNA 步行器主要有三足型、 四足型以及球型等。 如图4 所示,Li 等[11]设计了一种四足DNA步行器,它有4 条行走链,在目标蛋白链霉亲和素(SA)存在下,生物素修饰的行走链与固定在金属上的发卡发生催化发卡自组装-H1(MB-CHAH1)相互作用进而打开发夹结构。 此外,Zhang等[12]将DNA 行走链和DNA 轨道链分别固定在金纳米颗粒上,形成球型DNA 步行器。 在目标物的作用下, 球型DNA 步行器的行走链被激活并与球型轨道链杂交,在酶的作用下,轨道链被切割,同时,相邻的行走链可以与下一条轨道链结合(图5)。该球型DNA 步行器以寨卡病毒核糖核酸片段为模型, 构建的传感器具有灵敏度高、特异性强和回收率高的优点。 多足DNA 步行器的行走链可以与轨道链协同结合,使得行走链稳定不易脱轨,实现信号的多重累积。
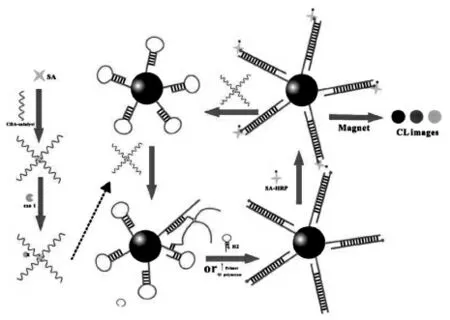
图4 基于等温链置换聚合酶链反应的DNA 步行器对亲和素灵敏检测的原理示意图Fig.4 A schematic illustration of the principle for the sensitive detection of SA based on an ISDPR-DNA walker.Copyright 2018 ACS
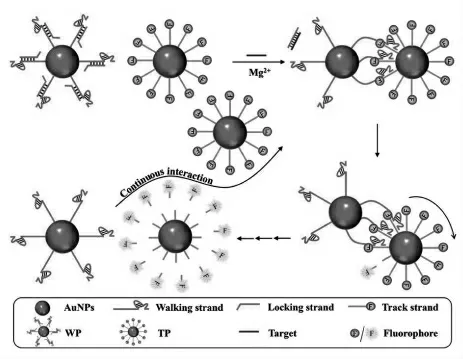
图5 目标物引发的粒子间相对运动的DNA 步行器示意图Fig.5 Schematic illustration of the interparticle relatively motional DNA walker triggered by the target.Copyright 2020 RCS
1.2 轨道链
DNA 步行器的设计要求轨道链与行走链牢固地结合,同时轨道链通常还担任电化学或光学信号的输出功能。 根据行走链的运动方式和运动范围,轨道链的类型大致可分为一维直线、二维平面和三维球型核酸轨道。 Zhang 等[13]将二维平面轨道链介导的分子信标在内切酶的辅助下实现了对细胞因子干扰素-γ 的灵敏检测(图6)。干扰素-γ 可以与DNA 双链上的适配子结合从而激活行走链,在内切酶的辅助下,触发轨道链离开电极表面打开分子信标2 从而实现对目标物的检测。 由于三维球型核酸轨道拥有更多与行走链结合的位点,因而引起了研究者广泛的兴趣。 Luo等[14]将磁性分离技术和球型核酸轨道DNA 步行器扩增技术相结合,构建了一种灵敏的电化学生物传感器实现了对人类免疫缺陷病毒脱氧核糖核酸的检测。 如图7 所示,通过将大量的轨道链固载在磁性纳米颗粒上形成球型核酸轨道,一方面可以提高轨道链的固载量,提供大量可以和行走链结合的位点,提高反应速率。 另一方面可以从复杂的样品中特异地捕获和分离目标,大大提高检测灵敏度。 与二维的轨道链相比,将所有的DNA 轨道链结合在一个球型的纳米颗粒表面,可以提高DNA 轨道链的固载密度, 从而加快催化反应的速度。但是轨道链固定是随机的。因此,准确定量的设计DNA 轨道链可以有效地提高DNA的行走效率。
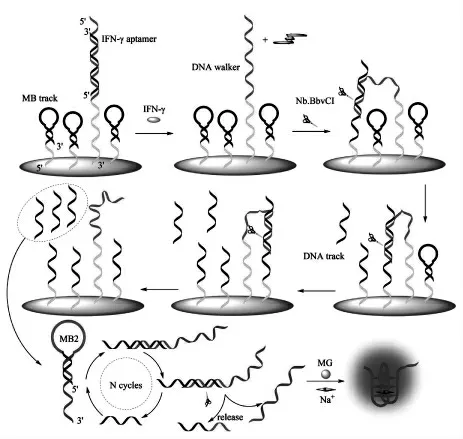
图6 DNA 步行器和内切酶辅助信号放大的生物传感器用于干扰素-γ 的快速灵敏检测Fig.6 Schematic diagram showing the principle of DNA walker and nicking enzyme assisted signal amplification method based biosensor for simple and ultrasensitive detection of IFN-γ.Copyright 2018 Elsevier
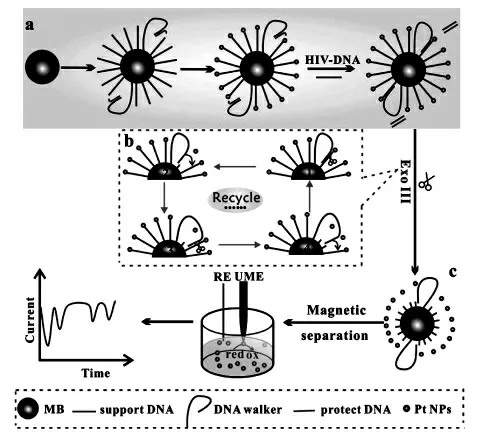
图7 DNA 步行器和磁性分离放大的电化学生物传感器的构建Fig.7 Illustration of the DNA walker and the magnetic separation-amplified single-particle electrochemical biosensor.Copyright 2021 ACS
1.3 驱动力
通常DNA 步行器的行走需要外界的一些驱动力,比如,酶,光照,化学反应或者核酸单元等。当目标物存在时,初始平衡可以从热力学或动力学上向一个方向倾斜,反应体系从高能级转变为低能级。 驱动力的类型通常由目标物质的性质决定。 DNA 步行器通常是由核酸内切酶、核酸外切酶和脱氧核酸酶等推动DNA 行走链沿着轨道链行走。 由于酶参与的反应对环境要求较高,因此,熵驱动扩增作为一种无酶参与的反应在生物分析中显示出独特的优势。 如图8 所示,Yang 等[15]报道了一种熵驱动的DNA 步行器放大策略。 该生物传感器的界面由三条链在金电极上自组装而成,两个不同功能的适配体与不同的目标凝血酶的位点结合, 邻位触及引发固定在三链DNA复合物中的一个短链DNA 的链置换, 从而暴露出一个预先锁定的结构域, 与亚甲基蓝标记的DNA 链 (MB-DNA) 杂交。 随后,MB-DNA 的toehold-介导的链置换导致适体/蛋白质复合物的释放和回收。 最终,大量的MB-DNA 链被传感器的表面捕获,对凝血酶产生显著放大的电化学反应。 熵驱动扩增具有简单、非机械化的特点,克服了有酶介导的反应对环境要求高的缺点。
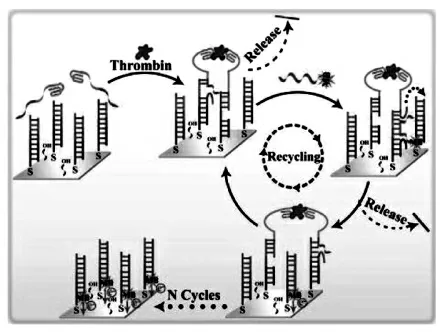
图8 熵驱动的DNA 步行器测定凝血酶的原理图Fig.8 Schematic diagram of entropy-driven DNA walkers for thrombin determination.Copyright 2017 ACS
2 DNA 步行器在生物分析中的应用
DNA 步行器以其快速的行走动力学和灵敏的处理速度有利于在一定时间内获得较高的信号增益。 因此,DNA 步行器被认为是一种理想的信号转导和放大工具, 特别是与DNA 扩增反应包括催化发夹自组装,链置换反应,滚环扩增反应,酶反应以及多种反应策略相结合在生物分析中引起了广泛的关注。 接下来主要从按照不同检测对象,如DNA、microRNA、蛋白质、霉菌毒素和细胞检测等方面展开介绍。
2.1 DNA 步行器在DNA 检测方面的应用
DNA 步行器作为一种理想的信号传导和放大工具,可适用于特定DNA 的检测。 Tao 等[16]研制了一个基于DNA 步行器和目标物引发的催化发夹自组装的模块化生物传感平台并用于乙型肝炎病毒(HBV)核酸的检测,检测范围为0.5~50 nmol/L。 此外,Zheng 等[17]开发了一种将DNA 滚环扩增(RCA)反应和DNA 步行器相结合的生物传感器,并用于人类免疫缺陷病毒(HIV)核酸的检测。 该生物传感器具有较高的选择性和灵敏性,能够在实际样品中检测目标DNA,在生物学研究和临床应用上表现出诱人的前景。 该方法在生物研究和临床诊断中具有广阔的应用前景。 此外, 基于DNA 步行器的生物传感器也被应用于突变基因的检测,如图9 所示,Wu 等[18]构建了DNA 步行器结合滚环级联放大纳米机器实现了对肿瘤相关基因p53 的超灵敏检测,该生物传感器在人血中p53 基因的准确检测中具有实用价值。DNA 步行器较早应用于DNA 传感方面,但对病毒和细菌等特异性DNA 的检测还有待进一步研究。
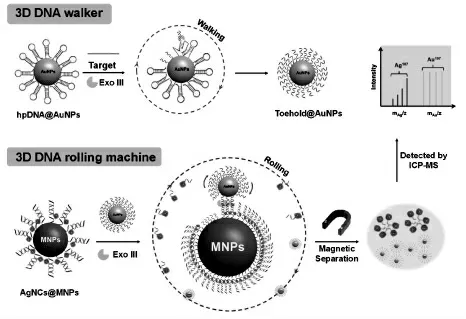
图9 三维DNA 步行器与三维DNA 滚环机器结合的级联扩增策略示意图Fig.9 Schematic illustration of the cascade amplification strategy of a 3D DNA walker coupled with a 3D DNA rolling machine.Copyright 2020 ACS
2.2 DNA 步行器在microRNA 分析中的应用
MicroRNAs 作为转录后调节因子的非编码短小RNA。 它们的核酸序列有很高的相似性,但在细胞中的表达水平很高, 这增加了检测的难度。因此,提高microRNA 的检测灵敏度具有重要意义。 已经有许多文献报道了基于DNA 步行器的生物传感器,他们在检测microRNAs 方面表现出了良好的选择性、 灵敏度和重复性等优异性能。 Liu 等[19]采用多环芳烃作为电化学发光体(DPA NBs),Pt-Ag 合金纳米花为共反应促进剂结合单足DNA 步行器构建了一个新型的ECL“off-on”开关的生物传感器(图10)。 锁住的DNA行走链和修饰有猝灭探针的DNA 轨道链同时固定在电极界面上,使得初始的ECL 信号处于“信号关闭”状态。 在目标物microRNA 141(miRNA-141)和核酸外切酶T7 存在下,激活DNA 行走链与DNA 轨道链杂交, 猝灭探针离开电极界面恢复强烈的ECL 信号,使其处于“信号开启”状态。此基于DNA 步行器的生物传感器对miRNA-141的检测下限可达29.5 amol/L。 最近,我们采用了四-(4-氨基苯)乙烯(TAPE)调控的苝微晶作为新型ECL 发光材料, 结合行走链的位置可控的DNA 步行器实现了对microRNA let-7a 的灵敏检测[20]。该工作中提出的位置可控的策略能够增加反应效率和提高DNA 步行器在行走中的动力学,这为临床生物分析中生物分子的灵敏检测提供新的思路(图11)。 与电化学发光传感器相比,由于荧光传感器可以实现均相检测, 因此用于microRNA 检测的荧光传感器也迅速涌现。 Yang等[21]巧妙地设计了Janus 三维DNA 纳米机器用于同时灵敏地检测两种不同的microRNA。 它可以有效地消除由于两个不同的信号探针接近时导致的信号干扰, 提高了对microRNA 的检测灵敏度。
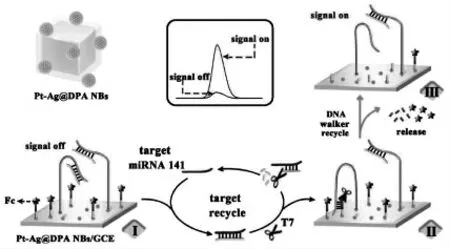
图10 基于一步法DNA 步行器放大的生物传感器对miRNA-141 的检测示意图Fig.10 Ultrasensitive detection of miRNA-141 based on the one-step DNA walker amplification.Copyright 2018 ACS
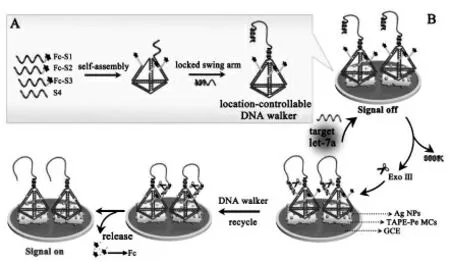
图11 位置可控的DNA 步行器的制备(A)及对microRNA let-7a 的检测示意图(B)Fig.11 Schematic illustration of the location-controllable DNA walker fabrication(A),the operating principle of the biosensor based on the location-controllable DNA walker for let-7a determination.Copyright 2021 ACS
2.3 DNA 步行器在蛋白质分析中的应用
快速、 灵敏地检测与临床相关的蛋白质,如一些生物标志物等,在疾病的早期诊断中起着至关重要的作用。 由于缺乏核酸扩增类似的蛋白质扩增技术,低丰度蛋白质的分析仍然面临着巨大的挑战。DNA 步行器在行走的过程中具有信号累积放大的优势,为实现蛋白质的灵敏检测提供了有效的途径。 Chen 等[22]提出了基于蛋白质结合诱导的邻近识别和聚合酶驱动的DNA 步行器策略,用于蛋白质的灵敏检测。 如图12 所示,设计两个DNA 探针分别固定在电极上和作为DNA行走链。 蛋白质与这两个探针上标记的识别元件的结合带来了它们的邻近杂交, 在DNA 聚合酶存在下, 标记有探针的Fc-P3 发生DNA 聚合,DNA 行走链释放,继而与相邻的固定化探针上进行杂交,再进行聚合酶驱动的DNA 步行器操作。实现了对蛋白质的灵敏识别和选择性检测,对地高辛抗体检测限为80 pmol/L。 因此,该研究为基于DNA 步行器检测蛋白质提供了一种简单、通用和一步放大的的电化学发光方法。 核糖核酸酶H(RNase H)是一种细胞内核糖核酸酶,在细胞过程中起着至关重要的作用,尤其与许多疾病过程有关。 Wang 等[23]提出了一种新的基于RNaseH驱动的DNA 步行机的信号放大策略, 用于特异和灵敏的RNaseH 活性检测。 该方法已成功地用于复杂环境中RNaseH 活性的检测和相关抑制剂的筛选。 因此,RNaseH 驱动的DNA 步行器为RNaseH 活性检测提供了一个新的平台。
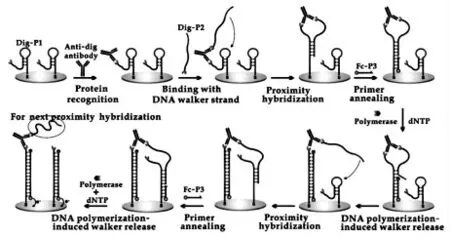
图12 基于DNA 步行器的生物传感器对抗地高辛抗体检测原理示意图Fig.12 Schematic diagram of the DNA walkers based biosensor for anti-dig antibody.Copyright 2019 Elsevier
2.4 DNA 步行器在霉菌毒素分析中的应用
霉菌毒素是真菌界生物产生的一种有毒次生代谢物。 它可以污染各种食物,导致食物急性中毒,严重的将导致肝癌的发生。 将DNA 步行器引入到生物传感器的构建中,适合于真菌毒素的快速、灵敏分析。 通常霉菌毒素的检测是利用相应的适体作为分子识别元件,可以将霉菌毒素分析转化为相应核酸检测。赭曲霉毒素A 是毒性最大、分布最广、产毒量最高、对农产品的污染最重、与人类健康关系最为密切,是继黄曲霉毒素后又一个引起世界广泛关注的霉菌毒素。如图13所示,Zhong 等[24]设计了多位点锚定的DNA 步行器应用于赭曲霉毒素A 的检测。在目标物的存在下可以完成转换形成球型DNA 步行器。 多位点锚定的DNA 步行器可以实现高的局部浓度,提高了反应速率,为赭曲霉毒素A 的检测提供了新的方向。 此外,Zhou 等[25]设计了一种基于滚环扩增辅助放大的多足DNA 步行器, 用于铜绿假单胞菌的检测。 基于DNA 步行器构建的传感器可以实现对霉菌毒素的灵敏检测, 在食品安全、环境检测和疾病诊断等方面具有广阔的应用前景。
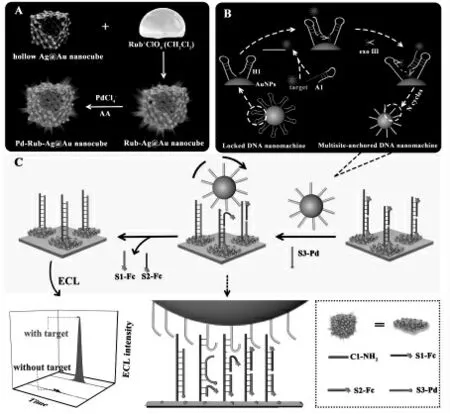
图13 DNA 步行器对赭曲霉毒素A 的检测示意图Fig.13 Schematic illustration of the OTA-induced multisite-anchored DNA nanomachines based biosensor.Copyright 2021 ACS
2.5 DNA 步行器在细胞分析中的应用
DNA 步行器除了用于DNA、microRNAs、蛋白质和真菌毒素的检测外,具有强大富集信号能力的DNA 步行器同样适用于细胞分析。 Miao等[26]提出了一种基于金纳米粒子的多足DNA 步行器用于循环肿瘤细胞的检测。 淀粉样多肽寡聚物(AβO)被广泛认为是诊断阿尔茨海默病的最有前途的生物标志物。 Yin 等[27]设计了一种三维DNA 步行器,用于在癌细胞中AβO 的检测。该策略具有灵敏度高、特异性高、使用方便等优点,为阿尔茨海默病的早期诊断提供了广阔的前景。 此外,Peng 等[28]报道了将整个DNA 步行器构建在一个20 nm 的金纳米颗粒(AuNP)上,上面修饰有数百条底物链作为轨道链,以及几十个被锁住保持沉默的DNA 酶分子(图14)。该DNA 步行器与细胞内的目标物相互作用, 激活了DNA 酶分子开始在AuNP 上的自主行走。 基于DNA 步行器的信号放大原理能够检测单个癌细胞中特定的microRNAs。 DNA 步行器为癌细胞的检测提供了强有力的工具。 但是进一步扩大DNA 步行器对临床样本的检测仍然有许多问题需要解决,如DNA 步行器对复杂样品的高选择性,高浓度的细胞或血清蛋白可能会阻碍DNA 步行器的行走等。
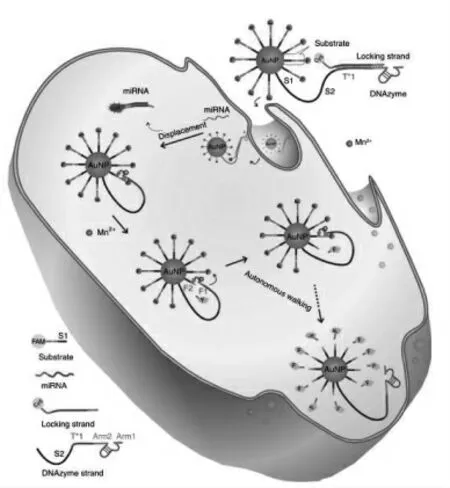
图14 DNA 步行器对活细胞中特定microRNAs 的检测示意图Fig.14 Schematic diagram of the DNA walkers for the detection of the specific miRNA.Copyright 2017 Springer Nature
3 总结
DNA 步行器具有结构可控及整合行走过程中的信号等优点,在生命分析领域具有良好的应用前景。但是,DNA 步行器未来还有很多地方需要改进。比如,DNA 步行器检测目标单一, 难以适用于复杂生物环境分析。 此外,生物体内各种核酸酶也会对DNA 步行器的检测造成干扰。总之,DNA 步行器的研究虽然取得了较大的进展,但是要克服上述难题还需要科研工作者们不懈的努力。

