丙泊酚对骨肉瘤细胞的影响及机制研究
张熙 王东伟 曾凡荣 刘爽 马雷 于祥菊
骨肉瘤是好发于儿童和青少年的骨恶性肿瘤,其特征是骨肿瘤细胞增殖产生类骨样或未成熟骨基质[1]。目前治疗措施包括根治性保肢手术,术前新辅助化疗,术后多药联合化疗[2]。骨肉瘤的治疗和检查都需要采用外科手术,如活检、病理切片和肿瘤切除等,而这些手术通常需要选用全身麻醉。研究表明,麻醉技术改变了分子环境可能会影响到癌细胞的功能,这可能是由于麻醉剂和阿片类药物对疼痛的影响所导致[3]。据报道,麻醉会损伤人体免疫反应,在手术刺激下使癌细胞更易扩散到周围组织和循环内[4]。由此可见,癌细胞的浸润和转移更易发生在外科手术期间。各种麻醉药物用于癌症切除手术中,然而许多麻醉药物对肿瘤的影响仍不清楚。因此,研究麻醉药物对肿瘤的影响对肿瘤治疗,减少肿瘤转移和复发率尤为重要。丙泊酚是一种广泛而常用的静脉麻醉药物。最近,越来越多的证据表明丙泊酚能够在体内和体外影响肿瘤细胞的增殖、扩散和迁移[5,6]。因此,丙泊酚可能成为一种针对肿瘤手术较好的麻醉药物[7]。然而,丙泊酚对骨肉瘤细胞的影响及其机制却鲜有报道。本研究将探寻丙泊酚对人骨肉瘤细胞的影响及其分子机制。
1 材料与方法
1.1 细胞培养 人骨肉瘤U2OS细胞购于北纳创联生物公司。U2OS细胞37℃快速复苏后,于McCoy’s 5A培养基(含10%胎牛血清)重悬后,置于37℃、5% CO2培养箱中培养,细胞达90%时,0.25%胰酶消化传代。细胞传至4~5代后用于后续实验。
1.2 实验分组及处理 用DMSO将丙泊酚稀释配制成1 μg/μl的丙泊酚溶液。按随机数字法,分为4组。D组:在4 ml McCoy’s 5A培养基(含10%胎牛血清)中加入DMSO 4μl;P5组:将配制好的丙泊酚溶液20 μl 加入McCoy’s 5A培养基(含10%胎牛血清)中(培养基中丙泊酚浓度为5 μg/ml);P10组:将配制好的丙泊酚溶液40 μl加入McCoy’s 5A培养基(含10%胎牛血清)中(培养基中丙泊酚浓度为10 μg/ml);P20组:将配制好的丙泊酚溶液80 μl加入McCoy’s 5A培养基(含10%胎牛血清)中(培养基中丙泊酚浓度为20 μg/ml)。取对数生长期U2OS细胞按不同分组加入培养基中,置于37℃、5% CO2培养箱中进行后续实验。
1.3 MTT法检测细胞增殖 人骨肉瘤U2OS细胞加入96孔板中,培养达到对数生长期时按不同分组加入各浓度丙泊酚,每组设3个复孔。置于37℃、5%CO2培养箱中培养12、24、36 h后,弃去药物,各孔加入100 μl 培养基和10 μl MTT试剂,设置调零孔:无细胞培养基+MTT;对照孔:含细胞培养基+MTT,继续培养4 h。酶标仪测定450 nm吸光度,公式:细胞抑制率(%)= [1-(试验组吸光度-调零组吸光度)/(对照组吸光度-调零组吸光度)]×100% 计算细胞抑制率。
1.4 流式细胞仪检测细胞凋亡 取对数生长期人骨肉瘤U2OS细胞加入6孔培养板,5×105/孔培养24 h后,按分组加入不同浓度丙泊酚处理24 h后收集各组细胞,4℃ PBS洗涤2遍,重悬细胞至1×106/ml。取500 μl细胞悬液,分别加入Annexin-V FITC和PI染液各5 μl,室温避光孵育15 min,流式细胞仪检测,早期凋亡(FITC+,PI-);晚期凋亡和死亡(FITC+,PI+)。
1.5 Western blotting检测蛋白表达 收集各组处理24 h后细胞,PBS液洗3遍后13 000 r/min 离心15 min,弃上清。加入蛋白裂解液、蛋白酶抑制剂(100∶1),4℃静置30 min,13 000 r/min 离心15 min,取上清,BCA法测定蛋白浓度,将样品蛋白和5×样品缓冲液以4∶1 混匀,100℃煮沸10 min,置于-20℃冰箱保存备用。蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电转膜至聚偏二氟乙烯(PVDF)膜(PVDF膜甲醇浸泡激活),37℃封闭1 h,加一抗,4℃过夜。TBST洗膜5 min/3次,加入辣根过氧化物酶标记二抗(1∶5 000),室温下孵育1 h,TBST洗膜3次/5 min。以β-肌动蛋白(β-actin)为内参。化学发光试剂ECL显影,曝光。采用光密度扫描仪计算积分光密度,取与β-actin的比值反映蛋白的相对表达量。
1.6 ROS检测 取对数生长期人骨肉瘤U2OS细胞加入6孔培养板,5×105/孔培养24 h后,按分组加入不同浓度丙泊酚处理24 h后收集各组细胞待测,按1∶500的比例用无血清培养液稀释DCFH-DA,终浓度为20 μmol/L。将收集好的细胞悬浮于稀释好的DCFH-DA中,细胞密度约1×106个。37℃细胞培养箱内避光孵育60 min。1 000 r/min离心5 min收集细胞,PBS洗涤2遍,PBS重悬细胞。荧光酶标仪测定荧光强度,488 nm激发波长,525 nm发射波长,测定结果以荧光强度/毫克蛋白表示。

2 结果
2.1 丙泊酚对人骨肉瘤细胞增殖的影响 不同浓度(5 μg/ml;10 μg/ml;20 μg/ml)分别作用于U2OS细胞12 h,24 h,36 h后,用MTT法检测丙泊酚对细胞的增殖抑制率。结果显示,D组生长抑制率分别为(40.8±0.5)%、(47.0±0.5)%、(47.2±0.4)%;P5组生长抑制率分别为(46.9±0.6)%、(61.5±0.4)%、(68.5±0.3)%;P10组生长抑制率分别为(61.2±0.2)%、(71.4±0.5)%、(79.1±0.2)%;P20组生长抑制率为(76.9±0.8)%、(80.7±0.2)%、(88.4±0.1)%。各组生长抑制率比较,差异均有统计学意义(P<0.001,F=581.625)。见图1。
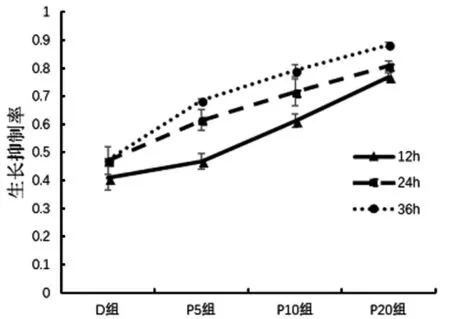
图1 不同浓度丙泊酚对U2OS细胞生长抑制率曲线
2.2 丙泊酚对人骨肉瘤细胞凋亡的影响 为了进一步检测丙泊酚对人骨肉瘤细胞U2OS凋亡的影响,各组U2OS细胞经丙泊酚处理24 h后,流式细胞仪检测显示,DMSO处理后U2OS细胞凋亡率仅为(1.6±0.5)%;5 μg/ml丙泊酚处理组U2OS细胞凋亡率为(11.8±2.4)%;10 μg/ml丙泊酚处理组U2OS细胞凋亡率为(23.3±4.8)%;20 μg/ml丙泊酚处理组U2OS细胞凋亡率为(33.8±3.3)%。4组间凋亡率比较差异均有统计学意义(P<0.01,F=53.386)。可见随着丙泊酚浓度升高,U2OS细胞凋亡不断增高,丙泊酚对U2OS细胞凋亡呈剂量浓度依赖性。见图2。
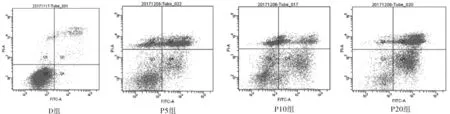
图2 不同浓度丙泊酚对U2OS细胞凋亡率的影响
2.3 丙泊酚对人骨肉瘤细胞凋亡相关蛋白表达的影响 为了进一步确认不同浓度丙泊酚对人骨肉瘤细胞凋亡的机制,western blotting检测了其不同组中凋亡相关蛋白表达情况。结果显示,随着丙泊酚浓度的增加,凋亡通路的Cleaved Caspase-3及其下游Cleaved parp蛋白表达增高,P20组Caspase-3前体蛋白显著减少;凋亡相关蛋白Bax上调,抗凋亡蛋白Bcl-2降低。其与内参蛋白光密度比值差异有统计学意义。见图3,表1。

图3 4组凋亡相关蛋白表达情况
表1 4组凋亡相关蛋白表达情况
2.4 丙泊酚对人骨肉瘤细胞ROS水平的影响 ROS荧光检测结果显示,D组U2OS细胞中ROS表达浓度为121.00±3.61(荧光强度/毫克蛋白);P5组U2OS细胞中ROS表达浓度为169.67±2.08(荧光强度/毫克蛋白);P10组U2OS细胞中ROS表达浓度为287.67±2.52(荧光强度/毫克蛋白);P20组U2OS细胞中ROS表达浓度为294.33±4.16(荧光强度/毫克蛋白);ROS表达水平随丙泊酚浓度增加而增加(P<0.001,F=2187.827)。见图4。

图4 不同浓度丙泊酚处理U2OS细胞后ROS表达水平
3 讨论
细胞凋亡是程序性细胞死亡的过程,通常发生在生长和衰老过程中,是维持生物组织中细胞群内稳态机制[8]。凋亡的进程由外在的死亡受体途径以及内在的线粒体介导凋亡通路启动[9],癌症细胞的致癌作用和发病机理与这两条凋亡通路的缺失有关[10]。细胞凋亡主要由半胱氨酸蛋白酶(Caspase)级联和Bcl-2家族蛋白调控[11]。
Caspase是凋亡信号转导的一种特殊蛋白质,它的活化是细胞凋亡机制的关键环节之一。其中Capase-3是凋亡通路下游的最关键执行者,Caspase-3被切割后将其下游的PARP切割成羧基端的催化结构域(89 kD)和氨基端的DNA结合结构域(24 kD),PARP失去其酶活性使细胞不稳定,最终导致DNA断裂,参与凋亡途径的最后阶段。研究发现,药物及射线等抗肿瘤治疗通过Caspase依赖途径导致骨肉瘤细胞凋亡[12]。在临床麻醉中,全身麻醉的靶向血浆丙泊酚浓度为 3~8 μg/ml[13]。本研究中随着丙泊酚浓度的增高,人骨肉瘤U2OS细胞活性减小,丙泊酚对U2OS细胞的抑制呈时间、剂量依赖性。并且western blotting的结果也显示Cleaved Caspase-3和Cleaved PARP蛋白表达的升高,以及20 μg/ml丙泊酚处理组的前体Caspase-3的显著降低,表明丙泊酚使U2OS细胞发生了凋亡。
Bcl-2蛋白家族通过控制线粒体膜通透性,在调节内在凋亡途径方面起着重要的作用。Bcl-2家族中促凋亡蛋白(Bid、tBid、Bax等)和抗凋亡蛋白(Bcl-2、Bcl-xL、Mcl-1 等)相互作用调控线粒体膜结构和功能的稳定性[14]。而Bax/Bcl-2的比值是线粒体凋亡机制中的重要指标[15],Bax/Bcl-2比值增高会持续开放线粒体外膜的膜渗透孔,释放细胞色素C进入细胞质,参与细胞进入线粒体凋亡通路的初始执行阶段[16]。有研究发现,丙泊酚抑制人骨肉瘤MG63细胞的侵袭,并诱导细胞凋亡[17]。但对其细胞凋亡途径尚未见具体报道。本研究中Bax蛋白表达随丙泊酚浓度剂量依赖性增高,Bcl-2蛋白表达降低,这意味着丙泊酚对U2OS细胞的抑制可能是通过其内在的线粒体凋亡途径产生。
众所周知,氧化应激反应尤其是活性氧自由基(ROS)聚集导致细胞凋亡在抗癌机制中起着至关重要的作用[18]。ROS直接或通过各种信号途径使细胞内脂类、蛋白质及DNA等被氧化,尤其是线粒体蛋白遭受损害,引起细胞损伤[19]。丙泊酚由于其酚羟基与内源性抗氧化剂维生素E结构上类似,被认为有一定的抗氧化应激作用,然而其本身又可介导细胞损伤。在其引起U2OS细胞凋亡机制中本研究继续观察了其细胞内ROS水平,发现其随着丙泊酚浓度的增加其ROS水平增加,表明丙泊酚对U2OS的凋亡作用与ROS的积聚及其氧化损伤机制有关,这也与一些研究中丙泊酚通过氧化应激介导细胞损伤的结果[20]一致。因此,丙泊酚通过ROS积聚引起的氧化应激导致了U2OS细胞凋亡。
虽然,本研究仅研究了丙泊酚对U2OS细胞的影响,其细胞种类较单一,培养环境与临床研究仍有一定的差异。但研究发现了丙泊酚呈剂量依赖性导致U2OS细胞凋亡,并深入研究了其通过ROS增多的线粒体凋亡机制,为骨肉瘤手术治疗的麻醉药物选择提供了一定的基础研究依据。因此,更多的骨肉瘤细胞种属以及动物研究及其更加深入的机制有待进一步研究。

