B细胞异位基因2在子宫内膜癌中的表达及意义
史丽 马静 赵喜娃 关英霞 孙亚平 赵连梅 单保恩
子宫内膜癌在女性生殖道恶性肿瘤中所占比例高达20%~30%,通常早期子宫内膜癌临床预后较好,一旦发生转移和复发,无论何种病理类型及分期均会导致较差的预后[1]。近年来,子宫内膜癌的发病率在世界范围内呈上升趋势[2],因此,探索有效的肿瘤标志物对子宫内膜癌早期诊断及制定治疗方案有重要的意义。B细胞异位基因2(B-cell translocation gene 2,BTG2)是 BTG/TOB 蛋白家族中的六位成员之一[3],该家族成员能够调节肿瘤细胞的增殖、分化及凋亡[3,4]。一项研究结果显示,在恶性肿瘤中BTG2存在表达失调,在一系列恶性肿瘤中具有抑癌作用,BTG2 是一个瞬时早期反应基因,有参与基因转录、转录后调控、调节细胞分化、细胞周期及凋亡以及综合性应激反应等生物学行为,可以用作各种癌症的预后生物标志物[5]。但是,BTG2在子宫内膜癌中的表达、作用的关系以及能否作为预后指标还不清楚。因此,本研究采用qRT-PCR、Western-blot以及免疫组化方法检测BTG2在子宫内膜癌组织中的基因及蛋白水平表达情况,并分析其表达水平与临床病理特征的相关性。
1 资料与方法
1.1 一般资料 选取2018年1~12月在河北医科大学第四医院妇科行手术治疗的子宫内膜癌患者40例,年龄(55±8)岁,选取癌组织和癌旁组织分为癌组和癌旁组。癌旁取材标准为距离肿瘤边缘3 cm,并经病理证实为非癌组织,将所取新鲜组织立即在液氮中冷冻,并储存在-80℃。另选取2016年1月至2017年12月子宫内膜癌患者(试验组)内膜癌组织标本98例,年龄(54±9)岁,根据 2009 年国际妇产科联盟分期(FIGO2009),Ⅰ、Ⅱ期 58例,Ⅲ、Ⅳ期 40例;组织病理类型为子宫内膜样腺癌 76 例,非子宫内膜样腺癌22例(浆液性腺癌16例、透明细胞癌4例、未分化癌2例)。 选择同期因良性病变行子宫切除或内膜切除且病理检查证实子宫内膜良性病变的组织标本 80例(对照组),年龄(52±10)岁,2组患者一般资料有可比性(P>0.05)。所有子宫内膜癌患者术前未接受放疗、化疗和激素治疗,患者及其家属均签署了知情同意书,该研究获得了河北医科大学第四医院的伦理学批准。
1.2 材料与试剂 Trizol试剂和PCR引物购自美国Invitrogen公司,逆转录试剂盒和BCA 蛋白定量检测试剂盒购自美国 Thermo公司,GAPDH 抗体购自美国 Proteintech公司。
1.3 荧光实时定量 PCR(Real-Time Quantitative PCR,RT-PCR)检测组织中mBTG2的相对表达水平。 用 TRIzol 试剂提取组织中总RNA,紫外分光光度计检测其浓度。 按逆转录试剂盒说明进行逆转录反应,在20 μl体系中加 3 μg总RNA 进行 cDNA 合成。 根据RT-PCR 试剂盒说明书,以合成的 cDNA 为模版,加入反应试剂,进行 PCR 反应,以GAPDH基因作为内参照。Primer Premier 5软件设计BTG2引物,BTG2上游为 5’-CATCATCAGCAGGGTGGC-3’,下游为 5’-CCCAATGCGGTAGGACAC-3’,扩增片段大小为122 bp;GAPDH内参的上游引物为5’-GCTTCGGCAGCACATATACTAAAAT-3’,下游引物5’-CAGTGCGTGTCGTGGAGT-3’,扩增片段大小为119 bp。根据实验所获Ct值对BTG2进行相对定量,用比较Ct值法(2-ΔCt)进行分析(ΔCt=CT BTG2-CT GAPDH)。
1.4 Western-blot方法检测组织中BTG2的蛋白表达水平 将癌组组和癌旁组各组织应用RIPA 裂解液提取各组组织中的总蛋白质。BCA 法进行蛋白质定量。具体步骤为:配制SDS-PAGE的凝胶,将蛋白变性后的上清,分别加入浓缩胶的上样孔中;取4 μl蛋白marker加于上样孔。4℃条件下,恒压90 V,电泳缓冲液中泳动3 h,根据蛋白分子量不同进行分离。根据目的蛋白大小将分离的蛋白区带凝胶切下,置于转膜缓冲液中浸泡,PVDF膜先在甲醇中浸泡3 min,再放入转膜缓冲液中平衡5 min。将PVDF膜平铺在凝胶上,PVDF膜和凝胶两侧各放三层滤纸,凝胶在负极,PVDF膜在正极,放入电转仪中,4℃条件下进行印记电泳(300 mA,1.5 h)。 取出PVDF膜,用5%脱脂奶粉37℃封闭1 h。TBST洗膜10 min×3次,加入TBST稀释的相应的一抗,4℃孵育过夜。TBST洗膜10 min×3次,加入TBST稀释的红外荧光标记的二抗,37℃反应1 h,注意避光。 TBST洗膜10 min×3次(避光),用Odyssey双色红外荧光扫描系统进行成像并分析。
1.5 应用免疫组织化学方法 脱蜡:石蜡切片标记后,二甲苯脱蜡,梯度乙醇水化,蒸馏水震荡冲洗。封酶并抗原修复,稀释BTG2抗体:用PBS将一抗稀释至所需的浓度(1∶50);血清封闭并滴加一抗过夜,次日取出放入37℃恒温箱中孵育50 min,取出组织切片用PBS清洗3次(震荡),每次5 min;滴加二抗(pv6001):在每个组织块上加入50 μl左右的二抗并DAB显色并苏木素复染,脱水封片并显微镜镜检,图像采集分析。将实验结果分为低表达组:弱表达(+)和中表达(++);高表达组,强表达(+++)。

2 结果
2.1 癌组及癌旁组BTG2的mRNA的相对表达水平 应用RT-PCR方法检测2组BTG2的mRNA的相对表达水平,癌组及癌旁组分别为(0.24±0.13)、(0.51±0.22),子宫内膜癌组BTG2的相对表达量明显低于癌旁组,差异有统计学意义(P<0.01)。
2.2 癌组及癌旁组BTG2蛋白的相对表达水平 应用Western-blot方法检测2组BTG2蛋白表达水平,癌组和癌旁组的相对表达水平分别为(0.99±0.08)、(2.16±0.12),癌组BTG2 蛋白相对表达量明显低于癌旁组,差异有统计学意义(P<0.01)。见图1。
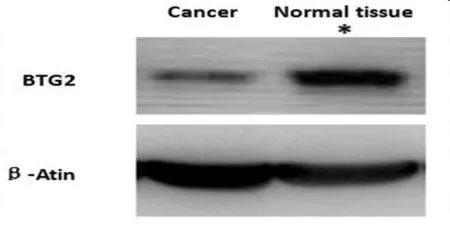
图1 癌组及癌旁组BTG2蛋白的相对表达水平
2.3 子宫内膜癌和内膜良性病变组织中 BTG2的蛋白表达水平 应用免疫组织化学检测BTG2在子宫内膜组织中表达情况显示BTG2在子宫内膜细胞核和细胞质中均有表达。试验组:低表达78例(79.6%),高表达20例(20.4%);对照组:低表达24例(30.0%),高表达56例(70.0%),2组比较差异有统计学意义(P<0.01)。结果表明在子宫内膜癌组织中BTG2的蛋白表达水平明显低于子宫内膜良性病变组织。见图2,表1。
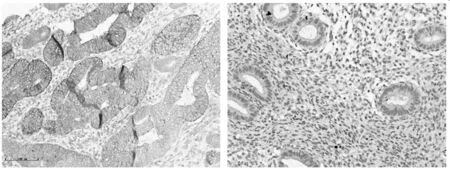
子宫内膜良性病变组织子宫内膜癌组织

表1 不同子宫内膜病变组织中BTG2蛋白表达 例(%)
2.4 子宫内膜癌组织中 BTG2 的表达水平与临床病理特征的关系 BTG2 表达水平与临床分期、组织分级、淋巴血管浸润、淋巴转移相关:临床期别越高,BTG2的表达水平越低;病理分级越高BTG2的表达水平越低;存在血管、淋巴管浸润的BTG2的表达水平降低;存在淋巴结转移的BTG2的表达水平降低;BTG2 表达水平与年龄、肌层浸润深度、组织类型无关。见表2。

表2 子宫内膜癌组织中BTG2蛋白表达与不同临床病理特征的关系 例(%)
3 讨论
子宫内膜癌是女性生殖系统常见的恶性肿瘤之一。近年来对于子宫内膜癌的病因学研究屡见报道,如PTEN基因突变和丢失、DNA错配导致的微卫星不稳定等[6,7];除了针对基因的研究,调节基因的变化和多位点调节也是目前研究的热点,如长链非编码基因、microRNA等[8]。BTG2 是于 1996 年 被 Rouault 等[9]发现,其基因位于1q32,仅由两个外显子组成。BTG2在细胞核和细胞质中均有表达,可以在人体肾脏,肺,前列腺,胰腺,胸腺等器官中检测到BTG2[10]。有研究表明,BTG2 是一个瞬时早期反应基因,有参与基因转录、转录后调控、调节细胞分化、细胞周期及凋亡以及综合性应激反应等生物学行为[11,12]。有研究显示,BTG2是肿瘤抑制基因,BTG2的mRNA表达受microRNAs.调控,比如在BTG2的mRNA的3’非翻译区发现多达17个miRNA结合位点参与BTG2的转录调控[13]。BTG2在乳腺癌、前列腺癌、肝癌、卵巢癌[14-17]等多个器官的实体瘤中均呈现低表达。本研究通过应用免疫组织化学方法发现BTG2在子宫内膜组织中的细胞核和细胞质中均有表达,癌组织中表达水平较子宫内膜良性病变组织明显减少,应用RT-PCR、Western-blot相对定量检测同样发现了BTG2在子宫内膜癌组织中的基因以及蛋白表达水平均低于癌旁或子宫内膜良性病变组织,BTG2在内膜癌组织中呈现低表达,提示了BTG2可能参与了抑制子宫内膜癌疾病进展的过程。
多项既往研究结果显示,BTG2通过相应的分子机制在实体肿瘤组织中呈现出低表达水平,并且BTG2低表达与临床病理特征相关[18]。如在前列腺癌中,BTG2是miR-32,miR-21的靶标,通过后者的抑制作用导致BTG2低表达,低水平BTG2会导致疾病的发生、发展、治疗耐药性和转移等[15];在乳腺癌中,通过细胞周期蛋白D1高表达/AKT磷酸化升高从而下调BTG2,并且低水平的BTG2与肿瘤等级、疾病进展和低总生存率相关[16];肝癌中,通过细胞周期蛋白D1 /细胞周期蛋白E的升高下调BTG2水平,并且低表达的BTG2水平导致肿瘤等级增加并与临床病理的分化程度、是否肝硬化、癌栓、转移情况及总生存期具有明显相关性[17]。既往研究发现microRNA参与调控了子宫内膜癌中癌基因或抑癌基因的表达并在疾病发展及治疗中发挥一定的作用[19-21],本课题组在既往研究中发现,子宫内膜癌组织中高表达miR-25-3p有可能参与调节子宫内膜癌组织中BTG2的表达[22]。本研究结果表明BTG2呈现低表达并与子宫内膜癌临床病理之间的存在一定的相关性,其中病例组中FIGOⅠ、Ⅱ期 和Ⅲ、Ⅳ期 相比BTG2表达具有差异性,临床期别越高BTG2的表达水平越低;病理分级越高BTG2的表达水平越低;存在血管、淋巴管浸润的BTG2的表达水平降低;存在淋巴结转移的BTG2的表达水平降低,上述结果均表明BTG2的低表达可能与子宫内膜癌的的发生发展密切相关,有可能成为内膜癌疾病基因靶向治疗的节点。
综上所述,BTG2在子宫内膜癌组织异常低表达并临床病理分期、分级、淋巴管血管浸润、淋巴结转移相关。我们推测BTG2可能抑制了子宫内膜癌的发生发展,有望成为子宫内膜癌的一个新的治疗靶点及病情监测指标,这与其它相关研究结果一致。但是,BTG2在子宫内膜癌发病中的具体作用机制尚未明确,这点将是我们课题组下一步研究的重点。

