高氯酸盐对Al-MnO2纳米铝热剂热性能及燃烧性能的影响
宋佳星,郭 涛,姚 淼,陈嘉琳,丁 文,刘晓峰
(陆军工程大学野战工程学院,江苏 南京 210007)
1 引言
铝热剂作为一种传统的含能材料,其反应物通常由一种燃料单质和氧化物组成,在发生铝热反应时,放出大量的热[1-2]。随着纳米技术的不断发展,纳米铝热剂能够在更短的时间内释放更高的能量,因此受到国内外学者的广泛关注[2-4]。
纳米铝热剂的组成中,纳米级燃料单质的选择主要集中在纳米Al 粉和纳米Si 粉两类[5-6]。由于自然资源储量丰富、能量密度高等特点,纳米Al 粉被广泛应用[4-5]。纳米氧化剂的可选范围则更丰富,主要包括Fe2O3、CuO、MoO3和MnO2等[5-12]。Hu[7]利用模板法制备出具有花粉状特殊结构的Fe2O3,并成功与纳米Al 进行复合,得到具有花粉状结构的纳米Al/Fe2O3铝热剂。Kim[8]在真空和低温条件下,将纳米Al 粉直接包覆在CuO 纳米线上制备得到Al/CuO-nanowire 复合物,实现了燃料与氧化物的直接接触。薛艳[9-10]制备了Al/MoO3纳米复合含能材料,并开展了一系列感度实验。但是,上述研究缺乏对所研究的纳米铝热剂燃烧性能的测试分析。本课题组前期研究发现,当选用MnO2作为氧化剂时,所组成的纳米铝热剂在更低的温度区间内出现放热峰,表现出良好的反应性能[11-12]。此外,在原有的二元组分中添加一些含能增强剂,可以有效提高和改善原有组分的反应性能。SHEN[5]考虑在Al/Fe2O3体系中加入少量高热值的硼(B)粉,得到的含能复合材料具有更低的反应起始温度和更高的热值,但B 粉的燃烧产物流动性差,因此,过量的B 粉反而会阻碍燃烧的持续进行[13]。氟是氧化性最强的元素,有学者将含氟高聚物作为添加剂加入铝热剂体系中,以增强反应热值和燃烧温度,但是,当氟聚物加入铝热剂组分中时,铝热剂整体的流动性变差,严重影响其热量的扩散和火焰的传播[14-15]。高氯酸盐作为氧化剂,易与燃料或还原剂发生氧化还原反应,产生剧烈的燃烧,因此,已广泛应用于火箭推进剂和烟火剂中。Wang[16]选用高氯酸铵(AP)作为含能添加剂,通过静电喷雾法将纳米Al 粉和纳米CuO 粉组装形成凝固的复合微米颗粒,报道了其燃烧压力的变化。然而目前,高氯酸盐作为添加剂对纳米铝热剂体系热性能、燃烧性能的影响则缺乏相关研究。
为此,本研究选用高氯酸钾(KClO4)和高氯酸铵(NH4ClO4)作为添加剂,采用静电喷雾法制备含高氯酸盐的Al-MnO2纳米复合含能材料,研究了高氯酸盐的加入对样品形貌、反应热性能、产物以及燃烧性能的影响,结合实验和分析结果,对两种常见高氯酸盐对Al-MnO2纳米铝热剂体系的热反应过程及燃烧性能有了进一步的认识。
2 实验部分
2.1 试剂与仪器
纳米Al 粉,上海乃欧纳米科技有限公司,纯度>99.9%,平均粒径100 nm;高锰酸钾(KMnO4),上海凌峰化学试剂有限公司,纯度>99.5%;盐酸(HCl),上海凌峰化学试剂有限公司,含量36.0%~38.0%;KMnO4和HCl 用于合成纳米铝热剂中氧化剂组分二氧化锰(MnO2),合成方法为水热反应釜合成法[11-12];高氯酸钾(KClO4)和高氯酸铵(NH4ClO4),国药集团化学试剂有限公司,纯度>99.5%;无水乙醇,分析纯,上海久亿化学试剂有限公司,含量不少于99.7%;实验用水为自制去离子水;所有的试剂均直接使用,未做进一步的处理。
德国NETZSCH 公司TG-DSC 型同步热分析仪,仪器型号STA 449F3,TG 校正/测量范围020/35000 mg,DSC 校正/测量范围020/5000 μV,吹扫气和保护气均为Ar 气,采用刚玉坩埚,温度区间为室温至800 ℃;FIGHT 牌超声波清洗器,仪器型号FD-200,工作电压220 V±10%,功率消耗35/60 W,超声频率43~45 KHz;德国Bruker 公司D8 Advance 型X 射线衍射仪,测量精度:角度重现性±0.02°,Cu 靶,测角仪半径≥200 mm,最小步长0.0001°,角度范围(θ/2θ)为360°,绝对精度(θ/2θ)为±0.005°,单马达驱动,最大扫描速度200°/min;日本Hitachi 公司S-4800 II 型场发射扫描电子显微镜(FE-SEM),放大倍率为20~8×105,最大分辨率为1 nm,加速电压0.5~30 kV;快速电热丝点火实验采用自制设备,利用稳压直流电源对0.1 mm 的镍铬电热丝进行快速加热,电热丝直接作用于15 mg 的样品粉末上;高速摄影,日本Photron 公司,设备型号为FASTCAM SA-Z,每秒拍摄20000 张照片,即每张照片之间的时间间隔为50 μs。
2.2 实验过程
以KClO4-Al-MnO2纳米复合含能材料为例对实验过程进行介绍。根据课题组前期研究,综合考虑纳米Al 粉的有效含量[17],实验分别称取40 mg 纳米Al 粉和60 mg 纳米MnO2,加入无水乙醇后利用超声波清洗器充分超声分散,得到Al-MnO2的分散液;称取43 mg KClO4(KClO4在体系内的质量分数约为30%),在超声条件下溶于去离子水中;将KClO4水溶液倒入Al-MnO2分散液中,继续超声并伴随玻璃棒搅拌,确保充分分散,得到前驱体混合液。将前驱体溶液注入注射器中,在平头金属注射针头与金属箔接收板之间,加载11 kV 的直流高压,利用注射泵将前驱体混合液缓慢推出,速度为4 mL·h-1,待静电喷雾实验结束后,将金属箔接收板上的样品干燥,收集后待测。NH4ClO4-Al-MnO2纳米复合含能材料和对照组Al-MnO2纳米铝热剂的制备方法与上述类似。
此外,为研究纳米MnO2对高氯酸盐热分解的催化作用,分别称取了80 mg 的KClO4和NH4ClO4,利用超声分散法与20 mg 的纳米MnO2混合后,得到KClO4-MnO2混合物和NH4ClO4-MnO2混合物。
3 结果与讨论
3.1 微观形貌分析

图1 样品的SEM 照片Fig.1 SEM images of the prepared samples
利用FE-SEM 观察样品的微观形貌和组分的分布情况,如图1 所示。图1a 是通过水热合成法制备的纳米MnO2的微观形貌,呈纳米棒状,棒长为1~4 μm,棒径约为100 nm,结构特征明显,表面平整,分散性良好,团聚现象不明显;图1b 是Al-MnO2纳米铝热剂的微观形貌,其中球状颗粒为纳米Al 粉,纳米棒状结构为MnO2,两者能够直接接触且分散性良好;图1c 是KClO4-Al-MnO2纳米复合含能材料的SEM 照片,红色方框内为高倍率照片。由图1c 可见,样品以KClO4为基底,纳米Al 粉和纳米MnO2广泛分布在其表面。图1d 是NH4ClO4-Al-MnO2纳米复合含能材料,红色方框内的高倍率照片。由图1d 可见,纳米Al 粉和纳米MnO2仍以NH4ClO4为基底,均匀分布在基底表面,与KClO4-Al-MnO2样品结构类似。
3.2 热性能分析
热分析实验采用TG-DSC 联用的同步热分析方法,该方法能够反映样品在线性升温条件下,材料的物理化学性质与温度的依赖关系,得到样品的一系列热量、质量和温度的关系曲线,如图2 所示,升温速率均为20 ℃·min-1。
Al-MnO2纳米铝热剂的热分析结果如图2a 所示。从室温至350 ℃时,样品的质量缓慢下降了约5.5%,DSC 曲线上未出现明显的吸放热信号,其主要原因是水热法合成的MnO2中含有一定量的结合水,同时在制备Al-MnO2纳米铝热剂样品时,部分溶剂可能未完全蒸干,在热分析实验中,随着温度的提高,结合水与溶剂逐渐蒸发而导致热重降低[18]。在温度区间500~600 ℃,DSC 曲线出现明显的放热信号,峰值温度为559 ℃,对应TG 曲线没有明显的质量变化,该阶段发生了Al 与MnO2之间的固相铝热反应,放出热量约为1050 J·g-1。由于纳米Al 稍微过量,在660 ℃出现Al粉熔化的吸热峰。
通常,过渡金属氧化物对高氯酸盐的热分解会有一定的催化作用,且不同种类、不同结构的过渡金属氧化物的催化效果也存在一定的差异[19-21]。因此,在研究KClO4-Al-MnO2纳米复合含能材料热性能之前,先对纳米MnO2对KClO4热分能性能的催化作用进行测试,如图2b 所示。KClO4在306 ℃因熔化吸热,DSC曲线呈现出尖锐的吸热峰,除了MnO2中结合水的蒸发,质量没有显著的变化。当温度升高至500 ℃以上,DSC 曲线出现两个信号,一个小的吸热峰和紧随其后的放热峰,峰值温度分别为510oC 和513oC。此时,KClO4发生热分解反应,先吸热后放热,热分解反应放出O2导致质量快速降低,放热量约为137 J·g-1。
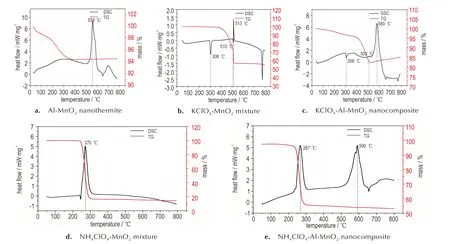
图2 样品的TG-DSC 曲线Fig.2 The TG-DSC curves of the involved samples
在此基础上,研究了KClO4-Al-MnO2纳米复合含能材料的热性能,如图2c 所示。因为KClO4熔化,在306 ℃附近DSC 曲线上出现吸热峰;进而在509 ℃附近,由于KClO4分解出现了一个微弱的放热峰。紧接着在530~620 ℃区间内,出现明显的放热峰,峰值温度为580oC,根据图2a 可知,这是由于Al-MnO2之间的铝热反应,放热量约为973 J·g-1。从TG-DSC 实验结果来看,KClO4在Al-MnO2铝热反应之前先发生热分解反应,此外,铝热反应发生的温度推迟了约21oC,这可能是因为KClO4的引入,使体系中Al-MnO2的相对含量降低所导致的。
同理,纳米MnO2对NH4ClO4热分解性能催化作用的结果如图2d 所示。对于纯NH4ClO4,其热分解过程可以划分为三个阶段:第一阶段在245 ℃附近,发生固体的晶型转变,吸收热量;第二阶段在305oC 附近,NH4ClO4发生热分解反应,放出热量,低温放热阶段;第三阶段在380oC,即NH4ClO 发生进一步热分解反应,放出热量,为高温放热阶段[19-20]。由图2d 可见,MnO2对NH4ClO4具有显著的催化作用,在245 ℃附近,NH4ClO4发生固相晶型转换后,随即发生热分解反应,峰值温度为270oC,放出大量的热量,没有出现低温放热阶段和高温放热阶段,并伴随质量快速下降,几乎所有的NH4ClO4在此阶段分解为气态产物。
NH4ClO4-Al-MnO2热性能结果如图2e 所示。NH4ClO4在245 ℃附近出现微弱的吸热信号后出现放热峰,放出热量,约为513 J·g-1,伴随质量的快速下降。结合图2a 和图2c,在510~620 ℃区间内,出现Al-MnO2之间铝热反应的放热峰,放热量约为993 J·g-1。在660 ℃出现Al 粉的熔化吸热峰。此外,铝热反应放热峰出现的温度延迟了约31 ℃。
由图2c 和图2e 可见,两种高氯酸盐均在铝热反应发生前完成了热分解反应,且高氯酸盐的引入将导致铝热反应延迟发生,这跟体系中铝热剂的相对含量降低有关。
3.3 产物分析
为进一步认识样品热反应的过程,收集坩埚中残留的反应产物,利用XRD 分析其物相组成,如图3 所示。Al-MnO2纳米铝热剂的产物主要是Mn3O4和MnO,同时Al 粉和MnO2中的O 元素反应生成Al2O3,对应的反应历程为Al 与MnO2反应,主要生成Mn3O4和部分MnO,一部分O 元素从MnO2转移到Al 上,与Al 反应生成Al2O3。对于KClO4-Al-MnO2纳米复合含能材料,产物主要是Mn3O4,没有MnO 的特征峰,另外还部分检测出了KCl 和Al2O3的衍射峰,结合图2b和图2c,对应的反应历程是随着温度提高,KClO4在MnO2的 催 化 作 用 下,热 分 解 生 成KCl,进 而,Al 与MnO2发生铝热反应,主要生成Mn3O4,O 元素与Al 结合生成Al2O3。而对于NH4ClO4-Al-MnO2纳米复合含能材料,产物则主要是MnO 的特征峰,没有Mn3O4,以及Al2Mn3合金和Al2O3,结合图2d 和图2e,对应的反应历程是随着温度提高,NH4ClO4在MnO2催化作用下发生热分解,产生大量气体产物,剩下的Al 与MnO2发 生 铝 热 反 应,主 要 生 成MnO 和Al2Mn3,O 元素与Al 结合生成Al2O3。另外,由于配方中Al 粉适当过量,因此,产物中都能够检测到Al 的特征峰。当KClO4加入到Al-MnO2体系中时,从产物分析的结果来看,产物主要是Mn3O4,会降低MnO2中O 元素的利用率,而NH4ClO4则正好相反,当NH4ClO4加入到Al-MnO2体系中时,产物主要是MnO,同时出现Al2Mn3。NH4ClO4热分解反应更加剧烈,气体产物量更多,有助于铝热剂组分的进一步分散和铝热反应的充分发生,提高铝热剂组分中氧化剂的利用效率。

图3 样品热分析产物的XRD 结果Fig.3 The XRD results of the decomposition condensed products from TG-DSC experiments
3.4 活化能
为研究高氯酸盐对样品铝热反应热动力学的影响,开展多重升温速率的同步热分析实验。根据Kissinger 法[22-23]的原理,统计不同升温速率下样品发生铝热反应的峰值温度,并进行线性拟合,进而计算得到铝热反应的活化能。由表1 和图4 可见,高氯酸盐的引入,可以有效降低Al-MnO2纳米铝热剂体系中铝热反应的活化能,KClO4可以使活化能降低39.1%,NH4ClO4可以使活化能降低35.8%。主要能量来自铝热反应,因此使铝热反应的活化能降低,可以有助于提高铝热反应的反应速率,提高能量的释放速率,有效地促进反应的进行。
结合图1 和图2 可知,随着温度的提高,高氯酸盐基底在MnO2的催化作用下发生快速的热分解反应。热分解反应放出一定热量并释放气体,而分布在其表面的纳米铝热剂组分将被进一步分散,有助于降低铝热反应的活化能。

表1 铝热反应在不同升温速率时的峰值温度及动力学参数Table 1 The peak temperatures and kinetics parameters of thermite reactions at different heating rates
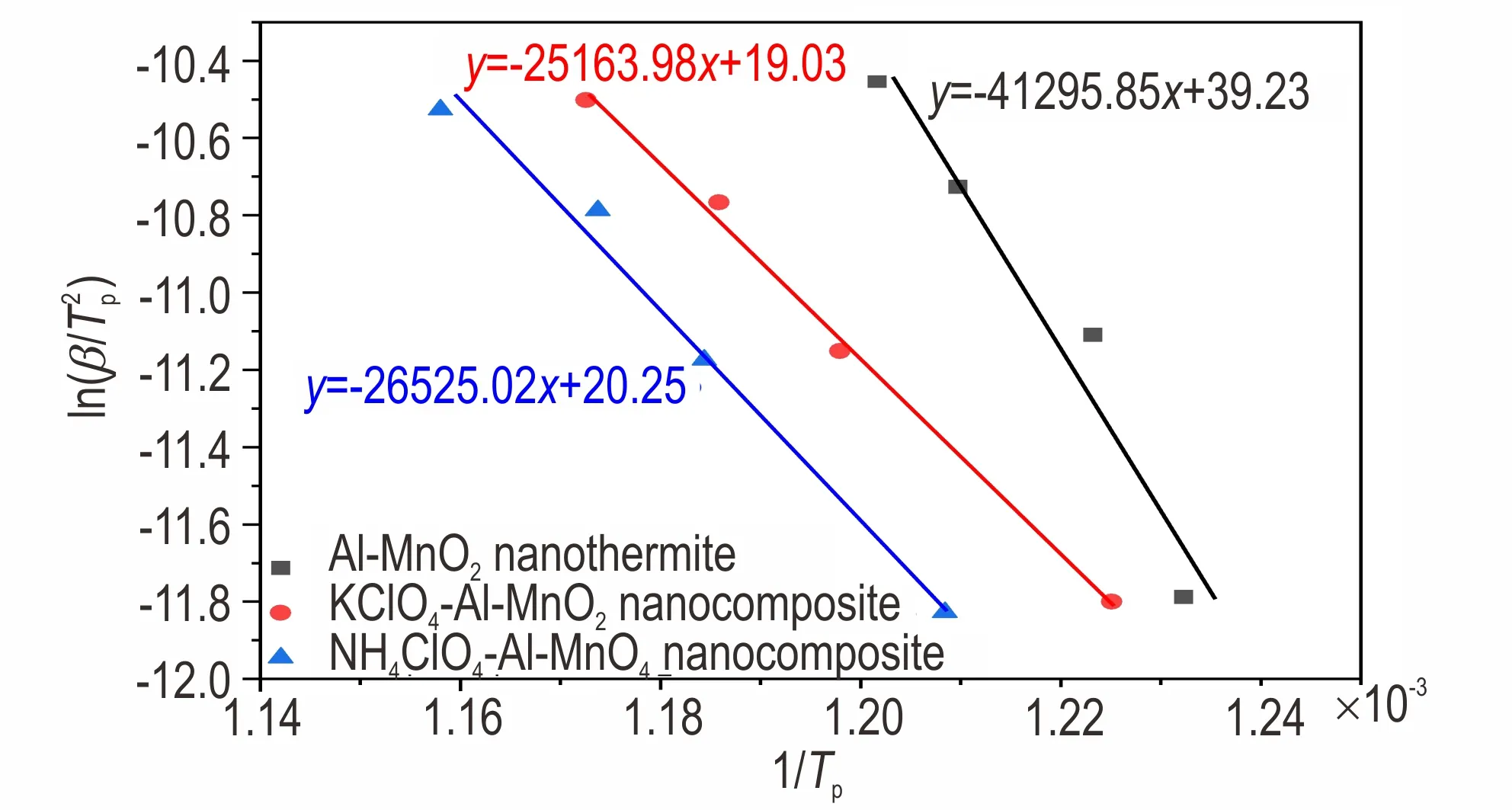
图4 样品发生铝热反应峰值温度点的线性拟合结果Fig.4 The linear fitting results of thermite reaction peak temperature for each sample
3.5 燃烧性能
点火和燃烧过程如图5 所示,以第一张记录到点火的照片为起始时刻,记为0 μs。图5a 是Al-MnO2纳米铝热剂,样品点燃后,火焰传播较快,在1 ms 时达到最大,火光明亮,充满了整个照片,然后火焰逐渐消退,消退速度较慢,在7 ms 时依旧明显地燃烧,并伴随一部分飞溅的火星。当加入KClO4时,如图5b 所示,KClO4-Al-MnO2纳米复合含能材料样品被点燃后迅速扩散,并在200 μs 时达到最大值,燃速显著提升,但是火光较弱,只占满了大约1/3 的照片,且不如Al-MnO2纳米铝热剂的火光明亮,火焰衰退速度较快,在7 ms时已经燃烧殆尽。而对于NH4ClO4-Al-MnO2纳米复合含能材料的燃烧,如图5c 所示,同样在200 μs 时达到最大值,燃速有显著的提升,火光有一定程度的衰减,但是明显强于KClO4-Al-MnO2纳米复合含能材料,火焰衰退速度最快,在3 ms 时就已经燃烧殆尽。

图5 样品点火与燃烧的高速摄影照片Fig.5 Photos of ignition and combustion process recorded by a high-speed camera
高氯酸盐的引入,将在一定程度上降低Al-MnO2纳米铝热剂燃烧时火光的明亮程度,但是对于材料的燃烧速度有显著提升,结合表1 和图5 的结果,这可能与活化能降低有关,KClO4和NH4ClO4都能够有效降低铝热反应的活化能,可以有效提高化学反应的速率。由图5b 和图5c 可见,虽然KClO4能够降低更多的活化能,但是在宏观表现上,却是NH4ClO4对Al-MnO2纳米铝热剂燃速的提升更明显。结合图2 的结果,NH4ClO4在热分解时释放的热量更多,有助于后续铝热反应的发生,同时根据图3 产物的分析结果,当NH4ClO4作为添加剂引入到Al-MnO2纳米铝热剂中时,产物中残留的主要是MnO 而不是Mn3O4,说明可以提高原先氧化剂MnO2中O 元素的利用率。然而,高氯酸盐对体系燃烧时火焰的大小和明亮程度没有帮助,这和热分析实验结果一致,高氯酸盐不直接参与铝热反应,因此,相同质量的含能材料,因为高氯酸盐的存在,将降低材料中Al-MnO2组分的质量分数。
4 结论
通过静电喷雾实验分别得到Al-MnO2纳米铝热剂、KClO4-Al-MnO2和NH4ClO4-Al-MnO2纳米复合含能材料,通过测试表征和点火实验,对比研究了高氯酸盐的引入对Al-MnO2纳米铝热剂体系的热性能、动力学和燃烧性能的影响,主要结论如下:
(1)利用静电喷雾法制备的样品,分散性良好。KClO4-Al-MnO2和NH4ClO4-Al-MnO2纳米复合含能材料的微观结构主要是以高氯酸盐为基底,纳米Al 粉和MnO2均匀分布在高氯酸盐基底上;
(2)TG-DSC 同步热分析实验发现高氯酸盐在铝热反应发生之前,发生分解放热反应;由于KClO4和NH4ClO4的引入,会相应地降低体系中铝热剂的含量,使得铝热反应的峰值温度分别推迟了21 ℃和31 ℃;
(3)KClO4-Al-MnO2的 产 物 主 要 是Mn3O4,而NH4ClO4-Al-MnO2的 产 物 主 要 是 MnO,说 明NH4ClO4的引入有助于氧化剂中O 元素的利用;利用Kissinger 法计算铝热反应活化能,KClO4和NH4ClO4使反应活化能分别降低了39.1%和35.8%;
(4)在点火实验中,高氯酸盐的引入可显著提高体系的燃烧速度,有助于提高反应速率;在200 μs 时,燃烧产生的火焰达到最大,但同时高氯酸盐的引入也将影响体系整体燃烧时火焰的大小和明亮程度。

