铁死亡机制与卵巢癌
黄承颖,林小丽,刘楠
卵巢癌是妇科肿瘤中最致命的恶性肿瘤,每年约有150 000名女性死于卵巢癌[1]。由于卵巢癌发生早期缺乏典型的临床症状,75%的卵巢癌确诊时已达晚期,超过70%的患者在治疗后复发[2]。一项流行病学研究收集了来自61个国家的数据,卵巢癌的5年生存率在30%~50%,且多数国家近20年生存率变化不大[3]。紫杉醇联合铂类药物是目前卵巢癌一线化疗方案,然而随着铂耐药的出现,改善卵巢癌的生存率陷入瓶颈。
近年来铁死亡成为研究热点,其与多种疾病有关,包括帕金森病、阿尔茨海默症等神经系统疾病,缺血再灌注损伤,肾脏损伤,血液疾病等[4],诱导或抑制铁死亡可以对疾病的发生、发展进行有效干预[5]。在肿瘤研究领域,铁死亡是诱导肿瘤细胞死亡的新的可能靶点。美国食品药品监督管理局(FDA)已批准的铁死亡相关药物中,索拉非尼(Sorafenib)、柳氮磺胺吡啶(Sulfasalazine)已用于肿瘤治疗。最新的研究表明铁死亡与卵巢癌有关[6]。因此,诱导肿瘤细胞发生铁死亡是攻克卵巢癌的新策略[7]。现深入讨论铁死亡的主要通路、铁死亡诱导剂与铁死亡抑制剂、铁死亡与卵巢癌的联系,为卵巢癌治疗寻找突破点。
1 铁死亡的发现和发展
2012年Dixon等[8]在研究RAS突变的肿瘤细胞时,首次将由艾拉斯汀(Erastin)引起的一种依赖于铁的非凋亡性细胞死亡方式定义为铁死亡。与凋亡、坏死相比,在形态特征上,发生铁死亡的细胞,其细胞质中的线粒体嵴及膜会发生破裂,但细胞膜不会破裂,因而具有完整的球形细胞的外观。生化方面,铁死亡以铁、活性氧簇(reactive oxygen species,ROS)及脂质过氧化的水平增加为特征。调控铁死亡的关键有芬顿反应、胱氨酸-谷氨酸反向转运蛋白系统(Xc-系统)、谷胱甘肽过氧化物酶 4(glutathionedependant peroxidase 4,GPX4)[9]。其中,Erastin 作用于Xc-系统,抑制胱氨酸运入细胞,减少了细胞内谷胱甘肽的水平,进而影响GPX4的功能,最终细胞内ROS积聚和细胞膜脂质过氧化导致细胞死亡[5]。
2 铁死亡的主要通路
2.1 铁代谢与芬顿反应铁是哺乳动物细胞维持正常所需的元素。Fe3+与转铁蛋白(transferrin,TF)形成结合物,通过细胞膜表面的转铁蛋白受体1(transferrin receptor 1,TFR1)转运。结合物经过内吞作用进入细胞,由六跨膜前列腺上皮抗原3(six transmembrane epithelialantigen ofprostate 3,STEAP3)还原为Fe2+,然后经过二价金属离子转运体 1(divalent metal transporter 1,DMT1)从内体(endosome)进入胞质。细胞内的铁可用于多种代谢过程,如形成铁硫簇,运入线粒体用于合成血红蛋白。如果细胞内铁过多,则会以铁蛋白的形式储存,当体内需要时,铁会从铁蛋白复合物释放出来;也可由膜铁转运蛋白 1(ferroportin 1,FPN1)运出细胞[10]。体内铁缺乏常常导致贫血,然而过多的铁可能造成铁稳态的失衡带来生物毒性,这来源于其催化的芬顿反应。芬顿反应中,Fe2+与过氧化氢反应生成Fe3+和羟自由基。羟自由基是一种具有极强氧化能力的ROS,可以破坏蛋白、脂质和DNA,影响细胞膜的功能,导致细胞死亡[11]。
2.2 脂质过氧化在铁死亡中,由ROS驱动的脂质过氧化反应在铁死亡通路中发挥重要作用。首先,羟自由基夺去细胞膜中多不饱和脂肪酸的氢,生成磷脂自由基,接着,磷脂自由基与氧、邻近的脂质反应,生成磷脂过氧化氢(phospholipid hydroperoxide,PLOOH),Fe2+与PL-OOH的反应产物继续与脂质反应,得到磷脂自由基,再次启动新一轮的脂质过氧化反应[12]。PL-OOH的降解物会破坏细胞膜,并且持续广泛的脂质过氧化会影响细胞膜的流动性和结构,增加细胞膜的渗透性,是细胞死亡的重要原因[13]。
2.3 Xc-系统/谷胱甘肽/GPX4轴Xc-系统是一种胱氨酸-谷氨酸反向转运蛋白系统,包括2个独立的蛋白质,其中一个叫做溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)[14],其与Xc-系统的运转功能有关;另一个是SLC3A2溶质载体家族 3成员2(solute carrier family 3 member 2,SLC3A2),其摄取一个胱氨酸分子进入细胞,同时向细胞外输出一个谷氨酸分子作为交换[15-16]。运入的胱氨酸进入细胞后转化为半胱氨酸,用于合成谷胱甘肽。谷胱甘肽是GPX4的辅因子和底物,与GPX4的脂质修复功能有关。GPX4将还原型谷胱甘肽转化为氧化型谷胱甘肽,同时将PL-OOH还原为磷脂羟基化物(PL-alcohol,PL-OH)[17]。很多细胞依赖于 Xc-系统摄取胱氨酸,这个摄取步骤是合成半胱氨酸的限速步骤。阻止或抑制这个步骤可导致细胞内半胱氨酸减少,抑制GPX4的脂质修复功能,通过影响细胞的氧化还原状态抑制铁死亡[18]。
2.4 转硫途径半胱氨酸是一种非必需氨基酸,除了依靠Xc-系统获取,一些哺乳动物细胞也能通过转硫途径合成半胱氨酸。甲硫氨酸作为硫供体,在胱硫醚 β-合酶(cystathionine β-synthase,CBS)、胱硫醚γ-裂解酶(cystathionine gamma-lyase,CSE)的催化下通过中间体同型半胱氨酸和胱硫醚转化为半胱氨酸,同时也产生气态信号分子硫化氢[19-20]。此途径的2个关键酶——CBS、CSE的活性及其蛋白表达可调控半胱氨酸的合成以及细胞质内谷胱甘肽的量进而调控铁死亡[19]。了解铁死亡通路与转硫途径的联系有利于寻找潜在的抗肿瘤靶点。铁死亡的主要通路见图1(见后插一)。
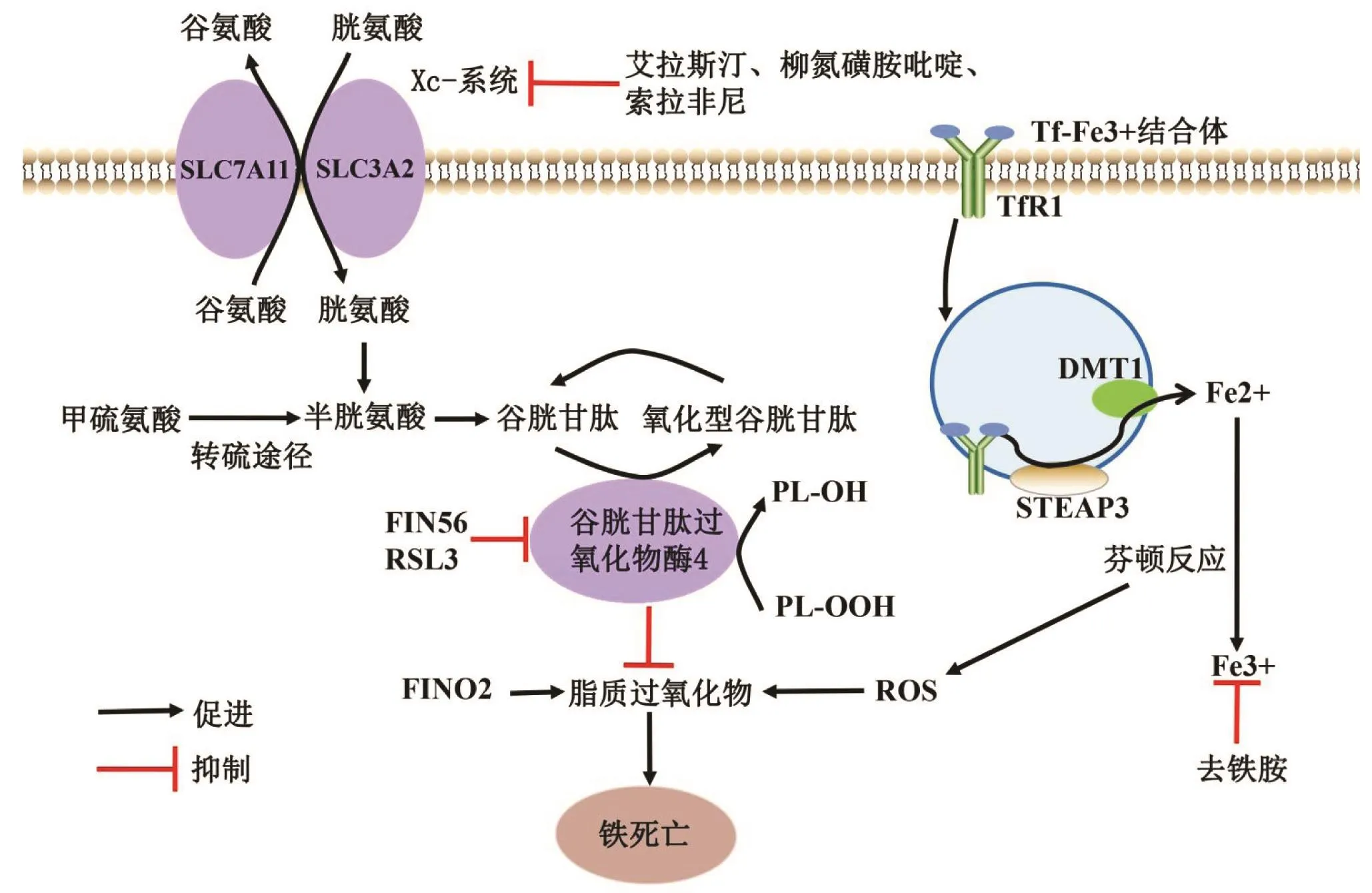
图1 铁死亡过程
3 铁死亡与肿瘤治疗
在肿瘤研究中最主要的挑战之一就是如何有效地杀死肿瘤细胞而让正常细胞不受损伤。使用铁死亡诱导剂或抑制剂来合理诱导铁死亡的发生是提高肿瘤治疗有效性和针对性的一个新方向。
3.1 铁死亡诱导剂Dixon等[8]发现了4种启动铁死亡的方式,因而铁死亡诱导剂可分为4类。第一类铁死亡诱导剂主要是Xc-系统抑制剂,包括Erastin及Erastin类似物等,这些药物是否可以用于体内目前仍处于研究中。某些肿瘤细胞通过抑制Xc-系统不能诱导铁死亡,这可能与不依赖于谷胱甘肽的硫氧还原蛋白抗氧化系统通路的提升有关[21]。针对GPX4的第2类和第3类诱导剂可用于。诱导这些肿瘤细胞发生铁死亡。
3.2 铁死亡抑制剂铁死亡抑制剂中铁死亡抑制剂1(Fer-1)可通过减缓脂质过氧化物的积累抑制铁死亡,这可能源于它们捕获自由基的抗氧化剂活性,而不是作为脂氧合酶抑制剂的效力[22]。去除铁死亡诱导剂不足以使铁死亡细胞复活,还需要铁死亡抑制剂的辅助。Tang等[23]研究发现,当移除铁死亡诱导剂后加入Fer-1,正在发生铁死亡的细胞可以恢复。而其他铁死亡抑制剂,如去铁胺、抗氧化剂维生素C无法在加入铁死亡诱导剂之后使细胞复活,因为它们作用于启动铁死亡的上行通路而不是执行铁死亡的下行通路。铁死亡诱导剂和抑制剂见表1。
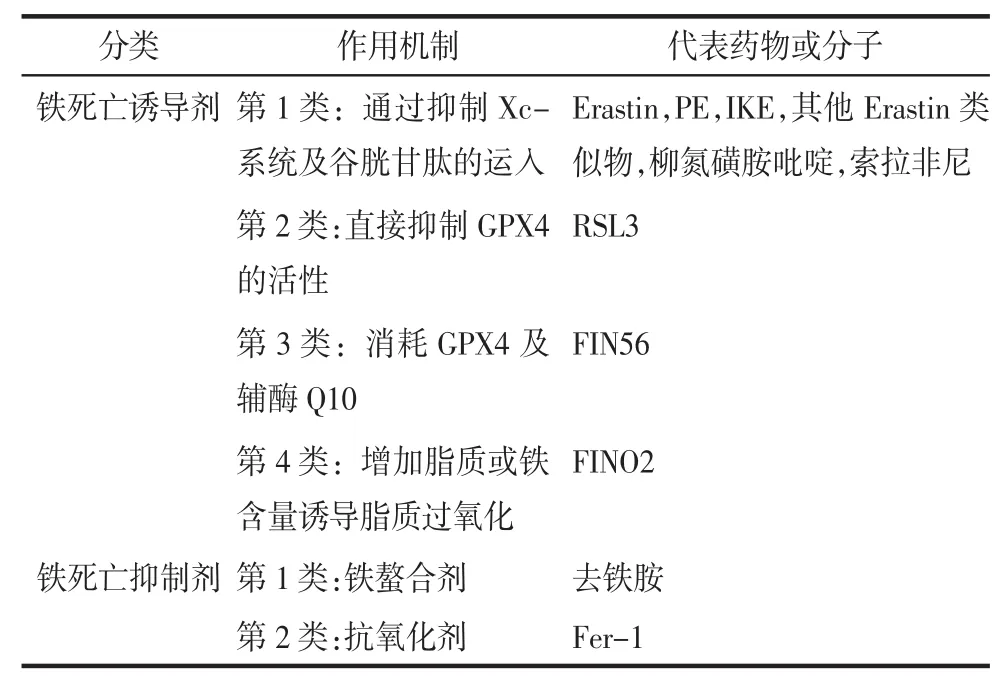
表1 铁死亡诱导剂和抑制剂
4 铁死亡在卵巢癌中的进展
4.1 铁水平升高多项研究表明,细胞内铁水平的升高与多种肿瘤的发生有关,包括肺癌、肝癌、卵巢癌等[24]。Basuli等[25]发现,与正常的卵巢组织相比,高级别浆液性卵巢癌癌组织中FPN下降,TFR1与TF增加,铁水平升高。卵巢癌起始细胞的遗传模型也表现出铁流出泵减少,铁运入相关蛋白表达上调的情况。这表明在卵巢癌发生的早期,卵巢癌细胞内铁水平升高,在早期扰乱肿瘤细胞的铁代谢是一个杀死肿瘤细胞的突破口。
4.2 p53基因卵巢癌的发生与p53基因突变有关。细胞内产生的ROS损伤DNA造成p53基因的失活、K-ras的激活,诱导卵巢癌的发生[26]。近年来的研究显示高级别浆液性卵巢癌可能起源于输卵管的远端。有研究表明,单纯的p53基因突变可以引起小鼠输卵管上皮细胞发生迁移;当p53基因突变与K-ras激活联合发生时,小鼠输卵管上皮细胞则转化为肿瘤细胞[26]。这说明减少p53基因突变有助于改善生存率。进一步的研究表明在铁死亡中,SLC7A11是p53的作用靶点,p53作用于Xc-系统的亚单位,抑制对胱氨酸的摄取来抑制铁死亡[27]。
4.3 转硫途径大量研究证实细胞内谷胱甘肽水平升高和相关代谢酶高表达与卵巢癌的耐药性密切相关[28-29]。Liu等[30]建立了Erastin耐受细胞株,发现细胞株依然可以维持谷胱甘肽的含量,提示细胞内存在其他途径合成胱氨酸。检测发现,转硫途径的关键酶CBS有高表达,说明Erastin耐受细胞株通过上调的转硫途径为细胞提供胱氨酸。Verschoor等[31]使用Xc-系统抑制剂和转硫途径抑制剂处理2种卵巢癌细胞模型,发现细胞内谷胱甘肽水平在转硫途径抑制后显著降低,说明转硫途径对卵巢癌细胞合成谷胱甘肽非常重要。Chakraborty等[32]发现在少数卵巢癌细胞系中,转硫途径中的CBS表达水平升高,CBS基因沉默可抑制卵巢癌细胞发生细胞迁移和侵袭。以上研究均提示对卵巢癌细胞转硫途径的深入研究可能为铁死亡诱导剂用于卵巢癌治疗提供方向。
4.4 铂耐药铂类药物机制的基础是产生细胞内的ROS造成细胞损伤和死亡。许多学者报道细胞对半胱氨酸与谷胱甘肽的获取合成对卵巢癌细胞对卡铂的耐药性有影响[33-35]。Santos等[35]猜想通过干扰半胱氨酸的代谢逆转耐药性,使用含硒白杨素作Xc-系统的抑制剂处理3种卵巢癌细胞系及2种良性细胞系,研究结果提示含硒白杨素可促进减少谷胱甘肽水平并且对CBS有抑制作用。为了增加药物对肿瘤细胞的特异性,他们设计了一种纳米药物作为改善卵巢癌治疗的新策略。表明设计药物干扰胱氨酸/半胱氨酸代谢下调细胞谷胱甘肽含量是卵巢铂耐药的突破点。
4.5 铁死亡相关药物索拉非尼是临床上批准的可以诱导铁死亡的抗癌药物[36],一项多中心的随机对照试验使用索拉非尼与托泊替康进行联合维持治疗,发现铂耐药卵巢癌患者的无进展生存期有显著改善[37]。青蒿素是一种经典的抗疟药,肿瘤细胞对青蒿素及其衍生物的细胞反应涉及了铁死亡、凋亡、坏死等多种细胞死亡方式[38]。青蒿酯处理卵巢癌细胞后,细胞内产生大量的ROS,并且增殖程度降低,凋亡抑制剂或铁死亡抑制剂都只能不完全地抑制青蒿酯对细胞的毒性作用,这说明青蒿酯通过多种机制对卵巢癌细胞发挥抗增殖和细胞毒作用[39]。虽然铁死亡相关药物的机制仍待研究,但其可能成为通过铁死亡通路改善卵巢癌治疗的新路径。
5 展望
铁死亡成为肿瘤方面的研究热点,铁代谢、芬顿反应、Xc-系统、GPX4之间的通路网络已初步建立,其他重要的相关通路(包括转硫途径等)及铁死亡相关药物有待进一步的研究。目前卵巢癌的化疗方案依然以铂类和紫杉醇药物为主,但晚期卵巢癌患者的预后依然不乐观。对铁死亡通路与卵巢癌的联系的深入探究有利于寻找一种新的化疗方案。铁死亡诱导剂和抑制剂有望在未来得到有效合理的应用,从而提高卵巢癌和其他肿瘤治疗的精准性。

