妊娠合并肺癌一例并文献复习
袁文静,刘惠娜,马慧慧,赵先兰
目前我国肺癌的死亡率居恶性肿瘤之首,女性发病率居第二位,妊娠合并肺癌却十分少见,每1 000例妊娠妇女中约有1例合并恶性肿瘤。近年由于年轻女性吸烟及延迟生育,妊娠合并肺癌的患者也逐渐增多。因其临床特点不典型,易与早孕反应相混淆,诊断较困难,故常在妊娠晚期发现,多预后不良。本研究回顾性分析在郑州大学第一附属医院诊治1例及既往文献报道的妊娠合并肺癌71例,分析妊娠合并肺癌的临床特点、治疗及预后,旨在提高临床医生对妊娠合并肺癌的认识,为临床诊治提供依据。
1 病例报告
1.1 收治病例诊治情况患者 女,29岁,因妊娠8个月余,活动后气喘进行性加重7个月余,咳嗽4个月余,于2019年6月19日入院,末次月经2018年10月19日,患者停经1个月余自觉轻微活动后气喘,未治疗,症状进行性加重。4个月前无明显诱因出现咳嗽,活动后气喘加重,咳嗽剧烈时伴右肺下缘区疼痛,偶伴泡沫样白痰,夜间睡眠无法平卧,高枕侧卧可改善,食欲差。1个月前自行触及颈部肿大,彩超检查提示双颈部多发淋巴结肿大;2 d前纳差、咳嗽、气喘加重,进食后伴恶心呕吐,外院对症治疗后无明显好转。发病以来,体质量较前减轻8 kg。既往无基础病史、无吸烟史及肿瘤家族史,无发热、咯血、咳痰、胸痛等其他不适。孕3产1,5年前因胎位不正行剖宫产术1次,2年前孕30周因胎儿面部畸形行引产术。
入院时体格检查:颈部可触及肿大淋巴结,双肺可闻及哮鸣音,腹部膨隆,宫高28 cm,腹围91 cm,胎心140次/min,头先露。实验室检查:血红蛋白107.5 g/L,D-二聚体0.74 mg/L,纤维蛋白原测定4.36 g/L;肿瘤标志物:甲胎蛋白(AFP)422.60 ng/mL;糖类抗原125为46.40 U/mL;非小细胞肺癌抗原2 115.45 ng/mL;血气分析:pH值7.43,二氧化碳分压31.00 mmHg(1 mmHg=0.133 kPa),氧分压 139.00 mmHg,红细胞压积0.31。肝肾功能、电解质、空腹血糖及传染病未见异常。心脏彩色超声:左室射血分数0.62,左心室缩短分数0.34,心包积液。胸腹腔未见明显积液。胎儿彩超提示:双顶径90 mm,头围320 mm,股骨长66 mm,腹围304 mm,羊水指数130 mm。胸部计算机断层扫描(CT)示:两侧颈根部及上中纵隔占位,恶性可能;右肺炎症;左肺下叶慢性炎症;心包积液(见图1)。请多学科医师会诊后,积极与患者及其家属沟通取得其知情同意,决定终止妊娠,遂于2019年6月21日在全身麻醉下急诊行子宫下段二次剖宫产术+右侧卵巢肿瘤剥除术+右侧卵巢修补术。手术顺利,剖娩一男活婴,胎盘及脐带未送病检。术中卵巢组织病理检查示:(右侧卵巢)高级别神经内分泌癌,符合小细胞癌,转移性不除外(见图2,见封三)。术后给予呼吸支持、抗感染、化痰平喘、改善循环等对症支持治疗,症状较前缓解后行支气管镜抽痰及检查,病理检查示:(右侧病灶)小细胞癌(见图3,见封三)。腹部CT示:①双侧附件区结节及肿块,考虑转移可能大。②胰腺多发结节及肿块,考虑转移可能大。③双侧肾上腺结节,考虑转移可能大(见图4)。2019年6月29日凌晨5点突发癫痫、意识不清,急查脑部CT示:左侧枕顶叶、右侧额颞叶及左侧基底节区多发转移灶?头颅磁共振成像(MRI)示:①左侧额顶叶、右侧额叶、双侧颞枕叶、左侧小脑半球多发病变,考虑脑转移瘤;②右侧小脑半球病变未见明显强化,考虑脑转移瘤?(见图5)。给予甘露醇及苯巴比妥针控制癫痫后生命体征平稳。

图1 胸部CT图
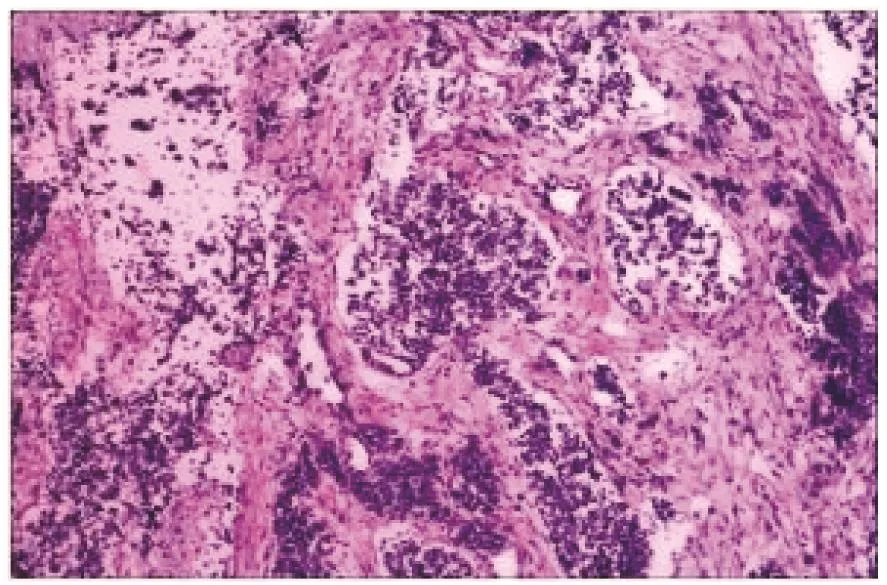
图2 右侧卵巢组织病理图(HE染色×200)

图3 右主支气管病灶组织病理图(HE染色×200)
初步诊断为:①肺癌并全身多发转移(骨、胰腺、胸膜、肾上腺、子宫附件、脑?);②心包积液;③剖宫产后;④卵巢肿瘤;⑤瘢痕子宫;⑥孕3产2。于2019年6月29日开始行“依托泊苷+奈达铂”方案化疗+头部调强适形放射治疗(IMRT),阿帕替尼抗血管生成维持治疗;化疗3个疗程后,2019年9月1日复查肿瘤标志物示:AFP为6.16 ng/mL;胸部CT:①小细胞肺癌多发转移,双侧颈根部及上中纵隔、右肺门区占位,较2019年8月8日略缩小。②双侧肋骨陈旧性骨折。头颅MRI:①肺癌转移化疗后改变,与2019年6月29日(1483749)相比病变明显减小,请结合临床动态观察;②桥脑病变未见明显强化,较前减小。截止2020年3月26日,患者已行化疗8个疗程,定期复查影像学检查、血清肿瘤标志物水平,目前处于密切随诊中。
1.2 文献病例及本例综合情况从1969—2020年1月,共检索到54篇文献[1-54]。加上本例病例,共72例病例纳入本研究,其中国外59例,国内13例。
72例妊娠合并肺癌的病例中,年龄17~45岁,中位年龄为34岁;妊娠期确诊肺癌64例,确诊孕周6~38周,中位孕周31周,其中妊娠中晚期确诊60例(93.75%);孕前及产后确诊肺癌分别为5例和3例;有明确吸烟史19例(26.39%),无吸烟史34例(47.22%);60例有首诊症状:咳嗽43例(71.67%),呼吸困难32例(53.33%),胸痛 12例(20.00%),咯血 10例(16.67%),乏力 10例(16.67%),体质量减轻 13例(21.67%),浅表淋巴结肿大及发热、骨痛各7例(11.67%),头痛及下肢肿痛各5例(8.33%),癫痫发作4例(6.67%),上腔静脉综合征、吞咽困难、视力障碍、关节痛各1例(1.67%);非小细胞肺癌59例(81.94%),小细胞肺癌13例(18.06%);临床分期为Ⅲ~Ⅳ期65例(90.28%);早期人工流产3例,分娩胎儿69例,其中经阴道分娩21例,剖宫产45例,3例不详,分娩的中位孕周为33周(26~42周)。在妊娠期接受治疗的患者共35例,其中23例化疗,化疗药物多为以铂类为基础的联合化疗,化疗药物有:卡铂、顺铂、奈达铂、多西他赛、依托泊苷、紫杉醇、吉西他滨及长春瑞滨等;7例行靶向治疗;5例行放射性治疗;1例手术。61例随访病例中,患者确诊肺癌后3个月、6个月、12个月的生存率为65.57%、52.46%、26.23%,无胎儿先天性畸形等报道。
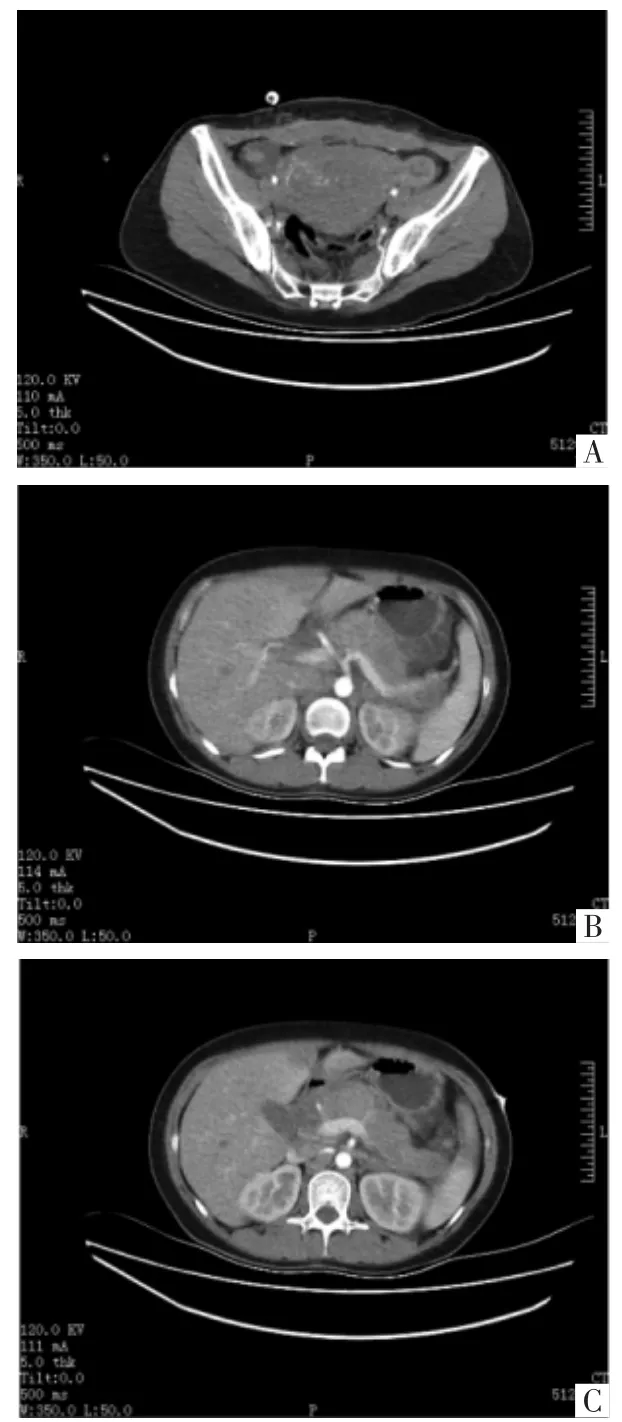
图4 腹部CT图
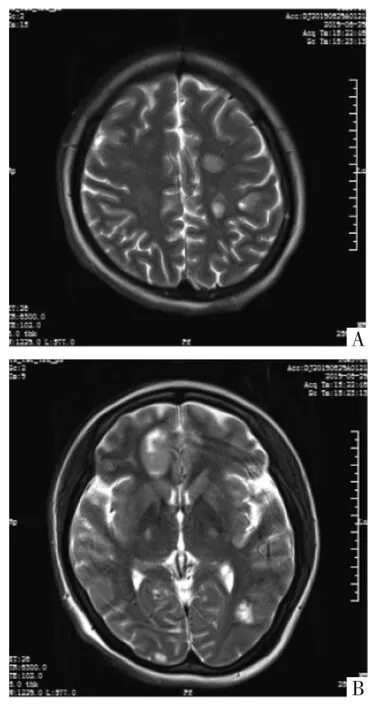
图5 头颅MRI图
2 讨论
2.1流行病学近年妊娠合并肺癌发生率逐渐增加。妊娠期最常见的肺癌组织学类型为非小细胞肺癌(non-smallcelllungcancer,NSCLC),约占 80%~85%,近2/3的患者诊断为晚期(Ⅱb/Ⅳ期),10%~15%为小细胞肺癌(small cell lung cancer,SCLC),不足 5%为肺类癌[49]。其中SCLC最具有侵袭性,易发生脑转移(BM),SCLC合并BM患者的预后较差,是妊娠合并肺癌死亡的主要原因,中位生存期为4~6个月[55]。
本研究72例病例中,妊娠中晚期确诊的患者有60例,占93.75%,临床分期Ⅲ~Ⅳ期65例,占90.28%。可见大多数患者妊娠早期常被误诊、漏诊,被确诊时孕周及TNM分期常为晚期,且预后不良。而误诊、漏诊和预后不良可能有多种原因:①妊娠可能掩盖癌症症状,肺癌相关临床表现如全身疲劳、咳嗽、胸闷和呼吸困难,均认为与妊娠期特殊的生理性改变相关;②由于辐射的影响,孕期不适宜放射线检查,即使医生建议,孕妇也不愿接受放射评估;③妊娠期激素水平的增加,母体免疫功能低下,可能加快肿瘤的生长。
2.2 诊断及辅助检查我国推荐非孕期肺癌高危人群使用胸部低剂量CT进行肺癌筛查,使用PET/PET-CT、骨扫描等检查协助肺癌的诊断、分期及治疗评价。但妊娠期影像学和核医学在肿瘤影像学检查中的应用与之不同,主要原因是存在致畸、流产、早产和胎儿死亡的风险。如高度怀疑恶性肿瘤,应向患者及家属强调检查的必要性,并取得患者知情同意后行放射评估,避免漏诊。胎儿损伤的显著风险阈值设定为100 mGy[56]。胸部X线及CT均小于0.1mGy,因此均可在有足够腹部屏蔽的情况下使用。但应避免电离成像程序,因为辐射可能影响胎儿的存活和发育[57]。建议使用无钆MRI,不建议使用PET和骨骼扫描评估远处转移,因为可能发生继发于放射性物质的胎儿畸形。可通过X线片对疼痛的骨骼部位进行筛查,以排除骨转移。肺癌确诊的方式是组织活检,如CT/超声引导下穿刺活检、支气管镜检查、浅表淋巴结活检,必要时妊娠晚期可在设备完善、有足够胎儿监护的医院进行。值得注意的是,主治医师应根据患者病情需要选择合适的检查方法。2.3 治疗临床分期Ⅰ、Ⅱ期患者可行手术治疗,Ⅲ、Ⅳ期患者多采取化疗,待其分娩后可考虑放疗。
化疗是大多数妊娠期肺癌患者的首选医治方法。妊娠早期是胎儿器官发育重要时期,大多数化疗药物都可以穿过胎盘屏障,致畸风险高达20%,晚期可下降到1.3%[58]。但有研究显示妊娠早期化疗不会导致胎儿畸形,只是可能增加新生儿并发症的风险[59]。因此需要在妊娠早期化疗的患者应综合考虑是否终止妊娠。妊娠中晚期化疗较为安全,可从孕12~14周进行,直至孕35~37周[60]。其次,胎儿畸形的风险高低取决于使用的化疗药物。在SCLC和NSCLC中,以铂类为基础的联合化疗是一种被广泛接受的一线疗法。Boussios等[43]发现,与卡铂相比,顺铂与更多的胎儿不良事件相关,如宫内生长受限、呼吸窘迫综合征、肾毒性、耳毒性及骨髓抑制等,因此孕期更推荐应用卡铂。抗代谢药物(吉西他滨和培美曲塞)致畸的危害最高,其次是烷基化剂,不建议妊娠期使用。蒽环类和植物生物碱是由大分子组成的,很难通过胎盘。因而,卡铂联合长春新碱类或紫杉烷类是不错的选择。化疗药物剂量应根据孕妇的实际体质量决定,不应与非妊娠期相同。一项研究调查了化疗后新生儿白细胞减少症和中性粒细胞减少症的发生率,发现化疗后22~28 d分娩胎儿中性粒细胞减少症比较常见,化疗后7 d内分娩胎儿白细胞减少的风险最高[61]。因此,最后一次化疗时间应与分娩至少间隔3周,以确保母婴骨髓抑制的恢复。此外,化疗期间禁止母乳喂养,因为化疗药物可随母乳一起排出。
放射治疗对胎儿有严重的影响,包括胎儿死亡、智力低下、致畸及致癌,具体取决于孕周及辐射剂量。妊娠早期禁忌放疗。有研究显示,在受精后10 d内放疗是致死性的,受精后2周~孕10周可致畸和生长迟缓,孕11~14周神经及生长发育畸形,孕15~24周可致恶性肿瘤、不育、遗传缺陷[62]。妊娠中、晚期放疗危害下降,但一般也不推荐。0.1~0.2 Gy的阈值以上的剂量对胎儿损害风险较大[63]。在小于0.1 Gy的胎儿剂量并做好腹部屏蔽的条件下,远离骨盆的部位(如脑部、骨骼)也可行姑息性放疗。
本研究72例病例中,在妊娠期接受治疗的患者共35例,其中23例化疗;7例靶向治疗;5例放射性治疗(2例妊娠早期脑部姑息性治疗,3例妊娠中晚期放疗);1例手术。妊娠期治疗的病例中,新生儿随访均无先天性畸形报道。妊娠期及产后未治疗患者,产后1年内死亡率达100%。因此,早期治疗对妊娠合并肺癌患者至关重要,并应根据孕周及患者病情选择合适的治疗方案。
2.4 分娩时机的选择妊娠合并肺癌的患者是否终止妊娠,以及分娩时机的选择是非常矛盾的,也面临着伦理学和医学巨大的挑战。积极治疗并延长孕周有助于胎儿在宫内的发育,但可能会加速疾病进展,危及患者的生命健康。本研究72例病例中,妊娠期确诊肺癌64例,主动要求早期人工流产3例,中期人工引产6例,中位确诊孕周31周(6~38周),分娩的中位孕周为33周(26~42周)。但Mitrou等[49]研究发现,终止妊娠并不能改善母儿预后。因此,分娩时机的选择需要多方面综合考虑,如孕周、患者状态、疾病严重程度、患者及家属意愿以及延迟治疗的风险。对于妊娠早期确诊、已生产、无继续妊娠意愿或决定在妊娠早期进行放化疗的患者,建议尽早终止妊娠[51]。对于妊娠中晚期患者,如出现明显呼吸困难、咯血、消瘦等情况,胎儿有生长受限、宫内窘迫的可能,延长孕周并不能改善胎儿预后,可及时终止妊娠;如患者一般情况可,身体状况可耐受且有强大的继续妊娠意愿,取得知情同意后可行尝试性的期待治疗,适当延长孕周,在积极促胎肺成熟后建议终止妊娠[40]。
2.5 预后患者总体预后较差,中位生存时间为7.5个月(1~42个月)[51]。本研究中超过80%的患者被诊断为晚期NSCLC,5年生存率低于5%。SCLC对放化疗敏感,但易复发,5年生存率约为5%~10%[18]。癌细胞垂直向胎盘或胎儿扩散的情况很少见,但很有必要进行胎盘组织病理学检查和脐带细胞学检查。早产是最常见的不良反应,也是新生儿早期并发症和神经发育不良结局的主要决定因素[64]。新生儿死亡、新生儿重症监护室(NICU)入院、小于孕龄儿(SGA)、早产相关疾病和血液系统紊乱等疾病发生率显著增加。另外,妊娠期化疗引起的长期并发症如神经发育障碍、心脏毒性、耳毒性和继发性恶性肿瘤也曾被报道[65]。因此,应长期随访新生儿的超声心电图及听力检查。
本研究61例随访病例中,患者确诊肺癌后3个月、6个月、12个月的生存率分别为65.57%、52.46%、26.23%。孕期及产后均未治疗患者均在1年内死亡。活胎分娩共69例,4例胎儿转移,其中2例头皮转移者在手术后5年随访无复发。余患儿长期随访中未发现有神经发育异常等相关长期并发症。
综上,妊娠合并肺癌是一种特殊性疾病,预后较差,早期诊断有助于改善母儿预后。但目前样本量小,病例资料不足,国内外尚无针对治疗的指南及共识。因此,临床医生应更加注重多学科联合治疗,关注既往诊治经验及研究进展,共同推进妊娠合并肺癌诊治的进一步发展。

