CD4+T细胞亚群在子宫内膜癌中的研究进展
张凯,刘玉林,胡佳丽,滕飞,薛凤霞
子宫内膜癌(endometrial carcinoma,EC)是女性生殖系统中常见的三大恶性肿瘤之一,预计美国2019年子宫内膜癌新发病例数为61 880例,新发病率占生殖道恶性肿瘤的21%,其中因罹患子宫内膜癌而死亡的患者数达12 160例[1]。子宫内膜癌的发生发展是一个涉及多因素多阶段的复杂生物过程,以往认为肿瘤细胞因基因的失调导致持续接受细胞生长信号而不受控制的增殖,而要充分了解肿瘤的生物学行为,还必须了解癌细胞所处的微环境,包括由大量免疫细胞、细胞因子、间充质细胞及细胞外基质等,其中T细胞介导的细胞免疫在肿瘤免疫中具有重要作用。既往的研究显示免疫系统对肿瘤患者具有保护作用,例如,肿瘤浸润淋巴细胞(tumourinfiltrating lymphocytes,TILs)被认为代表宿主的抗肿瘤反应,局部肿瘤组织中浸润的淋巴细胞数越多,则乳腺癌[2]、黑色素瘤[3]、结直肠癌[4]和食道癌[5]患者的总体生存期就越长。此外,一部分免疫系统产生的免疫应答也参与了促瘤的过程,如与肿瘤相关的调节性T细胞(Treg)或髓样抑制细胞则能够通过损害抗肿瘤免疫反应而促进肿瘤的增殖、生长[6]。因此,人体的免疫系统存在着促瘤与抑瘤的双面性。随着免疫学的发展,子宫内膜癌的发生、转移与机体的免疫功能也密切相关,免疫细胞及释放的细胞因子对子宫内膜癌的生物学行为发挥着极其关键的作用[7]。了解子宫内膜癌与免疫系统的关系,特别是T淋巴细胞与免疫微环境之间的调节机制,为子宫内膜癌的免疫治疗奠定理论依据。然而,目前国内外对CD4+T细胞及其亚群在子宫内膜癌中的研究尚处于起步阶段。现就CD4+T细胞亚群在子宫内膜癌中的作用加以综述。
1 CD4+T细胞及亚群
来源于卵黄囊、骨髓的T淋巴细胞前体干细胞在胚胎发育的第11周起,会经过血液流向胸腺,经过在胸腺的浅皮质区、深皮质区、髓质移行区中分化、T细胞受体(TCR)基因重排和阳性、阴性选择的筛选,以及后续微环境中多种刺激因素的作用下发育为成熟T细胞,获得能够识别抗原的能力,故又名胸腺依赖淋巴细胞(thymus-dependent lymphocyte)。成熟T细胞是高度不均一的细胞群体,根据T细胞的分化状态、表达细胞表面分子和功能的不同,可划分为初始T细胞(naive T cell)、效应T细胞(effector T cell)和记忆T 细胞(memory T cell)。初始 CD4+T细胞可与抗原主要组织相容性复合物(MHC)相互作用后而激活,依靠微环境中细胞因子向特定亚型分化并产生介导免疫反应的特定细胞因子。依据归巢的特性和免疫应答的特性不同又可分类[8],如1型辅助性 T 细胞(Th1)、Th2、Th17、Treg等,以及新确定的细胞亚群Th22、Th9。不同亚群的CD4+T细胞通过分泌不同的细胞因子,直接或者间接参与人体的固有免疫和适应性免疫应答,而效应T细胞和记忆T细胞则能参与适应性免疫应答和免疫记忆的维持。正常人体中,T细胞亚群之间维持着一定的平衡和稳定,各亚群细胞数量及分泌的细胞因子之间一旦发生失衡,将导致多种炎性疾病和自身免疫性疾病的发生,同时也伴随着多种肿瘤免疫过程的发生[9]。
2 Th1/Th2细胞亚群在子宫内膜癌中的作用
2.1 Th1/Th2细胞的分化调控人体的免疫应答基于细胞因子的不同分为体液免疫应答和细胞免疫应答,当特异性T细胞受体(antigen-specific T cell receptors,TCRs)和细胞因子受体被激活时,初始CD4+T细胞能够分化成中间阶段的Th0,再在特定的刺激条件下进一步分化发育为Th1或Th2,在人体的免疫应答中发挥着重要作用。Th1和Th2的概念最早是在1986年由Mosmann等[10]首先提出,Th1可分泌白细胞介素 2(IL-2)、IL-12、干扰素 γ(IFN-γ)和肿瘤坏死因子β(TNF-β),辅助活化自然杀伤细胞(natural killer cells,NKC)和 CD8+T 细胞,参与迟发型超敏反应和细胞免疫应答,介导组织损伤。Th2能够分泌 IL-4、IL-5、IL-9、IL-10和 IL-13 等细胞因子,刺激B淋巴细胞的增殖,参与体液免疫应答,对于驱除蠕虫等寄生于细胞外的寄生虫发挥一定功效。此外,Th2还可以诱导M2型肿瘤浸润巨噬细胞的极化,驱动肿瘤发生免疫耐受与新生血管生成,促进肿瘤的进展[11]。
T细胞表达的T盒(T-box expressed in T cells,T-bet)和 GATA 连接蛋白 3(GATA3)分别为 Th1 和Th2的特异性转录因子,在体外实验中发现,调控Th1分化的2个关键分子是IL-12和IFN-γ,IL-12和IFN-γ介导的信号分别通过诱导信号转导和转录激活因子 4(signal transducer and activator of transcription 4,Stat4)和 Stat1 共同激活 TCR,从而增强特异性转录因子T-bet的表达,促进Th1细胞的分化,并在细胞内病毒和细菌感染的免疫应答以及机体的抗肿瘤免疫中发挥重要作用[12]。然而,Th2的分化需要依靠IL-2和IL-4,通过诱导Stat6的表达,进而促进转录因子GATA3的表达增强,极化Th2;另一方面,下调IL-12受体β链的表达,抑制初始CD4+T细胞向Th1方向的极化[13-14]。因此,Th1和Th2分泌的细胞因子既可以相互作用,又可以对自身细胞发挥作用,产生促进分泌细胞因子的能力,在疾病发生、发展中相互调节和影响,见图1(见后插一)。
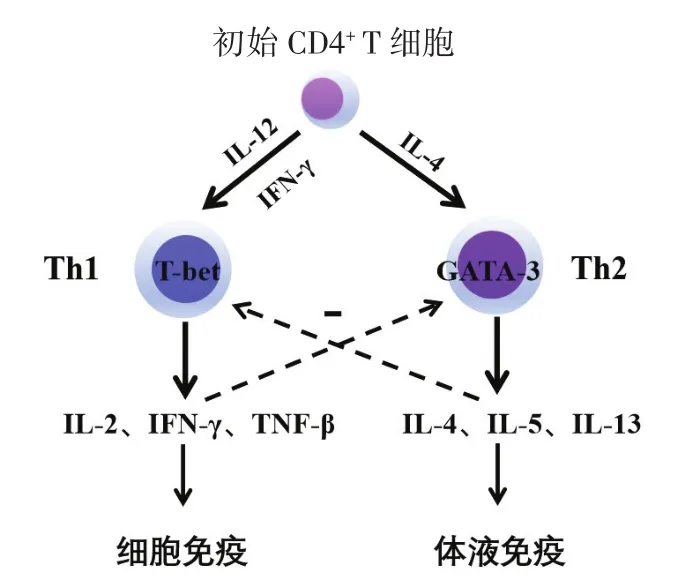
图1 Th1细胞和Th2细胞之间的分化示意图
2.2 Th1/Th2细胞在子宫内膜癌中的作用正常生理情况下,Th1与Th2之间存在着一种平衡状态,一旦机体破坏了这种平衡,就会导致偏向一方,此种现象称为Th1/Th2漂移(Th1/Th2 drift),这种漂移现象的发生可能导致肿瘤的发生。既往的研究表明,肺癌[15]、卵巢癌[16]、宫颈癌[17]等患者中,Th2 型细胞因子比Th1型细胞因子占有明显的优势,机体的免疫反应偏向于Th2型细胞方向转化。郑爱文等[18]研究发现子宫内膜癌患者血清中Th2细胞因子(IL-4、IL-5)升高,血清中Th1细胞因子TNF-α降低,Th1/Th2平衡比值降低,且向Th2偏移,手术切除肿瘤后Th1/Th2失衡可予以纠正。另有研究表明,与健康女性外周血相比,子宫内膜癌患者术前外周血Th1细胞因子TNF-β、IFN-γ基因相对表达量降低,Th2细胞因子IL-4、IL-6相对表达量升高,Th1/Th2比值明显降低[19]。因此,推测子宫内膜癌患者的免疫状态以Th2型体液免疫升高为主要模式,使得Th1细胞因子的抗肿瘤免疫能力被抑制,进而导致子宫内膜癌的发生、发展。通过纠正细胞因子从而恢复肿瘤患者Th1/Th2的漂移,使得初始CD4+T细胞向Th1方向增殖分化,将有助于增强机体的抗肿瘤免疫能力,提高肿瘤患者的治疗效果[20]。目前对于子宫内膜癌中Th1/Th2平衡及相关细胞因子的表达研究尚少,需国内外进一步深入研究。
3 Th17/Treg亚群在子宫内膜癌中的作用
3.1 Th17/Treg的分化调控Th17最早是由学者Harrington等[21]和Park等[22]首先在小鼠体内发现的一种以分泌IL-17为特征的T细胞亚群。IL-6、IL-21和转化生长因子β(TGF-β)存在的条件下共同激活Stat3,诱导维甲酸相关的孤儿核受体γ t(retinoidrelated orphan nuclear receptor γt,RORγt)的表达,从而促进CD4+T细胞分化为Th17。Th17通过产生IL-17A、IL-17F、IL-21和IL-22因子负责清除细胞外细菌(短小棒状杆菌、结核分枝杆菌等)和真菌(包括白色假丝酵母菌等),分泌的IL-17能够刺激多种细胞产生 IL-6、TNF-α、粒细胞集落刺激因子(Granulocyte colony-stimulating factor,G-CSF) 和趋化因子 8(chemokine ligand 8,CXCL8)等趋化因子,动员、趋化中性粒细胞,介导炎症反应。既往的研究表明,Th17参与了包括类风湿性关节炎[23]、银屑病[24]、慢性炎症性脱髓鞘性多发性神经根神经病[25]等多种自身免疫性疾病的发生和发展。Luan等[26]使用抗TNF拮抗剂治疗银屑病患者后,Th1、Th17和Th22的数量显著下降,其相关转录因子和血清中细胞因子的水平也随之下降,患者的临床症状得到明显缓解。对于类风湿性关节炎患者也有学者使用抗TNF-α对其进行治疗,显示出了一定的临床疗效。因此,意识到了促炎细胞因子也可以发挥免疫调节的作用,为将来充分了解自身免疫性疾病的发病机制和设计更好的治疗方案提供了新的视角[27-28]。
Treg是一类具有免疫调节功能的T细胞亚群,活化的Treg能够通过接触抑制的方式抑制T细胞的活化和增殖,分为诱导型Treg(iTreg)与天然Treg(nTreg)两种,对于维持免疫耐受、调节淋巴细胞的稳态和激活以及参与抑制效应T细胞的功能方面都很重要。调节初始CD4+T细胞分化为Th17、Treg的关键因素取决于微环境中不同细胞因子参与的信号通路,其中调节Th17/Treg细胞分化的关键细胞因子是TGF-β和IL-6。Th17和Treg在自身免疫性疾病中的比较见表1。

表1 Th17和Treg细胞在自身免疫性疾病(类风湿性关节炎等)中的比较
3.2 Th17/Treg在子宫内膜癌中的作用研究发现,Th17、Treg除了参与自身免疫性疾病的发生,在多种肿瘤中也有重要作用[29]。Punt等[30]发现,更高活性的Th17和IL-17+的非T细胞数量减少,口咽鳞状细胞癌患者的预后会更好。Kryczek等[31]研究发现,通过IL-17和IFN-γ之间的协同作用,肿瘤微环境中活化的Th17刺激CXCL9和CXCL10趋化因子的产生,从而将效应T细胞募集到肿瘤微环境中,在分期更晚的卵巢癌患者中,肿瘤浸润性Th17的水平和腹水IL-17的水平降低,说明Th17可能通过诱导Th1型趋化因子将效应细胞募集到肿瘤微环境中,从而有助于保护机体的抗肿瘤免疫力。有研究显示在子宫内膜样腺癌患者中,Treg/CD4+T细胞的比值明显高于健康对照组,表明免疫抑制Treg数量的增加可能是子宫内膜癌免疫耐受的原因之一[32]。Zhang等[33]研究表明,与正常对照组比较,子宫内膜癌患者外周血中Th17和Treg的数量以及血清中IL-10的表达水平显著增加;通过免疫组织化学方法观察到子宫内膜癌肿瘤组织中Th17表达比正常内膜组织要高,表明Th17/Treg参与了子宫内膜癌的发生、发展,恢复Th17/Treg的失衡,可能有利于子宫内膜癌患者的免疫治疗。在另一项研究中却发现在子宫内膜癌患者中观察到Treg比例的增加,且增加的部分原因是受绝经后的状态或年龄的影响[34]。因此,子宫内膜癌患者的免疫系统与肿瘤细胞之间的应答关系能够从循环外周血和组织微环境中Th17/Treg比值的异常得到反映,重新平衡Th17/Treg比值可能是子宫内膜癌患者的一种新型免疫增强疗法。
4 Th9/Th22亚群在子宫内膜癌中的作用
4.1 Th9/Th22的分化调控Th9/Th22是近年新发现的T细胞亚群,1994年有学者观察到小鼠的初始CD4+T细胞在一定条件下能够诱导分泌出IL-9[35],随后2008年由Dardalhon等[36]和Veldhoen等[37]在小鼠体内联合TGF-β和IL-4诱导出能分泌IL-9的新型T细胞,2010年在人体中Wong等[38]也观察到这类特殊的T细胞亚群,并将这类不同于Th2的亚群命名为Th9。此后学者们发现TGF-β和IL-4能够诱导初始CD4+T细胞向Th9亚型的转化,且分泌IL-9细胞因子为特征的亚群在肿瘤免疫反应中具有抗肿瘤免疫的能力。除IL-9外,Th9也表达IL-10和IL-21,在各种刺激条件下均可诱导上皮细胞表达CC家族趋化因子配体20(CCL20),而一旦诱导肿瘤细胞CCL20的表达,则可吸引表达CCL20受体6(CCR6)的T淋巴细胞、树突状细胞(dendritic cells,DC)和NK浸润实体肿瘤病灶[39]。此外,一方面Th9能够通过直接分泌、释放颗粒酶B等细胞毒性物质直接杀伤肿瘤细胞;另一方面,Th9能间接提高DC、CD4+CD8+双阳性 T(double positive T,DP T)细胞的存活周期和促进其增殖的能力,分泌的IL-9、IL-21还能诱导CD8+CTL的细胞毒性应答,增强抗肿瘤免疫反应,并在控制恶性细胞转化中起到了关键作用,Th9中促进IL-9和IL-21产生的信号通路及Th9抗肿瘤免疫的功能机制见图2(见后插一)。与传统的CD4+T细胞分化成Th亚群不同,Th9在特定的分化条件下,还具有一定的可塑性,即iTreg和其他T细胞亚群能够在一定的条件下转化成Th9,见图3(见后插一)。
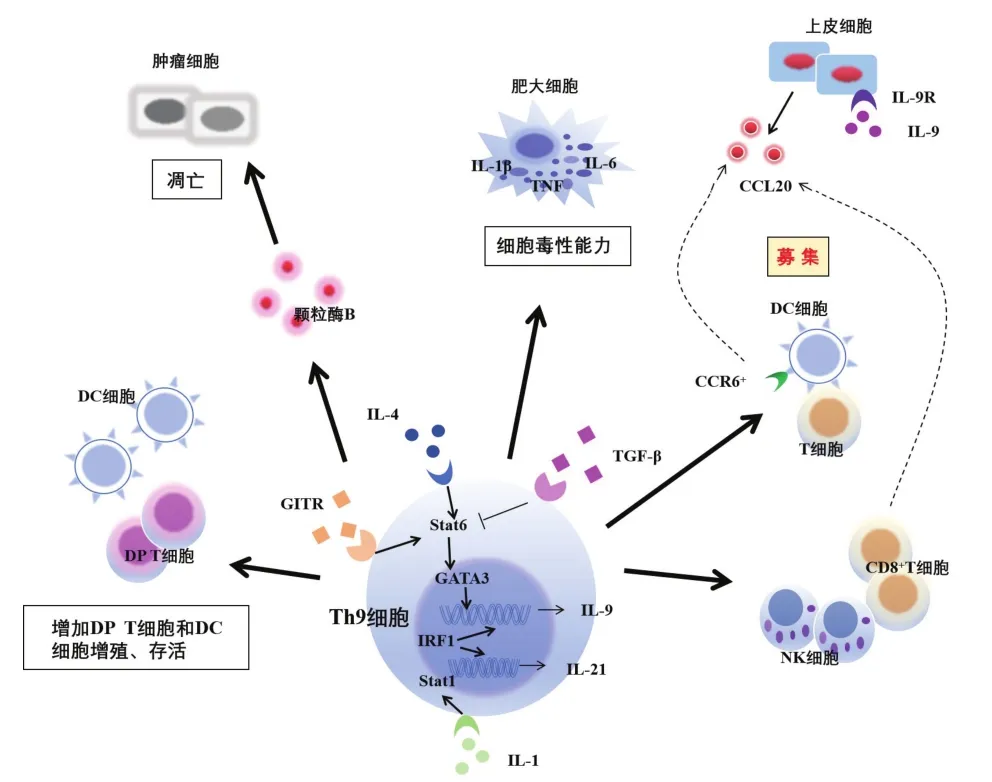
图2 促进Th9分泌产生IL-9和IL-21的信号通路及Th9抗肿瘤免疫的功能
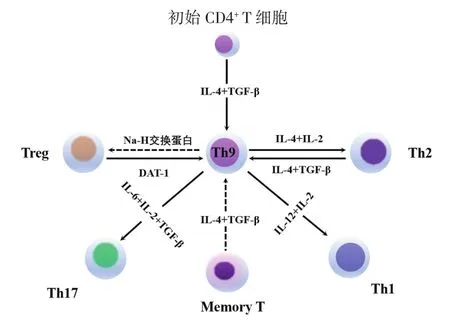
图3 Th9的来源、分化与可塑性
Th22是一种以高水平分泌IL-22细胞因子为特征[40],且不分泌IL-17和IFN-γ的T细胞亚群,不受其他免疫细胞的影响和干扰,IL-6和TNF-α因子能够促进Th22的分化,且不需要DC的刺激。Th22的表型特征为CCR6+CCR4+CCR10+,关键的转录调节因子是芳香烃受体(arylhydrocarbon receptor,AHR),分泌的IL-22能够结合异二聚体IL-10R2/IL-22R1复合物,进一步激活Janus激酶(JAK)/Stat信号通路,介导炎症反应、参与肿瘤的发生过程,对机体的免疫调节和组织修复起重要的作用。CD4+T细胞及亚群的分化、分泌细胞因子及功能效应汇总见图4(见后插一)。

图4 Th的分化、分泌细胞因子及功能效应
4.2 Th9/Th22在子宫内膜癌及其他妇科肿瘤中的作用对于Th9/Th22的研究目前还处于起步阶段,在肿瘤微环境中的分化与调控、促进癌症的发展亦或是抑制肿瘤的转移尚缺乏统一的结论。既往的研究显示,与健康人相比,肝细胞癌患者的外周血中Th9数量和血清中IL-9表达水平要高,且肝细胞癌组织中也比正常肝脏组织存在更多Th9的浸润和IL-9的表达,进一步研究发现Th9可以通过CCL20和Stat3途径在肝细胞癌中发挥促肿瘤作用[41]。也有研究报道了Th9在肺癌、乳腺癌、黑色素瘤等癌症中的抗肿瘤作用[42]。Purwar等[43]发现在进展期黑色素瘤伴有转移病灶患者的外周血和皮肤中,Th9的数量明显降低。Th9通过IL-9和IL-21诱导CD8+CTL细胞介导直接杀伤乳腺肿瘤细胞,提高抗肿瘤免疫力,并在乳腺癌中证明了非典型细胞因子的表达[44]。
Th9/Th22在子宫内膜癌中的具体作用尚未完全了解和报道,仅在妇科肿瘤中见少量报道。Zhang等[45]探究了健康妇女、宫颈上皮内瘤变、宫颈癌患者外周血中Th22数量,发现Th22数量在宫颈上皮内瘤变、宫颈癌患者外周血中高于健康妇女,且在宫颈癌患者中Th22数量的升高与淋巴结转移有关。Wang等[46]发现上皮性卵巢癌患者的外周血中Th22、Th17数量较健康妇女显著升高,血清中IL-22和TNF-α表达水平也明显增加,推测Th22可能参与了上皮性卵巢癌的发生。一项关于外周血Th22与肿瘤相关性的荟萃分析显示,Th22比例的升高与多种肿瘤的发生相关,且对肿瘤的分期具有一定的提示作用,可作为肿瘤患者诊断和预后评价的新型标志[47]。新发现的Th9在宫颈癌发病机制中的作用目前尚未阐明。Chauhan等[48]观察到宫颈癌患者组织活检标本中存在大量PU.1+细胞的浸润和过量IL-9R的表达。经过Th9标志性细胞因子IL-9和IL-21的处理则抑制了宫颈癌HeLa细胞系的增殖,增强了肿瘤细胞凋亡并刺激了HeLa细胞表达MHC-I和上皮型钙黏蛋白(E-cadherin),从而使肿瘤抗原被暴露且无法逃避免疫检查。因此,Th9以及IL-9因子能发挥抑制宫颈癌进展和免疫逃逸的作用。对于Th9/Th22在子宫内膜癌中的作用,目前尚无定论,期待国内外进一步研究。
5 结语
目前子宫内膜癌进展的机制仍然不明确,肿瘤免疫在子宫内膜癌中的相关机制也是近年研究的热点,T细胞亚群的失衡与人类越来越多的疾病密切相关,其之间的关系复杂且重要,不同谱系的T淋巴细胞分化取决于特定的细胞因子信号和转录因子的复杂网络表观遗传修饰,通过探究Th1/Th2、Th17/Treg亚群失衡的发生,还有新发现的Th9、Th22等T淋巴细胞亚群数量的变化,开拓了对肿瘤发生、发展机制的认识,对制定新的治疗对策有着非常重要的临床意义。对于作为女性生殖道三大恶性肿瘤之一的子宫内膜癌而言,通过调节Th亚群之间的比例失衡,纠正平衡关系,逆转漂移状态,以期提高子宫内膜癌患者的生活质量和生存时间,提高对子宫内膜癌进展机制的深入认识,为子宫内膜癌患者的免疫治疗提供理论基础,是妇科肿瘤专家和科研工作者奋斗的目标。

