两种辅料对固态发酵红曲米莫纳可林K与红曲色素产量的影响
史 成, 王 笑, 高嘉欣, 王小璐, 李 鹏, 王昌禄, 陈勉华
(天津科技大学 食品科学与工程学院, 天津 300457)
固态发酵(solid-state fermentation, SSF)是一种经济方便的发酵技术[1],具有操作简便、成本低等优点[2]。红曲霉(Monascusspp.)是传统的食用、药用真菌,在我国有近2000年的应用历史[3-4]。红曲霉以大米为基质,其固态发酵过程可产生多种有益的代谢产物,人们较为熟知的有莫纳可林K(Monacolin K, MK)和红曲色素(Monascuspigments, MPs)。
MK以酸型(MKA)和内酯型(MKL)两种构型存在,MKA能竞争性抑制人体内胆固醇合成途径中限速酶HMG- CoA活性,从而抑制胆固醇合成[5]。MKL 则需要在人体内转化为酸型结构后发挥作用[6]。研究发现,红曲产品中的 MK 与片剂药物中MK相比,前者口服后的溶出度和生物利用度更高[7]。红曲色素主要包括红、黄、橙三类色调的色素,其结构属于聚酮类化合物,具有热稳定性好,安全性高等优点。此外,MPs 还具有抗癌、抗菌、减肥及调节血糖等作用[8-9]。
豆粕和豆渣作为大豆加工后的副产物,富含蛋白质、膳食纤维等成分,具有很高的再利用价值[10-11]。在以往红曲研究中,代谢产物MK与MPs很难做到二者兼得,且以纯大米进行发酵培养成本较高。本实验将豆粕与豆渣作为辅料与大米复配,利用红曲霉在发酵过程中产生的复杂酶系,作用于蛋白质和纤维含量较高的豆粕和豆渣基质,探讨综合提高红曲霉发酵产物中活性物质产量并降低生产成本的可行性,同时研究添加辅料对红曲霉固态发酵产MK及MPs的影响机制,以期为大豆副产物的高附加值再利用和红曲霉发酵生产功能性食品和配料提供新的思路。
1 材料与方法
1.1 菌种与试剂
烟灰色红曲霉MPs- 7 (MonascusfuliginosusMPs- 7),天津科技大学发酵食品与新资源开发实验室。
大米,市售;豆粕、豆渣,天津山海关食品有限公司;Monacolin K标准品,Sigma公司;乙腈、无水乙醇(色谱级),天津康科德试剂公司;无水乙醇(分析级),天津江天化工有限公司;甲酸(色谱级),天津市光复精细化工研究所;NH4NO3、NaNO3、KH2PO4、MgSO4、葡萄糖、蛋白胨,天津市化学试剂一厂。
1.2 仪器与设备
1260型高效液相色谱仪,美国安捷伦科技有限公司;XL- 3型扫描式电子显微镜,日本日立公司;ZWY- 2112D型恒温摇床,上海智诚分析仪器制造有限公司;TDZ5- WS型离心机,湘仪离心机有限公司;KG- AP32L型立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;Kjeltec 8400型福斯全自动凯氏定氮仪,丹麦福斯集团。
1.3 实验方法
1.3.1培养基的配制
麦芽汁斜面培养基:大麦芽粒轻度粉碎,称取250.0 g,加入1 L蒸馏水,60 ℃恒温水浴4 h,过滤后加水稀释糖度至12°Brix,加入3.0 g琼脂,于121 ℃、0.1 MPa条件下灭菌20 min。
种子液培养基:6.0 g葡萄糖、2.0 g蛋白胨、1.0 g NaNO3、1.0 g KH2PO4、0.5 g MgSO4溶于100 mL蒸馏水并分装至250 mL锥形瓶中,8层纱布和牛皮纸封口,于 121 ℃、0.1 MPa 条件下灭菌20 min。
固态发酵培养基:25.0 g大米和蒸馏水按质量比1∶1在室温下浸泡12 h,将水沥干后装入组培瓶中,添加12 mL蒸馏水,于121 ℃、0.1 MPa条件下灭菌20 min。
添加辅料的固态发酵培养基:在控制总干基质量不变(即辅料与大米共计25.0 g)的条件下,将豆粕、豆渣两种辅料粉碎添加至固态发酵培养基中,添加量梯度分别为质量分数5%、10%、15%、20%、25%,加入相同质量的蒸馏水,在室温下浸泡12 h,沥干后装入组培瓶中,添加12 mL蒸馏水。于121 ℃、0.1 MPa条件下灭菌20 min。
添加无机氮源的固态发酵培养基:25.0 g大米和同质量的蒸馏水在室温下浸泡12 h,将水沥干后装入组培瓶中,添加事先溶解NH4NO3的蒸馏水12 mL,NH4NO3添加量梯度分别为质量分数0.5%、1.0%、2.0%,于121 ℃、0.1 MPa条件下灭菌20 min。
1.3.2菌种活化
将保存于4 ℃冰箱的菌种在超净工作台进行活化转接,30 ℃培养箱培养48 h。
1.3.3种子液的制备
将灭菌后的无菌水在超净工作台内倒入活化好的菌种斜面中,用无菌接种环轻轻刮下孢子制成孢子悬浮液,转接至种子液培养基中,30 ℃、180 r/min恒温摇床培养36 h,用血球计数板法计算其孢子数,调整孢子浓度至106个/mL。
1.3.4固态发酵培养
摇床振荡培养活化后的种子液用双层纱布过滤菌丝体后,注入固态发酵培养基和添加辅料的固态发酵培养基中,每瓶注入10 mL种子液,先置于30 ℃下培养7 d后,再于25 ℃培养14 d。每组样品进行5次平行实验。
1.3.5固态发酵基质原料蛋白质含量的测定
分别称取1 g(精确到0.01 g)大米、豆粕、豆渣放入消化管中,加入2片消化片、12 mL浓硫酸,420 ℃消化1 h后置入福斯全自动凯氏定氮仪定氮。每组样品做3次平行实验。
1.3.6MK及MPs的提取
60 ℃烘干发酵产物后称重,记录数据。将发酵产物磨粉后过200目筛。准确称取0.50 g加入10 mL离心管中, 料液比(g/mL)为1∶20,按照体积比4∶3∶3分3次加入体积分数75%乙醇溶液超声提取30 min,3 500 r/min离心10 min,将3次上清液合并转移至新的离心管中,得到MK及MPs的提取液。
1.3.7发酵产物色价测定
用移液枪准确吸取1~2 mL提取液,添加体积分数75%的乙醇溶液稀释提取液,采用紫外分光光度计测量吸光度,并使吸光度控制在0.2~0.8,以75%乙醇溶液为参比,选取分别代表黄色(410 nm)、橙色(465 nm)和红色(505 nm)的检测波长测定色价。色价计算见式(1):
S=A×V/m×n。
(1)
式(1)中:S,样品的色价,U/g;A,稀释后的吸光度;V,样品提取液的体积,mL;m,样品质量,g;n,提取液的稀释倍数。
1.3.8MK及MPs定量分析
《上海护理》是上海市卫生局主管、上海市护理学会主办的面向国内外公开发行的综合性护理技术类期刊。是中国科技论文统计源期刊(中国科技核心期刊)、中国期刊全文数据库收录期刊、中国学术期刊综合评价数据库来源期刊、中国学术期刊(光盘版)全文收录期刊、万方数据库全文收录期刊和中文科技期刊数据库全文收录期刊;首届《CAJ-CD规范》执行优秀期刊。
用0.22 μm有机相滤膜过滤提取液至液相小瓶中,待HPLC检测。以峰面积定量分析红曲红、红曲黄色素产量;以MK标准品峰面积为纵坐标,质量浓度为横坐标,绘制标准曲线计算样品中MK的产量。
HPLC检测条件:色谱柱为ZORBAX Eclipse Plus C18(250 mm×4.6 mm,5 μm);流动相为乙腈- 体积分数0.1%甲酸水(体积比60∶40),等度洗脱;二极管阵列检测器;检测波长237、410 nm;柱温25 ℃;流速1 mL/min;进样体积20 μL。
1.3.9两种构型MK标准曲线的绘制
MKL标准曲线:准确称量5 mg MKL标准品(精确至0.000 1 g),用色谱级乙腈定容至10 mL,制作得到500 μg/mL的母液,吸取母液稀释得到100、80、40、20、10、5 μg/mL的系列标准品溶液,用0.22 μm有机相滤器过滤至液相样品瓶中。以HPLC峰面积Y对质量浓度X进行线性回归,得到MKL回归方程为y=63.349x-26.801,R2=0.999,MKL在5~100 μg/mL线性关系良好。
MKA标准曲线:准确称量5 mg MKL标准品(精确至0.000 1 g),用0.1 mol/L的NaOH(体积分数50%乙腈配制)定容至50 mL,50 ℃水浴1 h,超声1 h,用1 mol/L的HCL调节pH值至中性,得到100 μg/mL的MKA母液。吸取母液稀释得到80、40、20、10、5 μg/mL的系列标准品溶液,用 0.22 μm有机相滤器过滤至液相样品瓶中。以HPLC峰面积Y对质量浓度X进行线性回归,得到MKA回归方程为y=65.641x-25.46,R2=0.998,MKA在5~100 μg/mL线性关系良好。
1.3.10扫描电镜观察
截取红曲米横截面,冷冻干燥24 h。用Eiko IB- 3型离子溅射仪喷金,XL- 3型扫描式电子显微镜(20 kV)扫描,观察形态[12-13]。
1.4 数据处理
2 结果与分析
2.1 发酵基质原料含氮量分析
微生物培养过程中氮源对次级代谢产物会有显著影响,过高或过低的C/N值都会对菌体的生长和代谢产生影响[14]。豆粕和豆渣作为大豆加工副产品,均含有丰富的氮元素,因此本实验从固态发酵基质含氮量的角度出发,对基质各原料的含氮量进行测定,结果如表1。

表1 固态发酵基质原料含氮量Tab.1 Determination of nitrogen content in SSF substrate
3种发酵基质中,豆粕含氮量最高,达到(77.71±1.86) mg/g;豆粕是大豆除去油脂及脂溶性成分后的残渣,富含蛋白质[10],是优质的植物蛋白源。豆渣干基含氮量为(43.02±0.85) mg/g;大米含氮量是3种原料中最低的,为(10.93±0.16) mg/g,因为大米中的主要营养成分为碳水化合物,含氮量相对较低。
2.2 添加辅料对发酵产物色价的影响
按照1.3.7方法对不同发酵基质的发酵产物色价进行测定,结果如图1。
红曲霉MPs- 7以大米为固态发酵基质时发酵产物的色价最高,410 nm测定色价达到638 U/g。随着豆粕与豆渣添加量的增加,不同检测波长下发酵产物色价与对照组相比均呈显著下降趋势(P<0.05)。Nimnoi等[15]、Srianta等[16]研究发现相同的趋势。前者以豆粕为唯一底物进行红曲霉固态发酵,其色价较低,仅为22 U/g ;后者以大米、玉米、高粱等不同谷物为唯一发酵基质进行红曲霉固态发酵,发现大米比其他发酵基质色素产量更高。推测色价高低与发酵基质含氮量的多少有关。有研究指出,红曲霉发酵前期会有大量己酸和辛酸合成,在发酵后期利用这两种脂肪酸进一步合成色素,豆粕与豆渣含氮量较高,而氮源过高会限制脂肪酸的生成,无法合成色素,导致色素产量降低[17]。色价仅能初步评价发酵产物中色素混合物的总量,因此采用HPLC进一步对红曲霉发酵产物中的单一色素进行定性和定量分析。
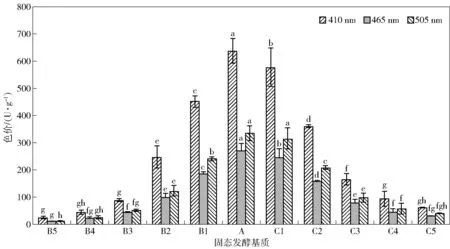
A.大米基质(对照组),B1.添加5%豆粕,B2.添加10%豆粕,B3.添加15%豆粕,B4.添加20%豆粕,B5.添加25%豆粕,C1.添加5%豆渣,C2.添加10%豆渣,C3.添加15%豆渣,C4.添加20%豆渣,C5.添加25%豆渣。不同字母表示相同检测波长下各组间色价差异显著(P<0.05)。图1 添加不同含量辅料对MPs- 7固态发酵产物色价的影响Fig.1 Effect of adding different contents of auxiliary substrate on color value of SSF products by MPs- 7
2.3 发酵产物HPLC分析

图2 发酵样品高效液相色谱Fig.2 HPLC of fermented sample
由于红曲色素在紫外和可见波长范围均有光谱吸收,而MK在237 nm处具有最大光谱吸收,为兼顾色素和MK的检测,采用237 nm检测波长同时对红曲霉发酵产物MK和MPs进行定性分析。图2为添加15%豆粕时发酵产物的高效液相色谱,结合MKA、MKL标准品HPLC洗脱时间以及各洗脱峰相应光谱分析,MPs- 7固态发酵产物中共检测出5种次级代谢产物,按洗脱时间先后顺序,依次为红曲红色素1(R1)、MKA、红曲黄色素1(Y1)、MKL和红曲黄色素2(Y2)。虽然在色价测定时,465 nm处检测色价略低于505 nm处,但HPLC未检测到红曲橙色素成分(依据红曲橙色素的特征吸收光谱判定)。由于红色素在465 nm也存在较大的光谱吸收,黄色素在相应检测波长下无光谱吸收,因此,图1在465 nm的检测结果代表了红色素相对含量,而非橙色素含量,410 nm检测波长则综合反映了红色素和黄色素的相对含量。
2.4 添加辅料对发酵产物MK及MPs产量的影响
红曲霉MPs- 7在以大米为基质进行固态发酵时,未检测出MK;而添加辅料的发酵基质均有MK产出,见图3。MK总产量随豆粕添加量的增加呈先上升后下降的趋势,在添加量为15%时产量达到最大值,为3 177 μg/g;又随豆渣添加量的增加而增加,在添加量25%时产量达到1 908 μg/g。当两种辅料添加量达到15%及以上后,MK主成分由豆粕或豆渣添加量为5%、10%时的内酯型转变为酸型。与大米基质对照组相比,在添加豆粕或豆渣后,3种色素(R1、Y1、Y2)的产量均受到抑制。且在5%~15%添加范围内,相同的添加比例,豆粕比豆渣抑制色素产量更显著(P<0.05)。当豆粕或豆渣添加量超过15%后,色素产量极低。以上实验数据表明:大米基质中适量添加豆粕或豆渣,非常有利于红曲发酵中次级代谢向MK的分流积累,同时降低了色素类次级代谢产物的合成。综合分析MK与MPs两类次级代谢产物,添加15%豆粕辅料最利于红曲霉固态发酵MK的积累,但与此同时MPs产量受到显著抑制;添加15%豆渣,提高MK产量的同时也能产生一定量的色素。由于豆渣本身含水量高,作为大米发酵辅料基质使用时可减少用水量,成本优势突出,在开发含有MK和红曲色素的功能性食品配料时,较添加豆粕综合优势更强。为探索添加豆粕或豆渣辅料对红曲次级代谢产物产量的影响是否与降低发酵基质中C/N值相关,在MPs- 7固态发酵基质中加入无机氮源NH4NO3,分析其对红曲次级代谢产物产量的影响是否与添加豆粕或豆渣辅料一致,结果见表2。
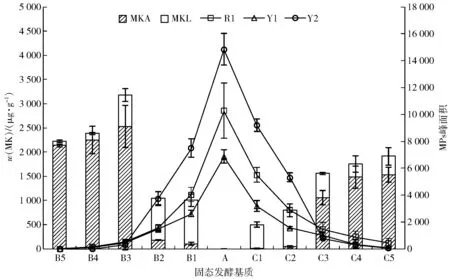
A.大米基质(对照组),B1.添加5%豆粕,B2.添加10%豆粕,B3.添加15%豆粕,B4.添加20%豆粕,B5.添加25%豆粕,C1.添加5%豆渣,C2.添加10%豆渣,C3.添加15%豆渣,C4.添加20%豆渣,C5.添加25%豆渣。图3 添加辅料对MK及MPs产量的影响Fig.3 Effects of adding auxiliary material on yield of MK and MPs
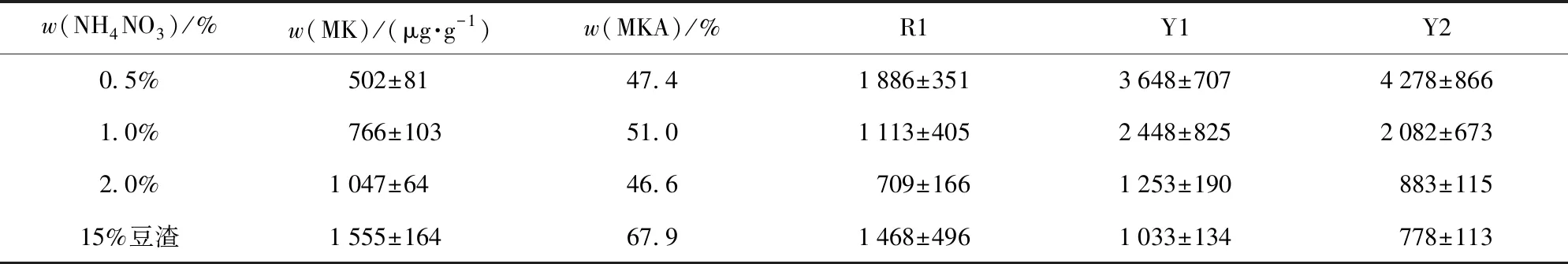
表2 添加无机氮与有机氮对MK及MPs产量的影响

A.大米基质(对照组),B1.添加5%豆粕, B3.添加15%豆粕,B5.添加25%豆粕,C1.添加5%豆渣,C3.添加15%豆渣,C5.添加25%豆渣。图4 固态发酵产物扫描电镜图Fig.4 Scanning electron micrograph of SSF products
综合分析图3、表2发现:无机氮源NH4NO3添加量的增加,显著增加了MK的产量(P<0.05),当添加2.0% NH4NO3时,MK总产量达到1 047 μg/g,而色素产量大幅度下降,与大米基质对照组相比,R1、Y1、Y2峰面积分别下降了93%、82%、94%。该结果与大米基质中添加豆渣或豆粕后对MK和色素的影响效果完全一致,说明大米基质中添加豆渣或豆粕,利于MK积累的同时,抑制色素合成的现象,与其适当降低了发酵基质中的C/N值直接相关。MK与MPs的生物合成都是利用丙二酰辅酶A和乙酰辅酶A进行缩合得到二酮化合物,之后二者的合成途径开始分支[17],适当降低发酵基质中的C/N值,促进MK合成并抑制色素积累,因此推测其调控靶点位于二者共同合成途径分支的下游。众所周知,适当的C/N值有益于微生物生长,但发酵基质中的C/N值截然相反地影响红曲中MK和色素两类次级代谢产物的现象和相关机制研究未见报道。有关糖多孢红霉菌等放线菌氮源代谢中心调控因子(GlnR)在分子水平交叉影响碳源和氮源的代谢走向和次级代谢产物生成的研究成果,可能为揭示红曲发酵基质C/N值影响次级代谢产物合成的分子机制提供参考[18]。
虽然添加无机氮源对代谢产物的影响与添加辅料基质有相同的趋势,但添加15%以上的有机氮源豆渣或豆粕,更利于MKA的积累,提示豆渣或豆粕辅料的添加除了提供丰富的氮源营养因素外,可能其持水能力较强的纤维素成分也为红曲霉的生长创造了有益于MKA合成的微生态环境。
2.5 扫描电镜观察红曲米微观结构
在红曲霉发酵初期,菌丝体主要集中在大米表面,随着发酵时间的推移,菌丝体深入大米基质内部。MK大部分是在菌体内积累,只有少量被分泌到胞外。通过观察发酵产物红曲米横截面菌丝体的生长情况,可以帮助分析发酵基质影响MK产量的原因。
固态发酵产物扫描电镜图如图4。图4(a)为大米基质发酵样品,红曲米内部菌丝体分布稀疏,且量少。有研究指出,基质黏度是影响MK产量的一个很重要的因素,对照组为纯大米基质,淀粉含量高,在发酵过程中更黏稠,容易形成大块,不适合菌丝体生长[19]。图4(b)为添加辅料基质样品。与空白对照相比菌丝体量明显增多。其中豆粕添加量为5%时能够观察到很多分生孢子,菌丝体量并不是很多;当添加量为15%时能观察到大量菌丝体在红曲米内部空间延伸,基质被分割成更小的团块;随着添加量的继续增加,菌丝体密度略有下降。豆渣组样品则随着添加量的增加,菌丝体量也随之增多,当添加量达到15%之后,菌丝体紧密地交织成网状。由此可见,豆粕和豆渣作为辅料添加至培养基中,有利于红曲霉菌丝体生长,且与MK的产量增加呈正相关的关系。
3 结 论
在大米基质基础上,添加不同比例的豆粕、豆渣作为辅料进行复配,均提高了红曲霉发酵产物MK的产量,显著抑制了MPs的产生。在相同添加量的条件下,添加豆粕比豆渣更有利于MK的积累,对MPs的抑制更显著。添加无机氮源同样显著提高MK产量,降低色素产量。说明豆粕或豆渣两种辅料的添加,降低了发酵基质中C/N值是有效提高MK产量的重要原因之一,其更深层面的分子调控机制有待进一步深入研究。本实验探讨了大豆加工副产物用于红曲霉发酵同时生产MK及MPs的可行性,大米基质中添加15%豆渣,提高了MK产量的同时也保证了一定的MPs产量,且成本比豆粕低,更适合开发同时富含MK和MPs的功能性食品配料。
筛选相对高色价并具有生产MK能力的红曲菌株,掌握C/N值截然相反地影响红曲中 MK和色素两类次级代谢产物合成的规律和解析相关调控机制,将为充分利用富含氮源的农副产品,开发兼具MK和高色价的功能红曲色素新产品提供理论支撑。

