桃杏果实内生细菌多样性分析及软腐病原菌的分离与验证
刘晓静, 林 杨, 吕 卓, 李亚玲, 何 欢,李 玲, 朱 璇,*, 张志东,*
(1.新疆农业科学院 微生物应用研究所/新疆特殊环境微生物实验室,新疆 乌鲁木齐 830091;2.新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐 830052)
新疆日照充足、昼夜温差大,利于瓜果糖分累积,是久负盛名的“瓜果之乡”。桃和杏作为新疆的特色水果,果肉鲜美,富含多种维生素和矿物质,深受广大群众的喜爱。然而,由于桃和杏的鲜果成熟期较为集中,采后易腐败变质,严重制约了其生产、销售和新疆特色林果业的发展[1-3]。
细菌在瓜果腐烂中发挥了不能忽视的作用,多种瓜果腐烂与致病细菌有关[4]。周胜虎等[5]发现,腐烂的水果中存在产纤维素的细菌;张大为等[6]证明了软腐柑橘中的主要细菌为葡糖杆菌属;戴宝玲等[7]利用高通量测序技术,发现草莓表面存在大量与植物软腐病有关的细菌。此前,桃杏的软腐多认为是外部菌株侵染果实导致[8-10],而对其内生菌在采后软腐中潜在作用了解较少。植物内生菌广泛存在于各种植物体内,并在植物不同生长时期发挥着重要的功能和作用,且其组成存在一定差异[11]。
高通量测序技术可更为准确地反映出微生物的真实组成和分布[12],弥补传统可培养法的不足,已成为微生物研究的热门工具。桃和杏是典型的核果类水果,均存在采后极易软腐变质的问题。本研究拟通过高通量测序技术,分析新疆油桃、库车小白杏采后的主要内生细菌群落组成与多样性;利用传统可培养法对其中的潜在病原细菌进行分离、筛选,并对其致病能力进行验证与分析。希望为进一步从微生物角度阐明桃和杏的贮藏保鲜、软腐病害的防治等相关研究提供参考。
1 材料与方法
1.1 材料与试剂
2019年6月于新疆阿克苏市库车县乌恰镇(E82.8188°,N41.6781°)果园中采集样品。根据转黄率将果实分为青熟期(着色面积小于20%)、转色期(着色面积 40%~60%)和完熟期(着色面积大于80%)三种不同成熟度[1]。选择果实自然成熟,无明显机械伤痕,无病变,且表皮有光泽,颜色、大小、硬度等表观一致的样品,发泡网包裹,装筐、运输。实验组于室温下贮藏(模拟库车小白杏采后售卖时的温度条件),用于软腐病原细菌的分离。
马铃薯葡萄糖琼脂培养基(PDA)、38号培养基(葡萄糖4 g,麦芽浸粉3 g,酵母粉4 g,氯化钠5 g,琼脂18 g,pH值7.2左右),由北京鼎国生物技术有限公司提供。
1.2 实验方法
1.2.1样品的表面消毒
将样品用体积分数为75%的乙醇、3.3%的H2O2分别处理5 min和3 min,无菌水冲洗干净[13]。
1.2.2样品的高通量测序
利用十六烷基三甲基溴化铵法[14]提取油桃、库车小白杏果的DNA,检验其浓度,达标后利用515F和806R引物进行PCR扩增[15-16]。回收产物,送往北京诺禾致源生物信息科技有限公司,对样品16S rDNA V4区进行测序。
1.2.3潜在病原细菌的筛选
样品表面消毒后去皮,利用平板划线法、稀释涂布法(切取病健交界处组织1.0 g加入至9.0 mL体积分数0.85%的无菌生理盐水中,摇匀,稀释梯度为10-3,取100 μL于待测培养基中进行涂布),对发生自然软腐的桃、杏样品中的病原细菌进行分离、筛选。模拟采后条件,于室温下进行培养[17]。观察并记录各细菌的形态特点和数量,对单一菌落进行纯化[18]。
1.2.4潜在病原细菌的分子鉴定
利用细菌菌落克隆法,对桃、杏潜在病原细菌的DNA进行PCR扩增[9]。回收产物,送往北京鼎国生物技术有限公司进行测序。利用EzTaxon 数据库进行比对,下载相似性较高的模式菌株序列,构建系统进化树[19-20]。
1.2.5潜在病原细菌致腐能力的验证
于无菌条件下,采用离体接种法对菌株的致病能力进行测定。使用酒精棉对其表面进行消毒,无菌水冲洗,晾干,用0.1 mL无菌针头挑取小量菌体,将其接种于果肉中(接种深度距表皮2 mm),采用保鲜膜包裹伤口处,于室温下进行贮藏。以接种无菌水的鲜果作为实验阴性对照组(以上每组样品均设置3组重复实验),观察并记录鲜果的发病情况[21]。
1.2.6潜在病原细菌的再分离与比较
利用酒精棉对接种组已发生软腐的鲜果进行表皮擦拭消毒,无菌条件下去皮,并采用划线培养法、稀释涂布法对病灶组织中的微生物进行分离、纯化,经16S rRNA基因序列扩增、测序和序列分析,并与接种菌株进行比较[21]。
2 结果与分析
2.1 内生细菌群落组成分析
利用高通量测序技术对新疆地产油桃、库车小白杏内生细菌群落组成进行分析,结果如表1。共获得原始序列412 105条,过滤掉低质量序列,总数为156 466条。所得序列经聚类比对,以相似度低于97%聚类为1个操作分类单元(operational taxonomic units,OUT),并去除植物体内的线粒体、叶绿体相关序列后,以及序列reads低于200的低频序列, 共获得128个OTU,涉及9个门的117个属。油桃中共包含102个OTUs,库车小白杏共包含47个OTUs。在所有的128个OTUs中,21个OTUs均出现在油桃和库车小白杏果实中。
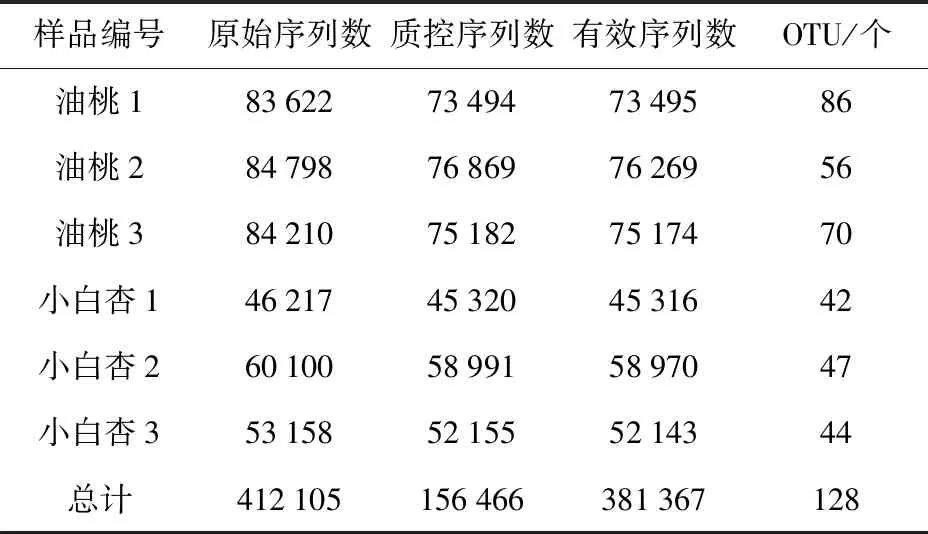
表1 油桃、库车小白杏微生物菌株测序数据统计结果Tab.1 Statistical data of microbial strains in nectarine and Kuqa apricot after sequencing
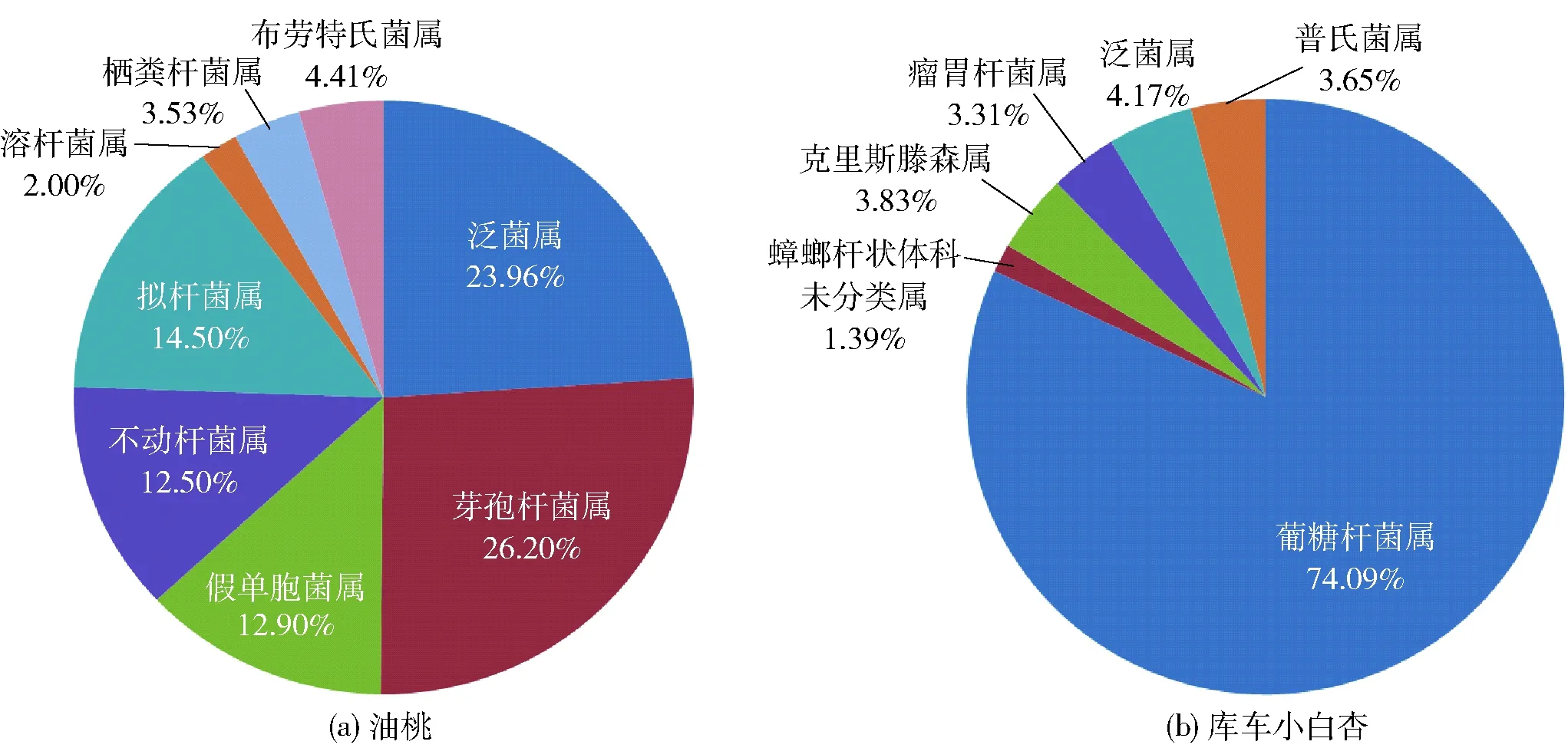
图2 属水平上主要的内生细菌群落组成Fig.2 Main composition of endophytic bacteria communities on genera level
对门水平上油桃、库车小白杏主要内生细菌的种群多样性进行分析,结果如图1。由图1可见,油桃和库车小白杏内生细菌以变形杆菌门为绝对优势菌门,其次为厚壁菌门和拟杆菌门。在属分类单元中,油桃与库车小白杏主要内生细菌群落组成如图2。图2(a)中,油桃内生细菌以泛菌属(Pantoea)、芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、拟杆菌属(Bacteroides)、溶杆菌属(Lysobacter)、栖粪杆菌属(Faecalibacterium)和布劳特氏菌属(Blautia)种群最为多样;其中,芽孢杆菌属和泛菌属为优势菌群,分别约占总菌群的26.20%、23.96%;其次为拟杆菌属、假单胞菌属,分别约占总菌群的14.50%、12.90%,其余菌群所占比例均低于5.00%。图2(b)中,库车小白杏内生细菌以葡糖杆菌属(Gluconobacter)、泛菌属(Pantoea)、瘤胃球菌(Ruminobacter)、蟑螂杆状体科未分类属(unidentifiedBlattabacteriaceae)、克里斯滕森菌(Christensenella)、普氏菌属(Prevotella)种群最为多样;其中,葡糖杆菌属为绝对优势菌群,约占总菌群的74.09%;其次为泛菌属、克里斯滕森属、普氏菌属、瘤胃杆菌属,分别约占总菌群的4.17%、3.83%、3.65%、3.31%,其余菌群所占比例均不足2.00%。
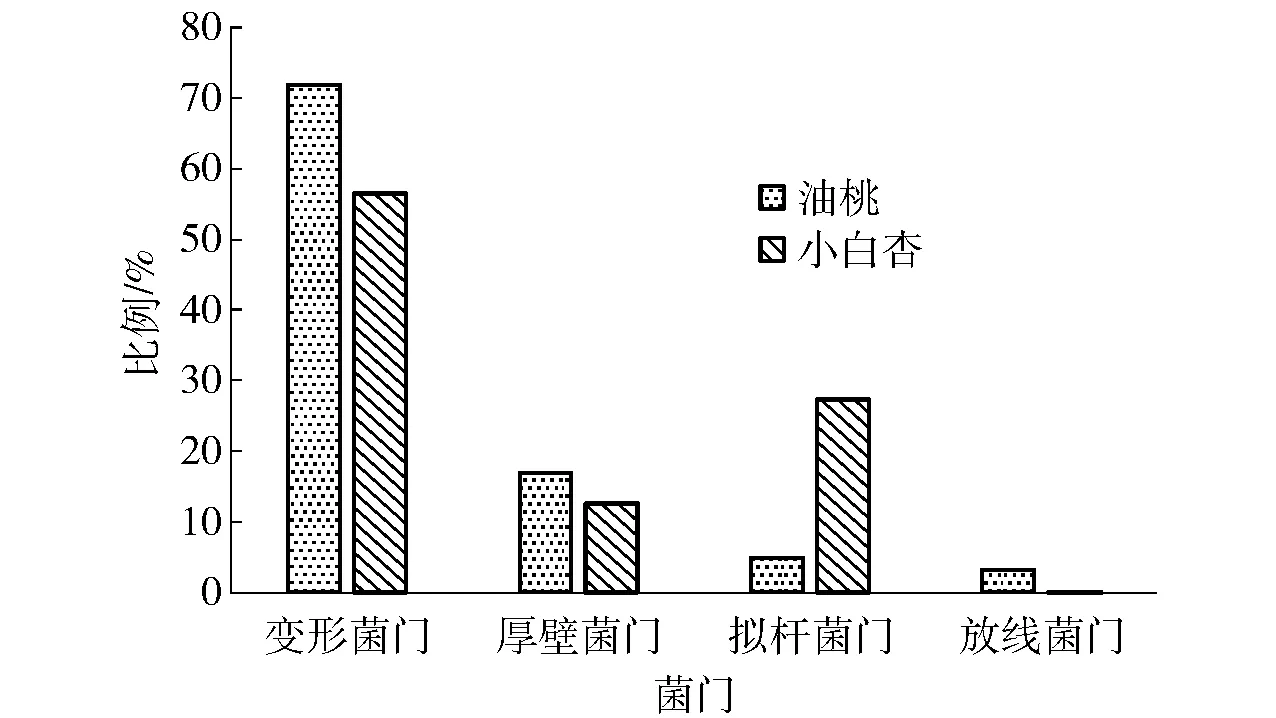
图1 门水平上主要的内生细菌群落组成Fig.1 Main composition of endophytic bacteria communities on phyla level
2.2 潜在病原菌的筛选与鉴定结果
通过对软腐桃和库车小白杏中潜在致病菌的反复分离、纯化、去重,获得了2株油桃潜在病原细菌,分子鉴定结果表明为泛菌属(Pantoea)和芽孢杆菌属(Bacillus);获得了3株库车小白杏潜在病原细菌,分子鉴定结果表明为葡糖杆菌属(Gluconobacter)、泛菌属(Pantoea)和芽孢杆菌属(Bacillus)。获得的病原菌中,1株为油桃和库车小白杏共同的潜在病原细菌,结果如图3。图3中的菌落较小(直径约为1.0~1.5 mm)、圆形、略隆起、边缘整齐、黏稠、呈淡黄色,将其命名为XAAS-P1。经PCR扩增和16S rRNA 基因序列测序及比对,构建该菌株的系统发育树,如图4。确定菌株XAAS-P1归属于泛菌属(Pantoea),其与已知模式菌株PantoeabrenneriLMG 5343T序列相似性为99.49%,与PantoeavagansLMG 24199T序列相似性为99.13%,暂不能确定其具体分类,有待进一步鉴定。

图3 菌株XAAS-P1的形态特征Fig.3 Morphological characteristics of strain XAAS-P1
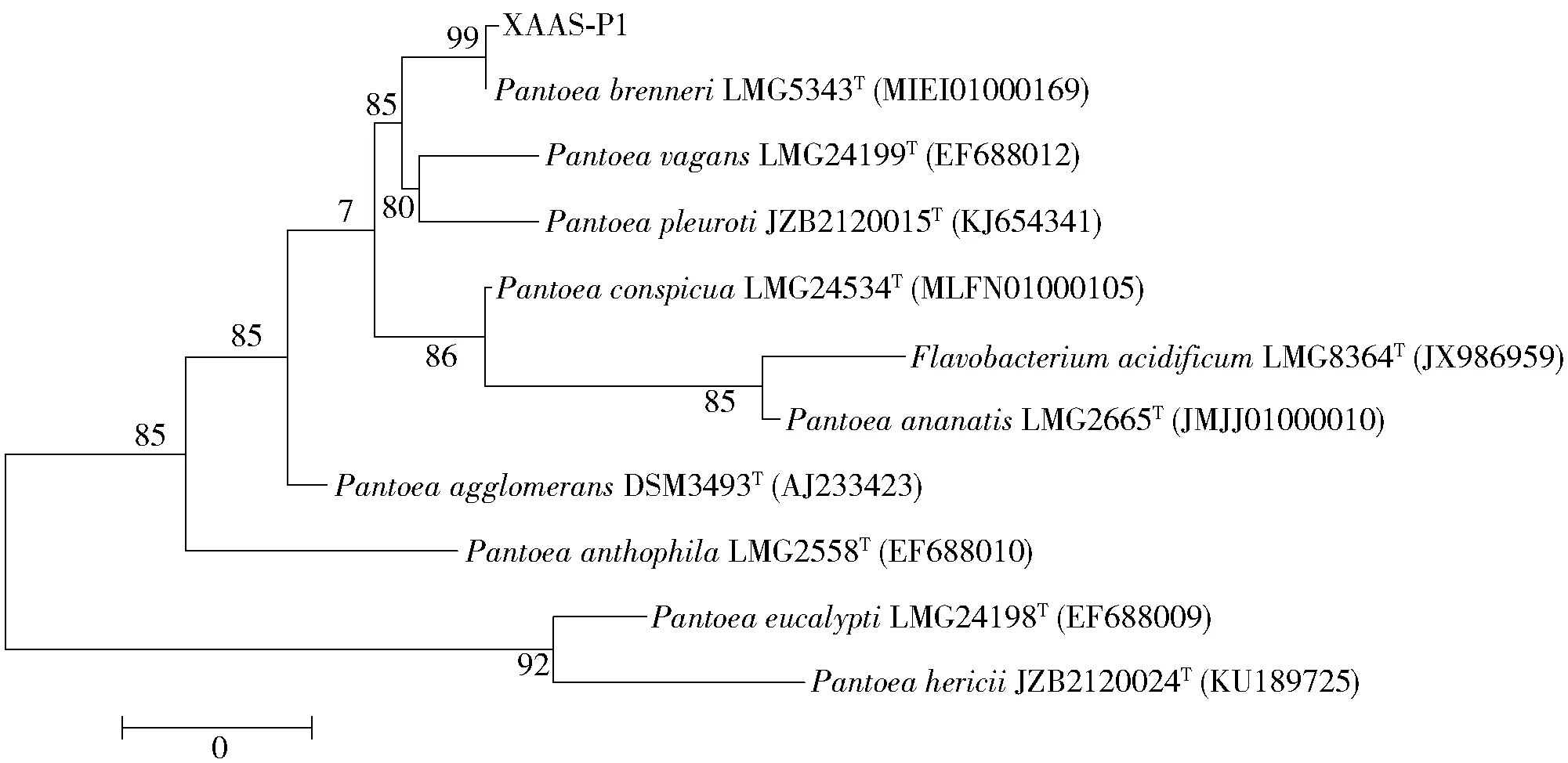
图4 菌株XAAS-P1 的系统进化树Fig.4 Phylogenetic tree of strain XAAS-P1
2.3 潜在病原菌致病能力分析
进一步利用离体接种法对油桃和库车小白杏共同的潜在病原细菌XAAS-P1的致腐能力进行验证,结果如图5。图5显示,菌株XAAS-P1对采后油桃表现出了较强的致腐能力。由图5(a)可知,接种72 h时,油桃出现明显的褐色病斑,并出现失水现象,致腐率为60%;由图5(b)可知,接种96 h时,病斑颜色进一步加深,失水现象明显加重,致腐率达100%。在阴性对照组中,放置96 h时,油桃未观察到明显的病斑和失水现象;且与阴性对照组相比,接种菌株XAAS-P1的油桃提前出现了明显的软腐现象。
研究发现,菌株XAAS-P1对采后不同成熟度的库车小白杏也表现出了较强的致腐能力,实验结果如图6。接种72 h时,不同成熟度的库车小白杏均出现了浅棕色病斑,转色期和完熟期出现轻微的失水现象,致腐率为50%;接种96 h时,青熟期、转色期、完熟期的库车小白杏由浅棕色病斑转为深褐色病斑,致腐率达100%。在阴性对照组中,放置96 h时,库车小白杏仅个别果实出现了轻微的软腐现象,但未观察到明显的失水现象;且与阴性对照组相比,接种菌株XAAS-P1的库车小白杏提前出现了明显的软腐现象,致腐率高达100%。
2.4 潜在病原菌的再分离验证结果
为进一步证实菌株XAAS-P1是否是引发油桃和库车小白杏软腐变质的病原细菌之一,分别对接种组中出现软腐部分的果肉、另一侧未接种但出现软腐的果肉、自然软腐果肉中的微生物进行了分离、纯化,实验结果如图7。对所获菌株的16S rRNA基因序列进行测序和比对分析,结果如表2。由图7和表2可知,菌株XAAS-P1大量分布于3组样品中,且均为3组样品中的绝对优势菌群;因此,实验证明了菌株XAAS-P1是导致采后油桃和库车小白杏软腐病的主要病原细菌。

CK:自然对照组。图5 油桃接种菌株XAAS-P1的致病力分析Fig.5 Pathogenicity analysis of nectarine inoculated strain XAAS-P1

图6 不同成熟期库车小白杏接种XAAS-P1菌后的变化情况Fig.6 Decay incidence of Kuqa apricot inoculated with strain XAAS-P1 in different maturation stages
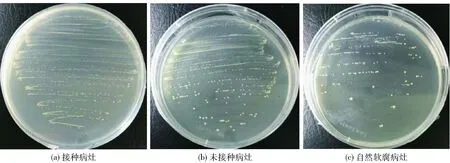
图7 接种组病灶组织划线菌落形态Fig.7 Colony morphology of bacteria from lesion by streaking on PDA

表2 菌株XAAS-P1分子鉴定结果
3 结 论
高通量测序技术目前已成为研究微生物群落组成与分布的重要手段,被广泛用于肠道[22]、植物[23]、土壤[24]等的微生物研究中,也成为内生菌研究的重要方法[25]。近年来,相关研究已从食用玫瑰花瓣[26]、诺尼果[27]、柑橘、番茄[28]、哈密瓜[29]等瓜果的果实和种子中发现存在大量内生细菌,其中,假单胞属、芽孢杆菌属、肠杆菌属、泛菌属、欧文氏菌属、乳酸杆菌属等为主要组成菌群。研究表明,泛菌如成团泛菌、菠萝泛菌、分散泛菌等易引起黄桃罐头[30]、台湾青枣等植物或瓜果的腐烂、变质[31],但有关桃、杏果实中腐败病原细菌的研究较为有限。李昱佳等[32]从桃树枝条中分离得到了泛菌10DM4-1;冯晓师[33]从采后桃果中分离到了菠萝泛菌,猜测其与桃果实褐变有关。现有研究表明,菠萝泛菌可引起多肉植物发生褐腐病[34]、玉米发生细菌性病害[35]。王建辉等[36]也证实,带蓬鲜莲在4℃贮藏条件下的优势腐败菌主要为分散泛菌、成团泛菌和葡萄球菌类菌群,其随贮藏时间的延长呈增长趋势。
本研究采用高通量测序技术证明了新疆地产油桃和库车小白杏果实中存在丰富的内生细菌资源,且假单胞菌属、肠杆菌属、泛菌属、欧文氏菌属、芽孢杆菌属、葡萄球菌属等优势菌群的分布比例在健康果实和软腐果实中存在明显差异,以泛菌属类菌群差异最为明显;同时,采用可培养筛选法对腐烂油桃、库车小白杏中的主要微生物进行了分离。从腐烂油桃中分离获得了泛菌属和芽孢杆菌属的分离株,从腐烂库车小白杏中分离获得了葡糖杆菌属、泛菌属和芽孢杆菌属的分离株,并对所获菌株的致腐能力进行了验证。结果表明,葡糖杆菌属对油桃的致腐能力不明显,但对库车小白杏的致腐能力较强;芽孢杆菌属对油桃和库车小白杏的致腐能力均不明显;而泛菌属对油桃和库车小白杏的致腐能力均较强。重点对泛菌属的致腐能力进行了验证与分析,结果表明:菌株Pantoeasp. XAAS-P1为采后油桃、库车小白杏软腐病灶的优势菌群(约占病灶中微生物菌落分离数的90%左右),且具有较强的致腐能力;接种4 d后,该菌株致腐率可达100%,并呈现出与自然软腐一致的病状。此外,前期对库车小白杏的研究表明,青熟期和完熟期的库车小白杏中均存在泛菌属,且随着库车小白杏的成熟,其所占比例呈倍数增长,最高可增加416倍[13]。本研究证实了泛菌属类菌群是导致油桃和库车小白杏软腐变质的主要病原细菌之一。
实验也发现尽管桃杏中存在丰富的内生菌资源,但分离获得微生物种类较为有限。实际上,不仅仅在内生菌资源挖掘方面存在这类问题,在环境微生物分离筛选中也普遍存在类似的问题,这已成为微生物资源挖掘的瓶颈问题。一般认为,人工培养基营养浓度过高,原有生态关系被破坏,生长缓慢的微生物被忽视,单纯地将待分离样品涂布在分离培养基中,是致使多数微生物表现为不可培养,分离的微生物种类有限的主要原因[37-38]。“不可(未)培养微生物”并不意味着绝对不能被培养,只是其某些生长需求尚不清楚,暂时未能获得纯培养物。微生物培养组学概念的提出,为环境微生物的无漏分离筛选提供了理论依据。近年来,采用高通量测序技术,结合大量筛选与多种筛选培养方法,获得了大量“不可培养”微生物,也有效纠正了相关高通量测序分析的实验偏差[39]。根据本研究的桃杏内生菌高通量测序结果,进一步开发相关内生菌微生物培养组学,从而挖掘更多的微生物资源,并进一步校正相关群落组成等,有待进一步深入研究。

