血小板数量动态变化对脓毒症预后预测价值的初步探讨
宗晓龙 ,韩悦,李婉秋,李浩宇 ,魏殿军 ,李真玉
脓毒症是重症监护病房(ICU)首位致死病因,随着人口老龄化加剧,其发病率呈上升趋势[1]。血小板减少症(thrombocytopenia,TCP)与脓毒症不良结局密切相关,1994年欧洲危重病医学会巴黎脓毒症共识会议上提出的序贯器官衰竭(SOFA)评分将血小板计数(PLT)纳入评分项[2],其评分权重沿用至今。后续研究发现,重症患者进入ICU后PLT变化趋势与临床转归存在关联,进行性血小板减少(progressive thrombocytopenia,PTCP)患者死亡风险增加[3]。当前,关于如何量化PLT动态变化趋势,以及如何应用这一指标对脓毒症预后进行评估仍需进一步探讨。本研究回顾性分析148例脓毒症患者进入ICU后PLT动态变化,结合国际数据库和本地实验室质控数据提出一种简单易行的PTCP定义标准,进而探讨PTCP与脓毒症预后的关联,并评价PTCP对脓毒症28 d病死率的预测价值。
1 对象与方法
1.1研究对象 回顾性研究2018年1月—2019年12月我院ICU收治的脓毒症患者。纳入标准:(1)年龄≥18周岁。(2)符合脓毒症3.0诊断标准[1]。(3)临床及实验室资料完整,临床结局明确。排除标准:(1)合并血液病、恶性肿瘤、风湿免疫性疾病。(2)流行性出血热等引起血小板特异性降低的病毒性疾病。(3)诊断或合并诊断血栓性血小板减少症或肝素诱导血小板减少症。(4)ICU期间应用抗血小板聚集药物治疗。(5)输注血小板或升血小板药物治疗。(6)应用激素类药物者。本研究经医院伦理委员会批准。研究纳入脓毒症患者148例,平均年龄(76.5±12.5)岁,男女比1.85∶1,ICU住院时间11(7,17)d。研究对象按28 d临床结局分死亡组30例,生存组118例。
1.2方法
1.2.1观察终点 以28 d全因病死率为观察终点,若患者28 d内出院,经电话随访确认其生存状况。
1.2.2资料收集 通过电子病案系统收集研究资料。收集患者入院第1、3、5、7、10、14天PLT数据,若指定时间未行血液检测则采用前1 d或后1 d的数据。PLT检测采用中国迈瑞公司BC-6800全自动血液分析仪及相关配套试剂和质控品。首次血小板计数值低于100×109/L时,行人工镜检复核确认。
1.2.3相关定义 TCP依据国家卫生行业标准WS/T 405-2012,《血细胞分析参考区间》定义为入院14 d内PLT最低值<125×109/L。PTCP:关于PLT动态变化参考值,目前尚无公认标准。本研究根据欧洲临床化学和实验室医学联盟(EFLM)推荐的方法确定PLT参考变化值(reference change value,RCV)[4],当PLT降低幅度超过RCV时即定义为PTCP。RCV计算公式为RCV=21/2×Z×(CVA2+CVI2)1/2。其中 CVI为个体生物学变异度,2020年5月13日EFLM更新的血小板CVI为5.6%(95%CI:4.5%~10%)[4],CVA为检测变异度,研究期间本地实验室室内质控PLT项目CVA值为4.5%,P<0.05时,Z=1.96。经计算,适合本地的PLT参考变异临界值为19.9%,与Coskun等[5]报道的20.6%接近。对PLT动态数据初步分析显示,死亡组和生存组于第7天PLT差异有统计学意义,见图1。因此,本研究中PTCP定义为:第7天PLT降低幅度超过基线水平的20%,即(PLTday7-PLTday1)/PLTday1<-0.2。
1.3统计学方法 采用SPSS 22.0软件进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;计数资料组间比较采用χ2检验或Fisher精确概率法;通过二元Logistic回归分析28 d死亡风险因素,自变量进入方式为向后逐步回归法,自变量进入标准为P<0.05,删除标准为P>0.1。绘制受试者工作特征(ROC)曲线,采用曲线下面积(AUC)评价PTCP、SOFA评分以及两者联合的预测效能。采用Kaplan-Meier法进行生存分析。以P<0.05为差异有统计学意义。
2 结果
2.1 患者基本特征 148例脓毒症患者28 d病死率20.3%(30/148),TCP发生率为36.5%(54/148)。死亡组与生存组年龄、男性、常见慢性病史、感染性疾病史、基线白细胞计数(WBC)、中性粒细胞淋巴细胞比值(NLR)、降钙素原(PCT)、D-二聚体(D-dimer)、PLT比较差异无统计学意义(P>0.05)。与生存组相比,死亡组SOFA评分、高值D-dimer(hD-dimer)占比、TCP、PTCP以及PTCP合并TCP发生率显著升高(P<0.01),见表1。
2.2 PLT计数动态变化 患者PTCP发生率为24.4%(30/123)。生存组58.5%(69/118)的患者于入ICU后2周内出院,死亡组1周病死率为33.3%(10/30),2周病死率60.0%(18/30)。血小板数量动态观察显示,PLT计数随病程进展呈双相性波动。病程早期(第1~3天)PLT呈下降趋势,随后逐渐上升,于第5天左右恢复至基线水平。之后死亡组PLT呈进行性下降趋势,第7、10、14天死亡组与生存组PLT计数比较差异有统计学意义(Z分别为3.064,4.387,入123例第7天在院患者,包括死亡组20例,生存组103例。模型1结果显示,校正SOFA评分后,PTCP是脓毒症28 d死亡的独立危险因素(OR=5.145,95%CI:1.772~14.937);模型2和3分别校正TCP和hD-dimer后,PTCP仍然是脓毒症28 d死亡的独立危险因素,见表3。3.892,P<0.01),生存组第10~14天血小板计数升高至基线水平的1.5倍左右,见图1。
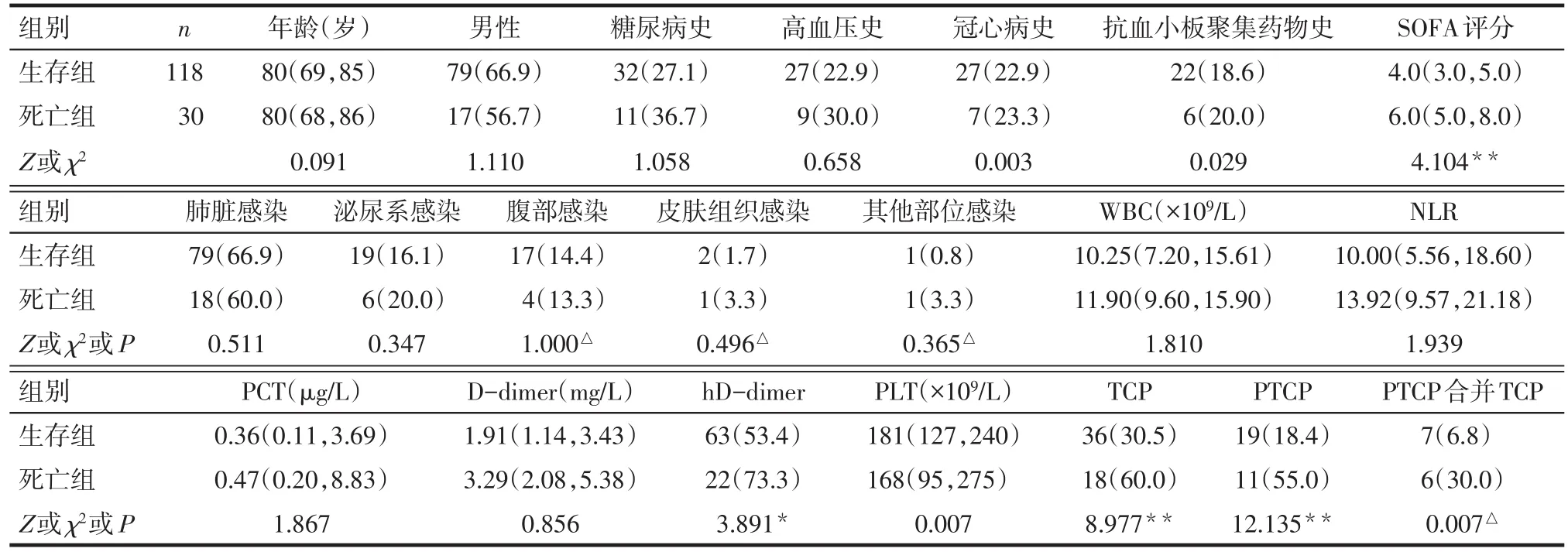
Tab.1 Baseline characteristics and platelet dynamic changes of two groups of patients表1 2组患者基线资料及血小板动态变化
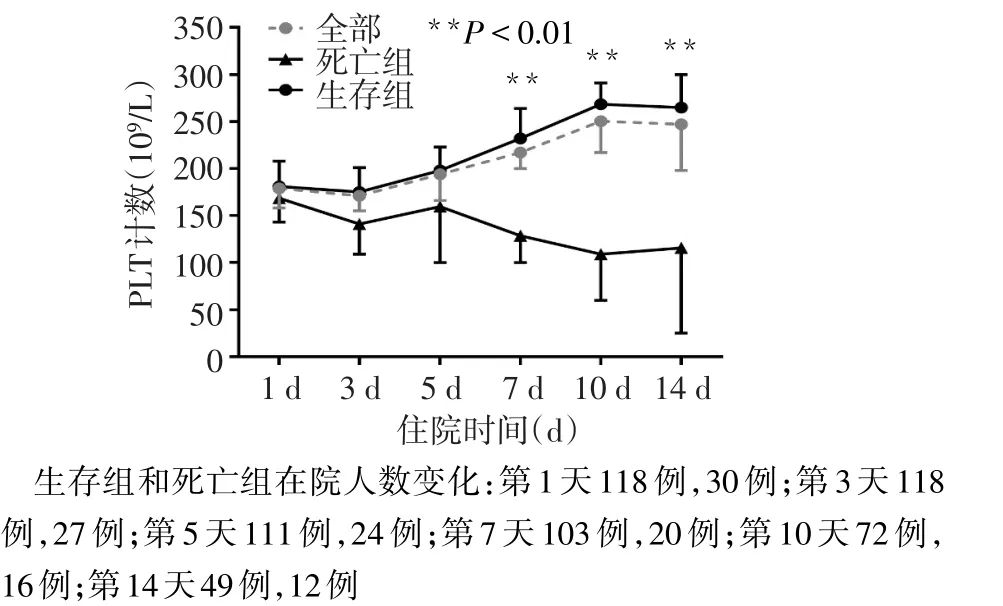
Fig.1 Dynamic changes of in hospital patients and platelet counts图1 脓毒症患者在院人数及血小板计数动态变化
2.3 PTCP预测脓毒症预后的ROC分析 PTCP和SOFA评分预测脓毒症患者死亡风险的AUC分别为0.683和0.691。两者联合时,AUC为0.778,见表2、图2。
2.4 脓毒症患者28 d死亡危险因素分析 以28 d结局(生存=0,死亡=1)为因变量,以D-dimer(D-dimer<2.0 mg/L=0,D-dimer≥2.0 mg/L=1)以及 TCP(未合并=0,合并=1)、PTCP(未合并=0,合并=1)和SOFA评分为自变量进行Logistic回归分析。模型纳
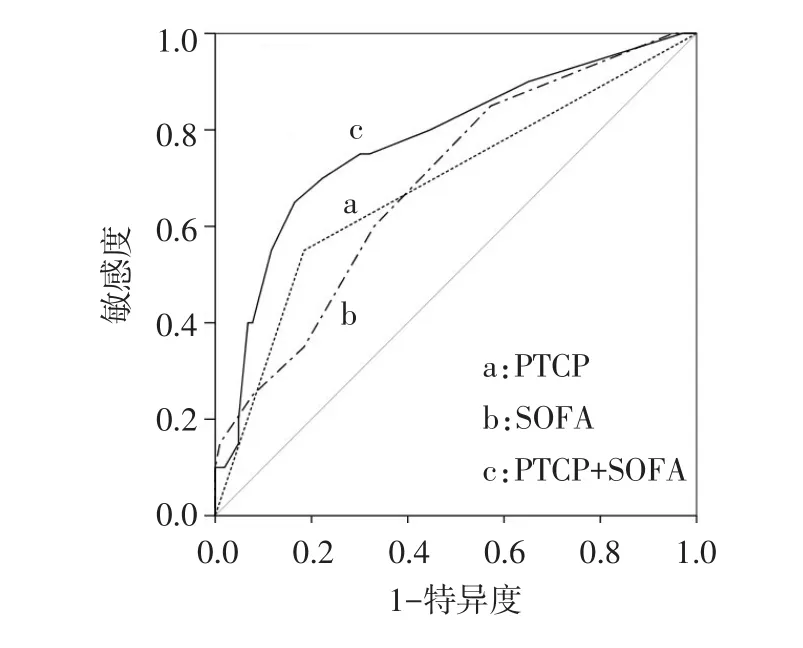
Fig.2 ROC analysis of PTCP in predicting 28-day mortality图2 PTCP预测28 d病死率的ROC分析
2.5 Kaplan-Meier生存曲线分析 根据是否发生PTCP将患者分组,合并PTCP组28 d生存率显著低于未合并PTCP组(63.3%vs.90.3%,Log-rankχ2=7.631,P=0.006),见图3。
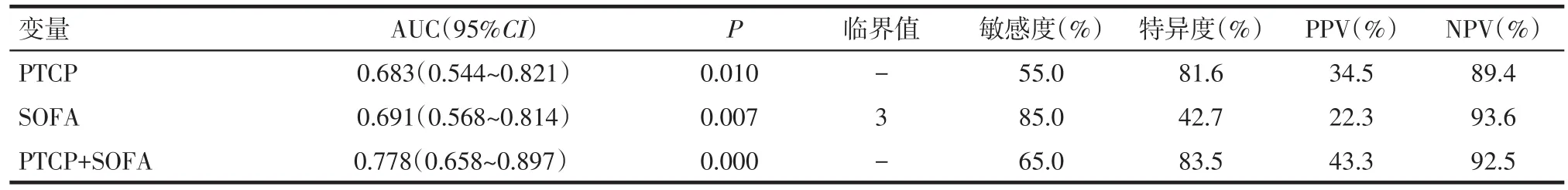
Tab.2 The predictive value of PTCP for the 28-day mortality of sepsis表2 PTCP对脓毒症28 d临床结局的预测价值
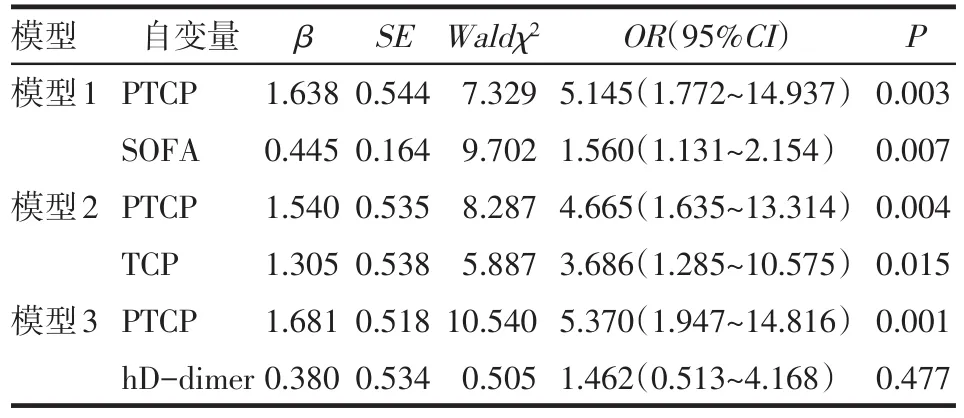
Tab.3 Logistic regression analysis of risk factors for 28-day mortality of sepsis表3 脓毒症28 d死亡危险因素的Logistic回归分析
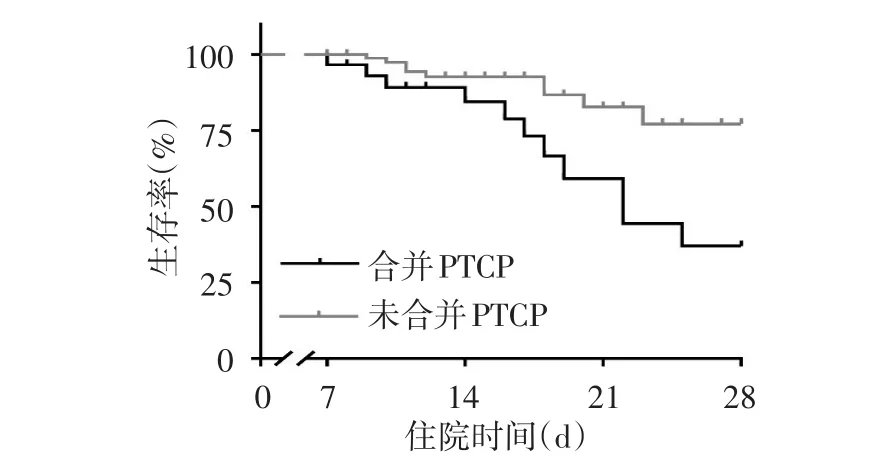
Fig.3 Kaplan-Meier survival curves of patients with and without PTCP图3 合并与未合并PTCP组28 d Kaplan-Meier生存曲线
3 讨论
脓毒症是机体对感染失调的宿主反应,可导致危及生命的器官功能障碍[1]。血小板减少是脓毒症患者常见并发症,其机制包括生成减少、消耗增加、破坏增多、异常分布和血液稀释等[6]。本研究148例脓毒症患者TCP发生率为36.5%,低于Venkata等[7]报道的47.6%,高于Koyama等[8]报道的29.8%。不同报道之间TCP发生率的差异,可能与研究对象异质性和TCP不同的定义标准有关。
本研究脓毒症患者进入ICU后第1~3天生存组与死亡组患者PLT计数均呈现下降趋势,于第3天达谷值,与Vardon-Bounes等[9]和Aydemir等[10]报道一致。2组患者在病程早期(第1~3天)PLT计数同步减少,可能主要归因于感染引起PLT消耗增加[11]以及液体输注导致血液稀释[12]等机制。进一步观察发现,生存组PLT计数于第5天左右开始回升,于第10~14天升高至基线水平的1.5倍左右。鉴于人体巨核细胞产生血小板周期为5 d左右[13],推测生存组PLT计数回升可能与巨核细胞产板周期及新生血小板释放有关。与生存组PLT波动趋势不同,死亡组PLT计数呈持续下降趋势,第7、10、14天2组PLT计数比较差异有统计学意义。Claushuis等[3]研究发现,脓毒症血小板减少与细胞因子上调、内皮细胞活化、血管内皮通透性增强、凝血系统激活等宿主反应表型相关,且这种关联随血小板减少程度加重而增强。据此推测,死亡组患者进行性血小板降低可能归因于持续失调的宿主反应及其导致的器官功能障碍。
本研究以第7天较基线PLT减少幅度超过20%为标准定义PTCP,结果显示,死亡组PTCP发生率55.0%(11/20)显著高于生存组18.4%(19/103);ROC分析显示,PTCP对脓毒症28 d病死率的预测价值与基线SOFA相当,两者联合可提高预测效能,与Strauss等[14]报道一致。研究同时发现,PTCP预测脓毒症28 d病死率的敏感度低于基线SOFA评分,而特异度优于SOFA评分,提示临床可采用基线SOFA评分作为脓毒症死亡风险的预警指标,而PTCP可作为风险升级的参考指标。对于基线SOFA评分较高同时继发PTCP的脓毒症个体,临床应给予足够的关注。报道显示,ICU住院期间PLT降低幅度≥30%[14]或PLT升高延缓(定义为第2~10天PLT日均增幅<30%)[15]对重症患者住院病死率具有中等预测价值。考虑到本研究与既往报道在研究对象、观察周期以及PTCP定义标准方面存在明显差异,未与各研究ROC分析结果进行直接比较。
脓毒症是ICU首位致死病因,SOFA评分是脓毒症预后评估的经典指标[16]。本研究Logistic回归(模型1)结果显示,校正基线SOFA评分后,PTCP是脓毒症28 d病死率的独立风险因素,提示PTCP与基线SOFA评分对脓毒症预后具有联合诊断价值,前文ROC分析结果支持这一推断。与此一致,既往研究发现ICU住院期间PLT减少幅度≥30%是重症患者发生院内死亡的危险因素,且这种关联与基线疾病严重程度无关[7]。Moreau等[17]建议将PLT变化趋势纳入新的预后评分系统。就本研究对TCP和PTCP的定义而言,TCP表示PLT绝对数量减少,而PTCP反应PLT进行性减少的动态趋势。Logistic回归(模型2)分析显示,校正TCP后,PTCP是脓毒症28 d病死率的独立风险因素,提示脓毒症合并PTCP时,无论PLT是否降低至TCP标准,28 d死亡风险显著增加。进行性血小板减少和D-dimer升高是弥散性血管内凝血的信号[18]。需要指出,严重脓毒症常伴随凝血系统激活而纤溶系统抑制,凝血与纤溶失衡导致微循环障碍是脓毒症器官功能损伤的重要病理机制[19]。本研究中脓毒症患者死亡组hD-dimer占比显著升高,Logistic回归(模型3)分析提示hD-dimer水平与脓毒症28 d病死率无关。与本研究结果不同,Semeraro等[20]研究发现,D-dimer是脓毒症90 d临床结局的保护因素。这种差异可能与研究对象疾病严重程度有关,本研究脓毒症患者基线SOFA评分明显低于Semeraro等[20]的研究。
综上,本研究发现PTCP在脓毒症中发生率较高,PTCP对脓毒症28 d生存结局具有一定预测价值,联合基线SOFA评分可提高预测效能;PTCP是脓毒症28 d死亡的危险因素,临床应重视脓毒症患者PLT的动态监测。本研究综合PLT生理变异度和检测不确定度[4]确立了20%的临界值来定义PTCP。需要指出,本研究提出的PTCP定义标准是基于小样本回顾性数据,有待大样本前瞻性研究,对不同的PTCP定义标准进行横向比较,以探究最佳临界值及最优定义方案。

