厄贝沙坦激活PPAR-γ介导AMPK/mTOR通路诱导自噬改善LO2细胞脂肪变
钟娟,雷任国,钟庆荣,覃亚勤,黎洪棉△
随着人们生活水平的提高,近年来我国非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的发病率呈显著增高的趋势,并已超过病毒性肝炎而居肝脏疾病首位,同时患病人群呈年轻化趋势[1]。有研究显示,NAFLD与高血压、糖尿病密切相关,三者可协同增加心脑血管疾病的发生及死亡风险[2]。目前NAFLD的发病机制尚未完全阐明,且无确切有效的治疗药物。血管紧张素受体阻滞剂(angiotensin receptor blockers,ARB)类降压药厄贝沙坦除具有降压作用之外,其作为过氧化物酶体增殖物激活受体 γ(peroxisome proliferator-activated receptor gamma,PPAR-γ)的选择性激动剂,还具有调控瘦素、脂联素、前列腺素等多种激素的分泌,调节糖、脂代谢紊乱,减轻肝脏脂质沉积、改善脂肪肝的作用[3-4]。笔者前期应用先天瘦素受体基因缺失的db/db小鼠NAFLD模型,观察厄贝沙坦对其肝脏脂肪变的疗效及作用机制,研究发现,厄贝沙坦可通过激活PPAR-γ及提高磷酸腺苷依赖的蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)磷酸化表达水平,降低哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)磷酸化的表达,从而诱导自噬,减轻db/db小鼠肝脏脂肪变[3,5]。本研究采用脂混合物(lipid mixture,LM)诱导的LO2细胞模型,并加用PPAR-γ抑制剂进行干预,进一步探讨厄贝沙坦通过调控PPAR-γ介导AMPK/mTOR信号通路,改善NAFLD的作用机制,为NAFLD的防治研究提供实验基础。
1 材料与方法
1.1材料 (1)实验细胞:正常人源肝细胞LO2购于中科院细胞库,冻存于南方医科大学中医药学院分子生物实验室。(2)药物与试剂:厄贝沙坦片(150 mg/片,国药准字J20080061,生产批号5A173)购自杭州赛诺菲制药有限公司;胎牛血清(fetal bovine serum,FBS)购自美国Hyclone公司;DMEM高糖培养基、青链霉素双抗、0.25%胰蛋白酶购自美国GIBCO公司;LM(货号L0288)购自美国Sigma公司;PPAR-γ抑制剂(T0070907)购自Selleck Chemicals公司;兔源一抗PPAR-γ、AMPK、磷酸化AMPK(p-AMPK)、mTOR、磷酸化mTOR(p-mTOR)、LC3B购自美国CST公司;ECL显影液、鼠源一抗β-actin以及HRP标记的羊抗兔二抗、羊抗鼠二抗均购于美国Santa Cruz Biotechnology公司;噻唑蓝(MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、细胞三酰甘油(TG)和总胆固醇(TC)酶联免疫吸附测定(ELISA)试剂盒购自南京建成有限公司。(3)仪器:超净台SW-LG-IF(苏州安泰空气技术有限公司);垂直电泳仪(美国Bio-RAD公司);倒置显微镜XD101型(南京江南光电股份有限公司);microplate reader酶标仪(美国Thermo Fisher Scientific公司);紫外可见分光光度计756型(上海第三分析仪器厂);Kodak Image Station 2000MM成像系统(美国Kodak公司)。
1.2方法
1.2.1细胞培养 LO2细胞用含10%胎牛血清的DMEM高糖培养基培养,加入1%青链霉素双抗,置于5%CO2、37℃无菌培养箱内培养。每48 h换液1次,待细胞融合至80%进行传代,取对数生长期LO2细胞进行后续实验。
1.2.2厄贝沙坦母液配置 精确称取厄贝沙坦42.85 mg,充分溶于2 mL DMSO溶剂中,得到50 mmol/L的厄贝沙坦母液,实验时使用DMEM高糖培养基稀释为所需浓度。
1.2.3MTT检测细胞活性 在96孔板中接种LO2细胞悬液(每孔100 μL,约5 000个细胞),置于培养箱中培养过夜后,弃去培养基,向各孔中加入不同浓度(0、1.25、2.5、5、10、20μmol/L)的厄贝沙坦溶液100 μL,同时设不加细胞只加培养液的孔为空白对照孔。将培养板于培养箱孵育24 h后,每孔加入20 μL MTT溶液,在37℃下孵育4 h,终止培养,弃上清液。后每孔加入200 μL DMSO,在酶标仪上选定490 nm波长,测定各孔的吸光度(A)值。细胞活性率(%)=[A(加药)-A(空白)]/[A(0 μmol/L加药)-A(空白)]×100%。实验重复3次。
1.2.4细胞造模、分组和药物干预 根据MTT检测结果筛选厄贝沙坦最佳作用浓度10 μmol/L进行后续实验。取对数生长期细胞以1×106个/mL的密度接种于培养皿内,采用2.5%的LM诱导LO2细胞,建立细胞脂肪变模型[6]。造模后细胞分为模型组、厄贝沙坦组和厄贝沙坦联合PPAR-γ抑制剂组(联合干预组),另设正常组。模型组细胞继续予含2.5%的LM培养基培养;厄贝沙坦组细胞予含10 μmol/L厄贝沙坦的培养基进行干预;联合干预组细胞予含10 nmol/L T0070907和10 μmol/L厄贝沙坦的培养基培养,具体配置方法如下:先称取T0070907 0.5 mg充分溶于1.8 mL DMSO溶剂中,得到1 mmol/L的T0070907母液,再取2 μL T0070907母液使用10 μmol/L厄贝沙坦培养液稀释至10 nmol/L;正常组细胞采用正常培养基培养,各组细胞给药后再培养24 h。
1.2.5LO2细胞TG、TC含量的检测 培养LO2细胞,将细胞接种于6孔板中,待细胞融合至50%左右,按1.2.4方法进行药物干预后,予0.25%胰蛋白酶消化,制备细胞悬液。将细胞悬液以187×g离心10 min,弃上清液,留细胞沉淀。采用ELISA法检测TG和TC含量,严格按照试剂盒说明书进行操作。
1.2.6LO2细胞油红O染色 取对数生长期LO2细胞,经0.25%胰蛋白酶消化后以1×106个/mL的密度接种于6孔板中,待细胞融合至50%左右,按1.2.4方法进行药物干预后,终止培养,弃细胞培养液,PBS漂洗1次,予4%多聚甲醛固定30 min,之后用新鲜配制的油红O工作液染色15 min,60%的异丙醇漂洗脱色,再用苏木素溶液复染2~3 min,PBS漂洗后观察。应用异丙醇提取细胞,紫外可见分光光度计测定细胞内油脂含量[7]。
1.2.7蛋白免疫印迹法(Western blot)检测LO2细胞PPAR-γ及AMPK/mTOR信号通路相关蛋白的表达 采用RIPA裂解液于4℃提取蛋白,12 000×g离心15 min,所得上清即为提取到的蛋白溶液,采用BCA蛋白定量法测各组蛋白浓度。每孔上样量为20 μg蛋白,行SDS-PAGE分离,然后电转移至PVDF膜上,5%脱脂奶粉室温封闭2 h,PPAR-γ、AMPK、p-AMPK、mTOR、p-mTOR、LC3B、β-actin一抗(1∶1 000)4℃孵育过夜,TBST洗涤3次、每次5 min,按照1∶2 000稀释羊抗兔或羊抗鼠IgG二抗,室温孵育1 h,TBST洗涤3次、每次5 min。ECL显影液曝光,运用Image Station 2000R图像工作站取像。以β-actin为对照内参,目的蛋白/内参蛋白的灰度值作为蛋白的相对表达量。
1.2.8激光共聚焦技术检测LO2细胞LC3B的表达 取对数生长期LO2细胞以1×106个/mL的密度接种于6孔板中,待细胞融合至50%左右,按1.2.4方法进行药物干预后,终止培养,4%多聚甲醛孵育30 min,0.2%Triton-100室温透化15min,5%牛血清白蛋白室温封闭1 h,冷PBS漂洗3次,每次5 min。细胞加入LC3B一抗(1∶50),置于4℃冰箱孵育过夜。加入荧光二抗室温孵育1 h,经PBS漂洗后,予DAPI染液室温作用10 min复染细胞核。LSM710激光共聚焦显微镜下观察、取图,运用Image-Pro Plus 6.0(IPP)软件测量荧光阳性细胞的LC3B平均荧光点数,即总荧光点(dots)/细胞数。
1.3统计学方法 采用SPSS 13.0统计软件进行统计学分析。符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用Tukey法。P<0.05为差异有统计学意义。
2 结果
2.1 厄贝沙坦对LO2细胞活力的影响 MTT检测结果显示,加入0、1.25、2.5、5、10、20 μmol/L厄贝沙坦的 LO2细胞活性率(%)分别为:100.00±0.00、99.40±2.49、95.65±3.24、94.68±4.36、94.80±4.26、72.21±6.30(n=3,F=20.605,P<0.01)。10 μmol/L 及以下浓度的厄贝沙坦对LO2细胞生长无明显毒性作用,20 μmol/L厄贝沙坦对细胞毒性作用较大,表现出明显的抑制作用。
2.2 厄贝沙坦对脂混合物诱导LO2细胞TG、TC含量的影响 模型组LO2细胞内TG和TC含量较正常组明显升高(P<0.05);经厄贝沙坦治疗后,LO2细胞内TG和TC含量较模型组降低(P<0.05);经厄贝沙坦联合PPAR-γ抑制剂干预后,细胞内TG和TC含量较厄贝沙坦组明显升高(P<0.05),与模型组差异无统计学意义,见表1。
Tab.1 The contents of TG and TC in LO2 cells of four groups表1 各组LO2细胞TG和TC的含量(mg/g prot,±s)
Tab.1 The contents of TG and TC in LO2 cells of four groups表1 各组LO2细胞TG和TC的含量(mg/g prot,±s)
**P<0.01;a与正常组比较,b与模型组比较,c与厄贝沙坦组比较,P<0.05
TC 7.14±2.04 24.56±5.31a 14.83±3.43ab 22.79±4.33ac 12.250**组别正常组模型组厄贝沙坦组联合干预组F n3 3 3 3 TG 14.26±2.02 85.78±6.02a 48.52±5.21ab 79.07±5.23ac 135.546**
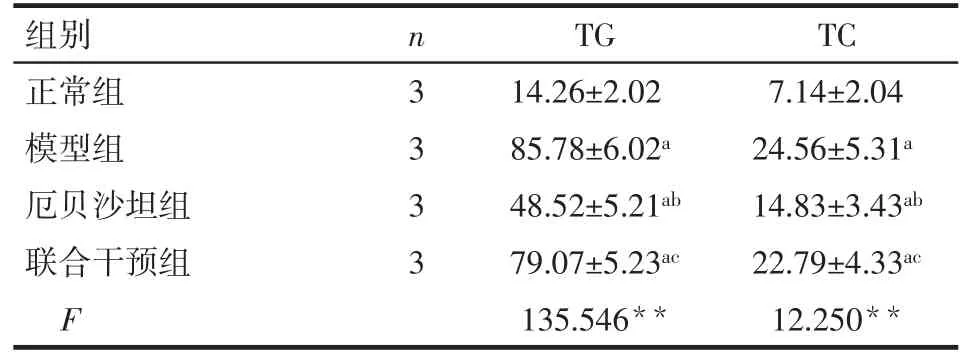
2.3 厄贝沙坦对脂混合物诱导LO2细胞油红O染色的影响 模型组油红O染色可见大量脂质沉积,经异丙醇提取细胞分光光度法分析,模型组细胞内油脂含量明显高于正常组(P<0.05);经厄贝沙坦治疗后,油红O染色显示脂质沉积明显减少,细胞内油脂含量低于模型组(P<0.05);经厄贝沙坦联合PPAR-γ抑制剂干预后,油红O染色显示脂质沉积显著加重,细胞内油脂含量明显高于厄贝沙坦组(P<0.05)。见图1、2。

Fig.1 Quantitative analysis of oil red O staining and oil red O staining in LO2 cells图1 厄贝沙坦对脂混合物诱导LO2细胞油红O染色的影响
Fig.2 Comparison of the lipid content in LO2 cells detected by cell spectrophotometry between the four groups图2 细胞分光光度法检测各组LO2细胞内油脂含量的比较
2.4 厄贝沙坦对脂混合物诱导LO2细胞PPAR-γ介导AMPK/mTOR信号通路的影响 与正常组比较,模型组LO2细胞PPAR-γ和p-AMPK蛋白表达水平降低,p-mTOR蛋白表达水平升高(P<0.05);与模型组比较,经厄贝沙坦治疗后,LO2细胞PPAR-γ和p-AMPK蛋白表达水平升高,p-mTOR蛋白表达水平降低(P<0.05);与厄贝沙坦组比较,经厄贝沙坦联合PPAR-γ抑制剂干预后,LO2细胞PPAR-γ和p-AMPK蛋白表达水平降低,p-mTOR蛋白表达水平升高(P<0.05)。联合干预组与模型组比较差异均无统计学意义,见图3。

Fig.3 Irbesartan activated the PPAR-γ-mediated AMPK/mTOR signaling pathway图3 厄贝沙坦对PPAR-γ介导AMPK/mTOR信号通路的影响
2.5 厄贝沙坦对脂混合物诱导LO2细胞LC3B表达的影响 Western blot和激光共聚焦技术检测自噬标志蛋白LC3B的表达,LC3B蛋白Western blot为双条带,即LC3BⅠ和LC3BⅡ。结果均显示,模型组LO2细胞LC3B蛋白表达水平低于正常组(P<0.05);经厄贝沙坦治疗后,LO2细胞LC3B蛋白表达水平较模型组升高(P<0.05);经厄贝沙坦联合PPAR-γ抑制剂干预后,LO2细胞LC3B蛋白表达水平较厄贝沙坦组降低(P<0.05),与模型组比较差异无统计学意义,见图4~6。
3 讨论
NAFLD是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝脏损伤,是全球最常见的肝病,但至今尚无特效治疗方法。厄贝沙坦在临床上主要用于降压治疗,并可以通过肾素-血管紧张素-醛固酮系统起到肝脏保护的作用。近来大量的实验及临床研究已证实,厄贝沙坦还具有PPAR-γ激动功能,是一种选择性PPAR-γ激动剂,从而增强机体对胰岛素的敏感性,调节糖、脂代谢,可用于NAFLD、代谢综合征、动脉粥样硬化等疾病的治疗[8-9]。
PPARs是核内受体转录因子超家族成员,其存在3种亚型:PPAR-α、PPAR-δ(也称PPAR-β)和PPAR-γ,其中PPAR-γ是被研究最深入的亚型。PPAR-γ的生物学功能复杂多样,包括降血脂和血压,抑制炎症反应,抗纤维化等[10-11]。PPAR-γ是脂肪细胞基因表达和胰岛素细胞间信号传递的主要调节者,参与脂肪细胞分化、转运和贮存。PPAR-γ被激活后,不仅可以通过促进脂肪形成和调节脂肪细胞分泌的蛋白质和细胞因子(如瘦素、脂联素等)的表达来控制脂肪细胞内的脂质动员,而且还可以通过抑制炎性因子和炎性介质的活性来负向调节免疫应答和炎症反应,从而降低脂毒性[12-13]。Kato等[14]研究显示,PPAR-γ激动剂厄贝沙坦通过激活PPAR-γ,降低固醇调节元件结合蛋白-1(sterol regulatory element binding protein-1,SREBP1)表达、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和转化生长因子-β1(transforming growth factor-β1,TGF-β1)的水平,改善胰岛素抵抗和炎症反应,从而减轻肥胖ob/ob小鼠脂肪肝及肝损伤。

Fig.4 Effects of irbesartan on the expression of the autophagosome marker LC3B detected by Western blot assay图4 Western blot检测厄贝沙坦对自噬标志蛋白LC3B表达的影响

Fig.5 Irbesartan increased the expression of LC3B observed by confocal microscopy图5 激光共聚焦技术检测厄贝沙坦对LC3B表达的影响
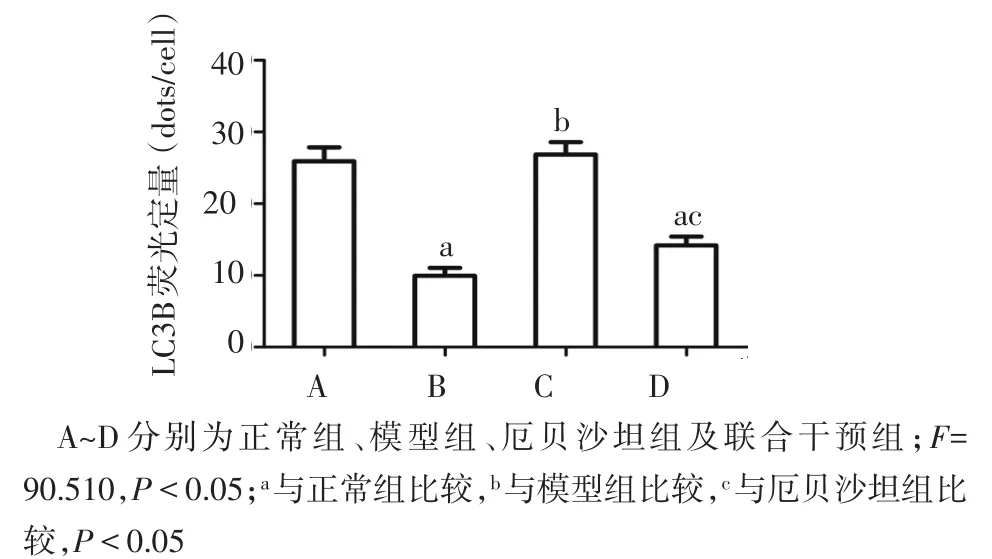
Fig.6 Comparison of LC3B expression levels detected by laser confocal technique between the four groups图6 激光共聚焦技术检测各组LC3B表达水平的比较
AMPK主要在真核细胞生物中发挥“能量调节器”的作用,并参与调节体内糖、脂代谢及胰岛素分泌,在NAFLD发病机制和治疗过程中起到至关重要的作用。既往研究证实,AMPK作为能量感受信号的中继站,可将细胞内的能量信号汇聚至mTOR,当细胞内腺苷三磷酸(ATP)生成减少,p-AMPK可以通过抑制mTOR磷酸化,继而增强自噬,促进分解代谢[15]。自噬是细胞在应激情况下所做出的一种非损伤性应答反应,其通过对自身胞质内物质和(或)细胞器进行包裹吞噬形成自噬体,进一步与溶酶体发生融合形成自噬溶酶体,最终将吞噬物降解。自噬可降解并清除细胞内受损或衰老的细胞器及错误折叠蛋白,从而维持细胞的形态、结构和功能正常以及减缓细胞的衰老。近来研究已证实,自噬除了降解肝细胞内过多或损伤的细胞器和蛋白质外,还介导肝细胞内脂肪的代谢和分解,促进脂滴内贮存脂质的降解[12,16]。因此,自噬的缺失会降低肝脏脂质输出,从而诱导肝脏脂肪变的发生与加重;反之,肝脏自噬被激活,则通过其吞噬作用调节细胞内脂代谢,有助于减轻肝脏脂毒性,从而治疗脂肪肝,并减缓或阻断其向肝纤维化、肝硬化以及其他严重肝损伤的发展。
综上所述,厄贝沙坦防治脂肪肝的作用机制可能与其激活PPAR-γ介导的AMPK/mTOR信号通路,促进肝细胞的自噬有关。

